中国海洋湖沼学会主办。
文章信息
- 梁营芳, 林慧敏, 石芸洁, 邓尚贵. 2016.
- LIANG Ying-Fang, LIN Hui-Min, SHI Yun-Jie, DENG Shang-Gui. 2016.
- 带鱼酶解蛋白亚铁螯合肽对凡纳滨对虾(Litopenaeus vannamei)生长、免疫及品质的影响
- EFFECTS OF HAIRTAIL PROTEIN FERROUS CHELATING PEPTIDE FEED ON GROWTH, IMMUNE PERFORMANCE, AND QUALITY CHARACTERISTICS OF LITOPENAEUS VANNAMEI
- 海洋与湖沼, 47(6): 1257-1262
- Oceanologia et Limnologia Sinica, 47(6): 1257-1262.
- http://dx.doi.org/10.11693/hyhz20160700161
-
文章历史
- 收稿日期:2016-07-27
- 收修改稿日期:2016-08-09
凡纳滨对虾(Litopenaeus vannamei)是世界主要养殖对虾之一, 也是中国主要对虾养殖品种。在集约化养殖过程中, 传染性疾病的暴发是制约对虾养殖效益的主要因素(Karthikeyan et al, 2015; Lin et al, 2015)。药物防病有一定的优势, 但药物残留及病原菌耐药性风险的增加制约了药物的使用, 通过添加提高免疫机能的生物活性物质是营养饲料学的重要研究方向和热点。有关提高养殖对虾的免疫研究, 现有报道集中在微量元素如维生素(Lee et al, 2004)、活性物质如多糖(Wang et al, 2008; Yudiati et al, 2016)以及中草药(Sha et al, 2016)等免疫添加剂对免疫相关指标的影响。
蛋白水解肽能够与生物体内的必需微量金属元素相结合, 从而形成蛋白肽-金属的配合物, 该配合物在提高机体繁殖和生长能力、提高抗病免疫力, 以及对生理代谢的调节等方面具有不可替代的作用(Ashmead et al, 1989)。Lin等(2014)以带鱼(Trichiurus lepturus)为原料, 经过复合酶解和金属螯合方法, 制备了带鱼酶解蛋白的亚铁螯合物[Fe (Ⅱ)-FPH], 实验表明该物质具有较强的清除自由基以及体外抗氧化活性。研究还发现带鱼酶解蛋白亚铁合物对小鼠有抗贫血、抗疲劳、增强体内抗氧化能力的功效(Huang et al, 2015; Lin et al, 2016), 实验还证明带鱼酶解蛋白亚铁合物是相对安全的产品(Li et al, 2016)。目前, 关于金属-水解肽螯合物对于凡纳滨对虾的生长和非特异性免疫、品质影响方面的成果尚未见报道。
本研究在制备Fe (Ⅱ)-FPH基础上, 在养殖对虾饲料中添加Fe (Ⅱ)-FPH, 对养殖凡纳滨对虾的生长指标(特定增长率, 存活率, 增重率和出肉率)、免疫指标(血清和肝胰腺组织中非特异性免疫因子LZM和AKP活性)及质构指标(肌肉硬度、弹性、耐咀性)加以测定, 重点探讨Fe (Ⅱ)-FPH对养殖对虾生长性能、非特异性免疫及品质的影响。以期为Fe (Ⅱ)-FPH在养殖水产动物免疫力调节和品质提高中的应用提供资料。
1 材料与方法 1.1 实验材料带鱼鱼糜由浙江兴业集团有限公司提供。用锯子将冷冻鱼糜分装成100-200 g/袋, 置于-20 ℃冰箱中保存, 使用前一晚放至4 ℃冷藏室中缓慢解冻。木瓜蛋白酶(papain, 酶活力20000 IU/g), 购自上海金穗生物科技有限公司, LZM、AKP试剂盒购自南京建成生物工程研究所。
1.2 Fe (Ⅱ)-FPH制备取解冻后的带鱼鱼糜约50 g, 置于500 mL去离子水中融化, 调节混合浆液的pH至6.5±0.1, 于35-40 ℃下保温10 min后加入木瓜蛋白酶(按20000 U/g比例), 45 ℃水浴、磁力搅拌酶解8h (控制酶解液pH在6.5左右)。于95 ℃的水浴中加热10 min用来钝化木瓜蛋白酶, 将所得水解产物以5000 r/min转速离心20 min, 所得的中间清液即为FPH。将FPH溶液用NaOH溶液(1.0 mol/L)调节至pH=7.0, 添加1 mol/L的FeCl2溶液(按体积的1.0%, 同时加0.1% Vc保护), 于30 ℃的水浴进行振荡30 min, 并于10000 r/min离心15 min, 将所得上清液采用实验室的纳滤膜分离设备截留1000-5000Da分子量的部分, 经冷冻干燥后得灰白色粉末状物质即为带鱼酶解蛋白亚铁螯合肽(记为Fe (Ⅱ)-FPH)。
1.3 对虾饲料的制备及其组成基础配料为: 35.0%鱼粉, 10.0%玉米粉, 15.0%小麦粉, 28.0%豆粕, 2.5%大豆油, 2.5%鱼油, 以及5.0%复合维生素和符合矿物质元素, 2.0%羧甲基纤维素钠。测定结果表明基础饲料营养水平:粗脂肪为6.0%, 粗蛋白为26.5%, 碳水化合物为40.0%, 粗灰分为8.0%。对上述组分加以粉碎至60目并均匀混合, 添加0, 500, 1000, 1500, 2000以及2500 mg/kg的带鱼酶解蛋白亚铁螯合肽, 加少许水均匀搅拌。用双螺杆压条机, 制成颗粒饲料(直径为1.5-2.0 mm), 于55 ℃熟化烘干2 h, 室温晾干后于4 ℃保存备用。
1.4 实验分组和管理实验对虾由舟山海洋研究所虾苗场提供, 挑选规格整齐(8.5±0.3) cm、质量(0.92±0.01) g、活力好的健康活泼的凡纳滨虾960尾随机分为6组, 每个饲料组设置4组重复, 每组重复饲养40对尾, 在试验场内驯养1周以适应环境。在56 d实验期间, 每天3次喂料, 时间分别在8:30、14:30和20:30, 根据对虾的摄食情况来调节投喂率, 日投喂率为对虾体质量的10%-20%。实验养虾用水采用循环过滤水系统, 期间保持充氧, 控制水体pH 7.8-8.0、温度25±0.2 ℃盐度为5.2左右, NH4+水平低于0.005 mg/L, 溶解氧高于6.0 mg/L。
试验分组:第1组对照组:基础饲料饲喂; 第2-6组到为Fe (Ⅱ)-FPH饲喂组:分别以添加500、1000、1500、2000、2500 mg/kg的Fe (Ⅱ)-FPH基础饲料饲喂。
1.5 对虾生长指标的测定及公式于饲养试验第0、28和56天, 将各箱内的对虾分别计数并称重, 计算成活率、增重率、特定增长率和出肉率(X)。
计算公式为:
成活率(%)=成活对虾尾数/实验初投放的对虾尾数×100%。
特定增长率(%/d)=ln (试验末期对虾重量/试验初期对虾重量)/饲养天数×100%。
增重率(%)=(试验末期对虾重量-试验初期对虾重量)/试验初期对虾体重量×100%。
出肉率(%)=对虾肌肉重量/对虾整体重量× 100%。
1.6 对虾生化成分的测定将待测样品称重, 置培养皿中, 于65 ℃下烘干, 置于105 ℃烘箱内烘至恒重, 称重, 并计算其干物质的含量。对虾灰分含量采用GB 5009.4-2010《食品中灰分的测定》测定; 粗脂肪含量使用全自动索氏抽提仪测定; 粗蛋白含量使用全自动凯氏定氮仪测定。
1.7 对虾非特性免疫指标测定血清和肝胰腺中LZM、AKP参照南京建成生物工程研究所试剂盒说明书。所制备样品均在12 h内完成测定。
1.8 质构分析对虾的硬度、弹性和耐咀性的测定采用美国TMS-PRO物性分析仪。质构剖面分析(texture profile analysis, TPA)特性检测参数为:平底柱形探头P/50 (直径50 mm); 选取距离头部3 cm处背部的肌肉组织为测定部位; 测试速度为1 mm/s, 样品的压缩形变量25.0%。
2 结果与分析 2.1 Fe (Ⅱ)-FPH对对虾生长性能的影响Fe (Ⅱ)-FPH饲喂对凡纳滨对虾的成活率、增重率、特定生长率和出肉率的影响见表 1。由表 1可知, 饲喂至第28天, 添加0、500和1000 mg/kg的Fe (Ⅱ)-FPH对对虾的基本生长性能没有显著影响(P > 0.05);随着Fe (Ⅱ)-FPH浓度增加(1500-2500 mg/kg), Fe (Ⅱ)-FPH对对虾的生长表现出显著促进作用(P < 0.05)。与空白组相比较, 1500-2500 mg/kg的Fe (Ⅱ)-FPH提高对虾成活率(3.98%-4.13%)、增重率(5.43%-5.84%)和特定生长率(0.22%-0.39%/d)。饲喂至第56天, 500 mg/kg Fe (Ⅱ)-FPH对对虾的成活率(5.23%)有显著提高(P < 0.05), 但对其增重率、特定生长率及出肉率影响不显著(P > 0.05);添加1000-2500 mg/kg Fe (Ⅱ)-FPH显著提高对虾成活率(8.03%-9.09%)、增重率(5.89%-8.72%)、特定生长率(0.41%d-0.49%/d)和出肉率(1.60%-2.05%) (P < 0.05)。
| Fe (Ⅱ)-FPH (mg/kg) | 成活率(%) | 增重率(%) | 特定增长率(%/d) | 出肉率(%) | ||||||
| 28d | 56d | 28d | 56d | 28d | 56d | 56d | ||||
| 0 | 86.31±2.23a | 75.46±4.19a | 109.63±3.45a | 209.41±5.52a | 2.51±0.26a | 4.24±0.10a | 13.13±1.93a | |||
| 500 | 86.56±3.29a | 79.69±3.69b | 110.51±3.90a | 211.16±5.57a | 2.56±0.64a | 4.47±0.27a | 13.28±2.01a | |||
| 1000 | 87.42±2.34a | 83.48±2.57c | 111.40±2.74b | 215.21±4.16b | 2.60±0.40a | 4.65±0.28b | 14.74±1.53b | |||
| 1500 | 89.67±1.97b | 84.56±3.49d | 115.25±4.51c | 217.96±4.62c | 2.71±0.40b | 4.71±0.26c | 15.03±1.62b | |||
| 2000 | 91.36±1.63b | 84.78±3.09d | 116.28±3.41c | 218.58±5.68c | 2.73±0.68c | 4.67±0.47c | 15.47±1.59c | |||
| 2500 | 89.45±2.11b | 84.35±3.36d | 116.73±3.52c | 218.67±4.57c | 2.83±0.36c | 4.73±0.25c | 16.29±1.93c | |||
| 注:于饲喂第0, 28和56天对各组实验动物的平均生长性能指标分别统计。同一列数据上标不同的小写字母表示差异显著(P < 0.05) | ||||||||||
大量研究表明, 多种不同来源的(分子量较小)水解肽, 通过N端氨基、C端羧基及氨基酸侧链基团与金属元素形成的配合物, 体内外稳定性更佳(Kurzak et al, 2004; Buglyó et al, 2007), 同时表现出较为特殊的生物体内转运机制和生理活性, 例如:激素样活性, 抗菌活性, 酶抑制, 免疫和生理调节功能等(Fisher et al, 2005; Megías et al, 2008)。本实验制备的Fe (Ⅱ)-FPH饲喂对虾, 对其生长性能的影响机制极有可能为:摄入体内的Fe (Ⅱ)-FPH可以通过增强机体的非特异性免疫能力, 从而起到改善其生长活力的效果。
2.2 Fe (Ⅱ)-FPH对实验对虾的生化特性影响由表 2可知, 饲喂开始时, 空白组的干物质、粗蛋白、粗脂肪和灰分的含量依次为43.52%、69.95%、5.22%及15.75%。添加500-1500 mg/kg Fe (Ⅱ)-FPH对对虾的粗蛋白和粗脂肪含量影响不显著(P > 0.05), 2000 mg/kg和2500 mg/kg的Fe (Ⅱ)-FPH对粗蛋白和粗脂肪含量的提高分别为0.62%-0.92%和0.14%-0.17%, 与空白组相比为显著性差异(P < 0.05)。1000-2500 mg/kg Fe (Ⅱ)-FPH饲喂效果对干物质及灰分含量的影响显著(P < 0.05)。由此可知, 在Fe (Ⅱ)-FPH的添加量为2000 mg/kg和2500 mg/kg时, 对于饲喂对虾的基本生化特性指标有显著的提高作用。
| Fe (Ⅱ)-FPH (mg/kg) | 干物质(%) | 粗脂肪(%) | 粗蛋白质(%) | 灰分(%) |
| 0 | 43.52±1.25a | 5.22±1.02a | 68.85±0.86a | 15.75±1.16a |
| 500 | 46.28±1.56a | 5.13±0.78a | 70.04±1.12a | 15.36±1.82a |
| 1000 | 46.77±2.01b | 5.27±1.62a | 70.17±1.07a | 16.50±1.22b |
| 1500 | 47.62±2.32c | 5.25±2.10a | 60.12±1.46a | 16.41±1.89c |
| 2000 | 47.73±2.54c | 5.39±2.24b | 70.56±0.67b | 16.26±2.35c |
| 2500 | 47.90±3.02c | 5.36±1.62b | 70.67±0.67b | 16.33±2.39c |
| 注:于饲喂第56天对各组动物取10尾全虾, 打碎匀浆后测定其生化特性指标; 同一列数据上标不同的小写字母表示差异显著(P < 0.05) | ||||
对虾血细胞吞噬异物后会分泌一些碱性蛋白质, 可以切断细菌肽聚糖中的β-1, 4糖苷键从而破坏细胞壁的支架, 导致细胞胀裂而死亡。这些碱性蛋白质即溶菌酶(LZM), LZM广泛存在于虾体体血清及其他组织液中, 是对虾非特异性免疫系统的主要成分(Bončina et al, 2008), 健康对虾血清中LZM溶菌活力较强, 而濒临死亡的对虾其溶菌活力基本丧失, 因此可以将LZM活力作为检测虾体的免疫状态的参照指标(Liu et al, 2015)。Fe (Ⅱ)-FPH饲喂对对虾血清、肝胰腺组织中LZM活性影响, 见表 3。空白组对虾血清和肝胰腺中, LZM活性为421.0-421.4 U/mL和46.7-48.3 U/mL。饲喂第28天, 1500-2500 mg/kg Fe (Ⅱ)-FPH对于对虾血清和肝胰腺中LZM活性有显著提高(P < 0.05), 分别达457.8-458.3 U/mL和52.0-52.8 U/mL。饲喂第56天, 1000-2500 mg/kg Fe (Ⅱ)-FPH对对虾LZM活性表现出了显著增强作用(P < 0.05)。
| Fe (Ⅱ)-FPH (mg/kg) |
血清中LZM (U/mL) | 肝胰腺中LZM (U/mL) | |||||
| 0d | 28d | 56d | 0d | 28d | 56d | ||
| 0 | 419.4±3.7 | 456.5±2.8a | 458.5±3.7a | 49.4±2.1 | 51.2±1.7a | 52.2±1.9a | |
| 500 | 419.3±3.0 | 456.2±3.1a | 458.6±3.5a | 48.9±1.9 | 50.9±1.8a | 53.3±2.0a | |
| 1000 | 419.6±3.7 | 455.9±3.4a | 459.4±2.9b | 48.8±2.4 | 50.7±2.1a | 54.2±1.7b | |
| 1500 | 419.7±3.9 | 457.8±2.8b | 459.6±3.1b | 49.1±1.8 | 52.0±1.9b | 54.5±2.0b | |
| 2000 | 419.5±3.5 | 458.1±2.9b | 460.8±3.3c | 48.9±1.6 | 52.4±2.1b | 54.1±2.2b | |
| 2500 | 419.8±319 | 458.3±3.4b | 460.7±4.2c | 49.2±1.9 | 52.8±2.1b | 55.4±1.8c | |
| 注:于饲喂第0, 28和56天对各组实验动物取10尾全虾, 分别制备血清和肝胰腺提取液, 测定LZM活性; 同一列数据上标不同的小写字母表示差异显著(P < 0.05) | |||||||
有研究表明, 生物体所必需的微量元素(如Fe、Zn、Ca及Mn等), 可与小肽形成不同结构的螯合物, 这些螯合物形成后, 可有效抵御微量元素与其它物质生成难以溶解的无机盐(Ashmead, 2001), 减少营养物质的损失, 而且小肽类物质也能够增强其吸收利用的效率。从本文结果来看, 当Fe (Ⅱ)-FPH的添加量为1500-2500 mg/kg时, 对对虾的血清及肝胰腺组织中的LZM活性有着显著的提高作用。因此在对虾的基础饲料添加Fe (Ⅱ)-FPH有利于养殖对虾提高机体的非特异性免疫能力, 进而可以抵抗环境污染物、病原体侵染, 提高存活率。
2.4 Fe (Ⅱ)-FPH对对虾AKP活性的影响AKP是巨噬细胞溶酶体的标志酶, 在体内直接参与磷酸基团的转移与代谢, 是参与动物体内免疫活动重要的水解酶类(Pipe, 1990)。Fe (Ⅱ)-FPH饲喂对对虾血清、肝胰腺组织中AKP活性影响, 见表 4。对于对虾血清, 2000-2500 mg/kg Fe (Ⅱ)-FPH可显著增强AKP活力(P < 0.05);对于对虾肝胰腺组织, 1500-2500 mg/kg Fe (Ⅱ)-FPH即可起到显著提高AKP活力的作用(P < 0.05)。
| Fe (Ⅱ)-FPH (mg/kg) |
血清中AKP (U/100 mL) | 肝胰腺中AKP (U/100 mL) | |||||
| 0d | 28d | 56d | 0d | 28d | 56d | ||
| 0 | 2.26±0.09 | 2.44±0.12a | 2.61±0.18a | 6.53±0.31 | 6.88±0.35a | 7.39±0.37a | |
| 500 | 2.24±0.08 | 2.46±0.08a | 2.58±0.19a | 6.51±0.28 | 6.85±0.26a | 7.41±0.34a | |
| 1000 | 2.28±0.06 | 2.40±0.09a | 2.64±0.18a | 6.55±0.27 | 6.83±0.27a | 7.38±0.21a | |
| 1500 | 2.22±0.08 | 2.49±0.06a | 2.64±0.17a | 6.51±0.33 | 6.96±0.33b | 7.45±0.24b | |
| 2000 | 2.26±0.09 | 2.48±0.08b | 2.71±0.18b | 6.51±0.29 | 6.98±0.26b | 7.56±0.31c | |
| 2500 | 2.25±0.07 | 2.52±0.07b | 2.72±0.19b | 6.52±0.31 | 7.12±0.29c | 7.61±0.28c | |
| 注:于饲喂第0, 28和56天对各组实验动物取10尾全虾, 分别制备血清和肝胰腺提取液, 测定AKP活性; 同一列数据上标不同的小写字母表示差异显著(P < 0.05) | |||||||
硬度和弹性是用臼齿第一下咬住样品所施的力, 以及被咬样品恢复至原来状态的程度, 这两者作为关键指标, 一般决定着消费者对水产品的接受程度。在饲料中添加Fe (Ⅱ)-FPH对养殖凡纳滨对虾的质构指标产生的影响, 见图 1。由图可知, 随饲料中Fe (Ⅱ)-FPH添加量的增加, 各项指标均随Fe (Ⅱ)-FPH添加比例的增加而升高。添加Fe (Ⅱ)-FPH量在500-1500 mg/kg时对肌肉硬度、弹性、耐咀性无显著影响, 但当添加2000-2500 mg/kg时则显著优于对照组及500-1500 mg/kg添加组(P < 0.05)。随着饲料中Fe (Ⅱ)-FPH添加比例的升高, 肌肉硬度升高的原因可能是由于虾体摄入Fe (Ⅱ)逐渐增多, 虾体肌肉肌纤维蛋白互相之间合力增强, Fe (Ⅱ)强化了内部组织结构, 因而弹性增强, 硬度加大(Merkin et al, 2014)。
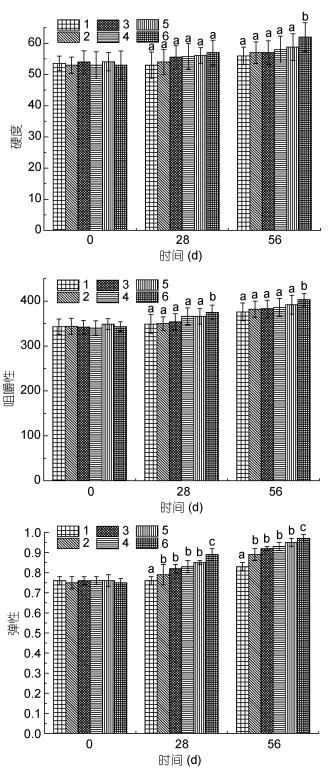 |
| 图 1 饲喂Fe (Ⅱ)-FPH对对虾质构的影响 Fig. 1 Sensible quality characteristics of L. vannamei fed with Fe (Ⅱ)-FPH 注:试验分组: 1.对照组:基础饲料饲喂; 2.添加500 mg/kg Fe (Ⅱ)-FPH饲喂; 3.添加1000 mg/kg Fe (Ⅱ)-FPH饲喂; 4.添加1500 mg/kg Fe (Ⅱ)-FPH饲喂。5.添加2000 mg/kg Fe (Ⅱ)-FPH饲喂; 6.添加2500 mg/kg Fe (Ⅱ)-FPH饲喂。同一列数据上标不同的小写字母表示差异显著(P < 0.05) |
本研究在基础对虾饲料中, 添加了不同浓度带鱼蛋白水解肽-金属配合物(Fe (Ⅱ)-FPH), 考察了Fe (Ⅱ)-FPH对对虾的非特异性免疫增强效果和生长促进作用。研究结果表明500 mg/kg和1000 mg/kg的较低浓度、28d的短时间饲喂Fe (Ⅱ)-FPH, 对凡纳滨对虾的机体生长性能和生化指标, 以及非特异性免疫酶活性的影响均无显著差异(相比于空白对照组)(P > 0.05);而2000 mg/kg以上的高浓度及56 d的较长时间饲喂Fe (Ⅱ)-FPH, 均在一定程度上提升了凡纳滨对虾的生化指标、血清以及肝胰腺中的非特异性免疫酶活性(LZM和AKP)等, 究其原因, 作者认为有可能利用小分子量酶解肽在机体内的特殊转运和吸收的机制, 将酶解肽和金属螯合物一并吸收到特定的靶器官, 增强机体的非特异性免疫能力, 也同时提高了生物体对脂肪、蛋白质及维生素等营养物质的利用效率。同时, 高浓度(≥2000 mg/kg)、较长时间(56 d)的Fe (Ⅱ)-FPH饲喂, 对虾肌肉组织弹性影响较明显, 虾体弹性加大, 水产品品质增强。
| Ashmead H D, 2001. The absorption and metabolism of iron amino acid chelate. Archivos Latinoamericanos De Nutrición, 51 (1 Suppl 1) : 13–21 |
| Ashmead H H, Ashmead D H, Graff D J, 1989.Amino acid chelated compositions for delivery to specific biological tissue sites:U.S., 4863898.1989-09-05 |
| Bončina M, Reščič J, Vlachy V, 2008. Solubility of lysozyme in polyethylene glycol-electrolyte mixtures:the depletion interaction and ion-specific effects. Biophysical Journal, 95 (3) : 1285–1294 DOI:10.1529/biophysj.108.128694 |
| BuglyóP P, Nagy E M, Farkas E, et al, 2007. New insights into the metal ion-peptide hydroxamate interactions:metal complexes of primary hydroxamic acid derivatives of common dipeptides in aqueous solution. Polyhedron, 26 (8) : 1625–1633 DOI:10.1016/j.poly.2006.12.014 |
| Fisher A E O, Naughton D P, 2005. Metal ion chelating peptides with superoxide dismutase activity. Biomedicine & Pharmacotherapy, 59 (4) : 158–162 |
| Huang S B, Lin H M, Deng S G, 2015. Study of anti-fatigue effect in rats of ferrous chelates including hairtail protein hydrolysates. Nutrients, 7 (12) : 9860–9871 DOI:10.3390/nu7125504 |
| Karthikeyan V, Selvakumar P, Gopalakrishnan A, 2015. A novel report of fungal pathogen Aspergillus awamori causing black gill infection on Litopenaeus vannamei (pacific white shrimp). Aquaculture, 444 : 36–40 DOI:10.1016/j.aquaculture.2015.03.021 |
| Kurzak B, Woźna A, Jezierska J, et al, 2004. Copper (Ⅱ) complexes of several monophosphono dipeptides:the role of phosphonic oxygen and thioether sulfur in complex stabilization. Polyhedron, 23 (11) : 1939–1946 DOI:10.1016/j.poly.2004.04.027 |
| Lee M H, Shiau S Y, 2004. Vitamin E requirements of juvenile grass shrimp, Penaeus monodon, and effects on non-specific immune responses. Fish & Shellfish Immunology, 16 (4) : 475–485 |
| Li Y J, Lin H M, Deng S G, et al, 2016. Genotoxicity and acute oral toxicity of peptides ferrous chelates of hairtail protein. International Journal of Clinical and Experimental Medicine, 9 (2) : 4047–4052 |
| Lin H M, Deng S G, Huang S B, 2014. Antioxidant activities of ferrous-chelating peptides isolated from five types of low-value fish protein hydrolysates. Journal of Food Biochemistry, 38 (6) : 627–633 DOI:10.1111/jfbc.2014.38.issue-6 |
| Lin H M, Deng S G, Huang S B, et al, 2016. The effect of ferrous-chelating hairtail peptides on iron deficiency and intestinal flora in rats. Journal of the Science of Food and Agriculture, 96 (8) : 2839–2844 DOI:10.1002/jsfa.2016.96.issue-8 |
| Lin Y C, Chen J C, Chen Y Y, et al, 2015. Crowding of white shrimp Litopenaeus vananmei depresses their immunity to and resistance against Vibrio alginolyticus and white spot syndrome virus. Fish & Shellfish Immunology, 45 (1) : 104–111 |
| Liu H T, Wang J, Mao Y, et al, 2015. Identification and expression analysis of a new invertebrate lysozyme in Kuruma shrimp (Marsupenaeus japonicus). Fish & Shellfish Immunology, 49 : 336–343 |
| Megías C, Pedroche J, Yust M M, et al, 2008. Production of copper-chelating peptides after hydrolysis of sunflower proteins with pepsin and pancreatin. LWT-Food Science and Technology, 41 (10) : 1973–1977 DOI:10.1016/j.lwt.2007.11.010 |
| Merkin G V, Stien L H, Pittman K, et al, 2014. The effect of stunning methods and season on muscle texture hardness in Atlantic salmon (Salmo salar L.). Journal of Food Science, 79 (6) : E1137–E1141 DOI:10.1111/jfds.2014.79.issue-6 |
| Pipe R K, 1990. Hydrolytic enzymes associated with the granular haemocytes of the marine mussel Mytilus edulis. The Histochemical Journal, 22 (11) : 595–603 DOI:10.1007/BF01072941 |
| Sha Y J, Wang L, Liu M, et al, 2016. Effects of lactic acid bacteria and the corresponding supernatant on the survival, growth performance, immune response and disease resistance of Litopenaeus vannamei. Aquaculture, 452 : 28–36 DOI:10.1016/j.aquaculture.2015.10.014 |
| Wang Y C, Chang P S, Chen H Y, 2008. Differential time-series expression of immune-related genes of Pacific white shrimp Litopenaeus vannamei in response to dietary inclusion of β-1, 3-glucan. Fish & Shellfish Immunology, 24 (1) : 113–121 |
| Yudiati E, Isnansetyo A, Murwantoko, et al, 2016. Innate immune-stimulating and immune genes up-regulating activities of three types of alginate from Sargassum siliquosum in Pacific white shrimp, Litopenaeus vannamei. Fish & Shellfish Immunology, 54 : 46–53 |
 2016, Vol. 47
2016, Vol. 47


