中国海洋湖沼学会主办。
文章信息
- 郝贵杰, 林锋, 母昌考, 李荣华, 姚嘉赟, 潘晓艺, 袁雪梅, 沈锦玉, 王春琳. 2016.
- HAO Gui-Jie, LIN Feng, MU Chang-Kao, LI Rong-Hua, YAO Jia-Yun, PAN Xiao-Yi, YUAN Xue-Mei, SHEN Jin-Yu, WANG Chun-Lin. 2016.
- 三疣梭子蟹(Portunus trituberculatus)半乳糖凝集素PtGAL的基因克隆与原核重组表达
- CLONING AND PROKARYOTIC EXPRESSION OF GALECTIN FROM PORTUNUS TRITUBERCULATUS
- 海洋与湖沼, 47(6): 1241-1249
- Oceanologia et Limnologia Sinica, 47(6): 1241-1249.
- http://dx.doi.org/10.11693/hyhz20160700147
-
文章历史
- 收稿日期:2016-07-06
- 收修改稿日期:2016-07-24
2. 农业部淡水渔业健康养殖重点实验室 浙江省鱼类健康与营养重点实验室 浙江省淡水水产研究所 湖州 313001
2. Agriculture Ministry Key Laboratory of Healthy Freshwater Aquaculture, Key Laboratory of Fish Health and Nutrition of Zhejiang Province, Zhejiang Institute of Freshwater Fisheries, Huzhou 313001, China
半乳糖凝集素(Galectins)是生物体内广泛存在的一种保守糖蛋白, 从真菌到哺乳动物均有发现, 也是动物凝集素家族的成员之一(Vasta, 2009), 可特异性识别糖链末端的b-半乳糖苷, 为非膜整合性的可溶性蛋白(Barondes, 1984; 贺雪明等, 2012)。迄今为止, 在哺乳类动物中至少已发现15种不同的半乳糖凝集素, 它们均含有糖识别结构域(carbohydrate recognition domain, CRD), 根据其分子结构不同, 一般被分为3种类型:原型、嵌合型和串联重复型。其中原型只含有1个CRD结构域, 并且会形成非共价结合的同源二聚体; 嵌合型含有1个C端CRD结构域和N端富含脯氨酸和甘氨酸的结构域; 串联重复型含有2个CRD结构域, 中间由一段功能肽段连接(Yang et al, 2008)。近年来, 在软体动物中又发现了一种独特的quadruple-galectin (Song et al, 2011; Maldonado-Aguayo et al, 2014), 其对Galectins家族的结构是一个新的补充。半乳糖凝集素广泛存在于大部分细胞尤其是免疫相关细胞中, 它们通过与细胞表面的糖复合物结合, 在多种生物过程中发挥重要的作用, 如细胞增殖、黏附、凋亡、免疫反应等(秦欣欣等, 2012; Wang et al, 2013)。
随着水生动物免疫学研究的深入, 越来越多的水生动物半乳糖凝集素被发现, 从鱼类(Yang et al, 2013; Zhanget al, 2016)、甲壳类(Shi et al, 2014; Hou et al, 2015)、软体动物(Yamaura et al, 2008; Wei et al, 2012)到海绵(Kawsar et al, 2008)。众多的研究表明, 半乳糖凝集素在脊椎动物和无脊椎动物非特异性免疫中起到重要作用, 尤其是作为模式识别受体(Pattern Recognition Molecular, PRR)发挥抵抗病原微生物的作用(Song et al, 2015)。例如, 中华绒螯蟹(Eriocheir sinensis)的半乳糖凝集素EsGal对多种病原菌具有较强的凝集活性, 而且这种凝集可被D-半乳糖和a-乳糖抑制(Wang et al, 2016); 菲律宾蛤仔(Ruditapes philippinarum)的半乳糖凝集素可结合派琴虫(Perkinsus)和弧菌(Vibrio)表面的半乳糖和N-乙酰半乳糖胺而进行病原菌的识别(Kimet al, 2008)等。然而目前尚未见三疣梭子蟹(Portunus trituberculatus)半乳糖凝集素的相关报道。
三疣梭子蟹隶属甲壳纲(Crustacea), 十足目(Decapoda), 梭子蟹科(Portunidae), 梭子蟹属(Portunus), 因其味道鲜美且营养价值高, 现已成为沿海各省海水养殖的主导产品。然而, 近年来, 由于集约化养殖及养殖环境污染等因素, 导致梭子蟹自身的抗病力下降, 对病害的易感性增加, 疾病频繁发生(王国良等, 2006; 许文军等, 2006; 刘淇等, 2007; 阎斌伦等, 2012)。三疣梭子蟹缺乏特异性免疫系统, 主要依靠非特异性免疫系统进行病原的识别及清除, 已有很多免疫相关分子如模式识别受体及免疫效应因子陆续报道(Pan et al, 2010; Liu et al, 2012; Haoet al, 2015; Li et al, 2016), 但关于三疣梭子蟹半乳糖凝集素的研究却鲜有报道。本研究从三疣梭子蟹转录组数据库中鉴定得到了一个半乳糖凝集素基因EST (命名为PtGal), 对序列进行了末端扩增及生物信息学分析, 并开展了基因表达组织分析及溶藻弧菌刺激响应规律以及重组表达蛋白功能的研究, 以期为三疣梭子蟹分子育种及抗病选育提供依据, 并为认识梭子蟹半乳糖凝集素以及对该分子进化、结构和功能进行深入研究提供资料。
1 材料与方法 1.1 实验材料与试剂实验用三疣梭子蟹为宁波鑫亿鲜活水产有限公司养殖基地人工繁育并养殖, 规格50±3 g, 投喂冰鲜小杂鱼, 每天换水1/3, 于22-25 ℃充气海水中暂养一周后, 选取健康的梭子蟹100只, 有5只蟹分别取肝胰腺、胃、肠等组织快速置于液氮罐中, 其它蟹进行溶藻弧菌感染实验(菌株由宁波大学海洋学院王国良老师惠赠), 并设置对照组, 分别于感染前(即0 h), 感染后3 h、6 h、12 h、24 h、48 h和72 h随机挑取5个个体, 取肝胰腺, 快速置于液氮罐中备用。
实验试剂RNAsimple Total RNA kit、FastQuant cDNA RT Kit (with gDNA)、SuperReal PreMix Plus (SYBR Green)试剂盒购自天根生化科技(北京)有限公司; PrimeSTAR HS DNA酶、TaKaRa LA Taq、3′-Full RACE Core Set with PrimeScriptTM RTase、Agarose Gel DNA Purification Kit、pMD19-T simple vector购自大连宝生物(TaKaRa); Trans1-T1, BL21(DE3)购自北京全式金公司, Ni-Agarose His标签蛋白纯化试剂盒购自康为世纪生物科技有限公司; 其它为国产分析纯。引物合成及序列测定由南京金斯瑞生物科技有限公司完成。
1.2 三疣梭子蟹总RNA提取及cDNA第一链的合成各组织经液氮研磨后取50-100 mg, 按照RNAsimple Total RNA kit试剂盒说明书进行总RNA的提取。用NanoDrop2000超微量分光光度计对RNA进行浓度和纯度测定, 最后各样品统一定量为2 μg, 根据FastQuant RT Kit (with gDNase)试剂盒说明书进行cDNA第一链的合成, 反转录产物用于PCR或qRT-PCR扩增。
1.3 三疣梭子蟹PtGal末端序列的RACE扩增及全长序列的确定在三疣梭子蟹卵巢转录组数据库中筛选到一种半乳糖凝集素基因编码框cDNA序列, 设计用于3’RACE扩增末端PolyA序列的引物PtGal-GSP1和PtGal-GSP2(表 1), 按照TaKaRa 3′-Full RACE扩增试剂盒说明书, 使用3′RACE Adaptor引物进行反转录反应, 再利用引物PtGal-GSP1和3′RACE Outer Primer进行Outer PCR反应, 反应条件为: 94 ℃ 3 min; 94 ℃ 30 s, 55 ℃ 30 s, 72 ℃ 1 min, 20个循环; 72 ℃ 10 min。以第一轮PCR产物为模版, PtGal-GSP2和3’RACE Inner Primer进行Inner PCR反应, 反应条件为: 94 ℃ 3 min; 94 ℃ 30 s, 55 ℃ 30 s, 72 ℃ 1 min, 30个循环; 72 ℃ 10 min。PCR产物回收克隆至pMD19-T后蓝白斑筛选, 阳性克隆送至南京金斯瑞生物公司测序, 所得序列用DNAstar软件拼接获得完整的全长序列。
| 引物名称 | 序列(5′-3′) |
| PtGal-GSP1 | 5′-CCCCACAATACTCCAGTCCCCA-3′ |
| PtGal-GSP2 | 5′-TACTGGGCATTTTGCACTGTGA-3′ |
| qPtGal -F | 5′-GGCTGAGGGTGTGATTGGTCGCA-3′ |
| qPtGal -R | 5′-CTGGAGATGTTGAGGAAGGTGAG-3′ |
| β-actin-F | 5′-ATGTGGACAGATGGGACG-3′ |
| β-actin-R | 5′-CTCACAAATCGGACTTACA-3′ |
| PtGal -BD-F | 5′-CCCATATGATCGCTGGAGGTTTTGCTCCCGG-3′ |
| PtGal -BD-R | 5′-CCTCGAGTTAGTGGTGGTGGTGGTGGTGAACAGTGACATCTTGGCTAGTG-3′ |
半乳糖凝集素基因及氨基酸同源序列从NCBI数据库中获得(http://www.ncbi.nlm.nih.gov/BLAST), 由(http://www.ebi.ac.uk/clustalw/)分析氨基酸序列的一致性。利用ProtParam tool (http://web.expasy.org/protparam/)对半乳糖凝集素等电点pI及分子量(Mw)进行预测; SignalIP4.0 Server (http://www.cbs.dtu.dk/services/SignalP/)查找半乳糖凝集素信号肽; 蛋白质保守结构域的预测由在线软件Simple Modular Architecture Research Tool (SMART)完成(http://smart.embl-heidelberg.de/); N-糖基化位点预测用NetNGlyc 1.0 (http://www.cbs.dtu.dk/services/NetNGlyc/); 用BioEdit进行不同物种半乳糖凝集素氨基酸序列比对。
1.5 实时荧光定量PCR分析(qRT-PCR)应用qRT-PCR检测三疣梭子蟹半乳糖凝集素PtGal转录本的组织分布情况及对溶藻弧菌刺激的反应模式。根据PtGal基因序列设计特异性定量引物qPtGal-F和qPtGal-R, 并选取β-actin基因作为内参基因(引物信息见表 1), 根据SuperReal Premix Plus (SYBR Green)说明书配制qRT-PCR反应体系, 用Mx3005P荧光定量PCR仪(Stratagene公司)进行扩增完成。反应条件为: 95 ℃ 15 min; 95 ℃ 10 s, 58 ℃ 20 s, 72 ℃ 30 s, 40个循环; 72 ℃ 10 min。采用2-ΔΔCt方法处理数据(Livak et al, 2001), 其中ΔCt=Ct (目的基因)-Ct (内参基因), ΔΔCt=ΔCt (感染组)-ΔCt (对照组)。应用SPSS 19.0中单因素方差分析进行显著性分析, P < 0.01表示差异极显著。应用GraphPad Prism 5进行柱状图的制作。
1.6 PtGal的表达和纯化 1.6.1 表达载体的构建根据PtGal序列和pET-21a (+)表达序列的特征, 设计原核表达引物PtGal-BD-F/R (表 1)。上游引物5′端含Nde I酶切位点, 下游引物5′端含Xho I酶切位点。以肝胰腺cDNA为模板进行PCR反应, 将产物纯化后克隆至pMD19-T载体, 筛选阳性克隆并测序。再用常规酶切连接方法构建重组表达质粒pET-21a (+)-PtGal, 转化大肠杆菌BL21(DE3)感受态细胞, 筛选阳性克隆进行测序, 同时保种待用。
1.6.2 重组蛋白的诱导表达及分析取30μL上述保存的菌液, 接种于3 mL LB液体培养基中(含有100 μg/ mL氨苄青霉素), 37 ℃, 250 r/min过夜培养, 第二天取新鲜菌液继续分管培养, 37 ℃ 250 r/min恒温摇至OD600达到0.6-0.8时, 加入终浓度为1 mmol/L的IPTG诱导, 同时设置未诱导组, 分别放至15 ℃摇床培养16 h, 37 ℃摇床培养4 h, 8000 r/min离心收集菌体, 2倍体积PBS重悬菌体, 加入终浓度为1 mg/ mL溶菌酶后超声破碎, 分别取全细胞裂解液及经离心处理的上清和沉淀进行SDS-PAGE分析。
1.6.3 蛋白纯化与LC-MS鉴定37 ℃大量培养重组菌液, 加入终浓度为1 mmol/L的IPTG, 移至15 ℃摇床继续诱导培养16 h并收集菌体。纯化重组蛋白采用Ni-Agarose His标签蛋白纯化试剂盒(可溶性蛋白), 按照试剂盒说明依次进行装柱、平衡、菌体裂解、离心、上柱、冲洗、洗脱等。收集洗脱蛋白液, SDS-PAGE分析纯化效果, 并切下目的条带, 进行质谱鉴定。
1.7 ELISA检测重组蛋白rPtGal与不同细菌及真菌的结合参考王鹏等(2014)的方法略作修改, 所用菌株为革兰氏阳性菌(金黄色葡萄球菌, 枯草芽孢杆菌), 革兰氏阴性菌(溶藻弧菌, 副溶血弧菌, 哈维氏弧菌, 鳗弧菌, 大肠杆菌, 嗜水气单胞菌), 真菌(酵母菌)。具体步骤如下:将各菌株培养到OD600为1.0左右, 并用包被液重悬使其终浓度为5×108 ind/mL。按100 µL/孔将菌液加入96孔酶标板, 4 ℃孵育过夜。用PBST (含0.5 mL/L Tween20的PBS)洗液满孔洗涤3-4次, 每次3-5 min。然后每孔加入200 µL含3% BSA的PBS, 置于37 ℃水浴锅封闭3 h, 同上洗涤。各孔加入不同浓度的重组蛋白PtGal (16µg/ mL倍比稀释至0.5µg/ mL)100 µL, PBS作为阴性对照, 30 ℃孵育2 h, 同上洗涤; 每孔加入100 µL一抗His-tag抗体(1︰1000, V/V), 37 ℃温育1 h, 同上洗涤; 再加入100 µL辣根过氧化物酶标记山羊抗小鼠IgG (H+L)(1︰250, V/V), 37 ℃温育1 h, 同上洗涤; 每孔加入200 µL TMB显色液, 避光孵育10-30 min, 然后每孔加入50 µL 2mol/L硫酸溶液中止反应, 于450 nm测定吸光度, 将至少2倍于对照读数的结果定义为阳性, 结合指数定义为:蛋白的A450读数/PBS的A450读数。
2 结果 2.1 三疣梭子蟹半乳糖凝集素基因PtGal的序列特征根据克隆测序拼接得到PtGal全长为875bp (GenBank登录号: KU648403), 包括5′-UTR 76bp、编码区、3′-UTR 123bp和poly (A)组成, 其ORF编码含有222个氨基酸残基的蛋白(图 1a)。其理论分子量为23529.4Da, 等电点pI为5.21。SMART检索表明该蛋白包含一个半乳糖识别结构域, 位于N端16-142位氨基酸, 靠C端有两个富含脯氨酸/甘氨酸低复杂区, 分别为150-164及195-220位氨基酸(图 1b)。和其它半乳糖凝集素相似, PtGal没有信号肽, 但它有一个潜在的N-糖基化位点(Asn132-Ile133-Ser134-Ser135)。序列同源性在线比对结果显示, PtGal编码的氨基酸序列与其它甲壳类具有较高的相似性, 如与中华绒螯蟹Eriocheir sinensis的相似性为77%, 与凡纳滨对虾Litopenaeus vannamei的相似性为66%, 与日本囊对虾Marsupenaeus iaponicus的相似性为58%。运用BioEdit软件制作PtGal基因编码的氨基酸序列与上述甲壳类氨基酸序列比对图(图 2), 结果显示galectin糖结合区高度保守。
 |
| 图 1 PtGAL的全长cDNA、推导的氨基酸序列及SMART预测的结构图 Fig. 1 The cDNA and deduced a mino acid sequence of PtGAL and the graph predicated by SMART 注: a: ORF区用大写字母显示, 5’UTR和3’UTR用小写字母显示。灰色阴影标示SMART预测的半乳糖结构域。终止子用“*”表示。下划线ATG为起始密码子, TAG为终止密码子; b: SMART预测的结构图, 菱形区为糖结合区域, 粉色区为富含脯氨酸/甘氨酸低复杂区域 |
 |
| 图 2 不同物种Galectin氨基酸序列比对 Fig. 2 Multiple sequence alignment by BioEdit 注:各物种及其GenBank登录号为: Pt:三疣梭子蟹Portunus trituberculatus; Es:中华绒螯蟹Eriocheir sinensis(GI: 294718621); Lv:凡纳滨对虾Litopenaeus vannamei (GI: 540070879); Mj:日本囊对虾Marsupenaeus iaponicus (GI: 387165448);划线处为PtGal糖识别结合区 |
PtGal基因组织表达分析:以β-actin为内参基因检测了PtGal mRNA在健康梭子蟹个体不同组织中的表达差异性(图 3), 结果表明: PtGal mRNA在眼柄中没有表达, 在肝胰腺、鳃、肌肉、肠、胃、心、性腺中都有表达, 但表达量存在明显的差异。以肝胰腺的表达量为参考, PtGal在性腺中的表达量最高, 为肝胰腺的51.65倍(P < 0.01), 其次是在肌肉中, 为肝胰腺的28.4倍(P < 0.01)。
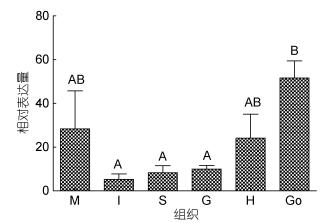 |
| 图 3 PtGal在不同组织中的表达分布 Fig. 3 Distribution of PtGal gene in different tissues of P. trituberculatus measured by Quantitative Real-time PCR 注:所有数据按照平均值±S.D (n=5)表示。不同字母之间表示两组织之间PtGal基因表达量差异极显著(P < 0.01)。M.肌肉; I.肠; S.胃; G.鳃; H.心脏; Go.性腺 |
PtGal在溶藻弧菌感染后的表达模式:以三疣梭子蟹肝胰腺为靶组织, qRT-PCR分析PtGal基因在溶藻弧菌感染后不同时间表达量的变化, 结果表明, 溶藻弧菌感染后3 h, PtGal的表达已开始慢慢的上调, 于12 h时表达量达到最大值, 然后慢慢回落, 总体表现为先升高、后降低的趋势。
2.3 重组蛋白PtGal的诱导表达和纯化原核表达重组质粒pET-21a (+)-PtGal, 转化大肠杆菌BL21(DE3)阳性转化菌经IPTG诱导表达后, 利用SDS-PAGE检测重组蛋白rPtGal的表达(图 5), 结果发现:宿主菌的蛋白表达谱发生了变化, 该蛋白在37 ℃诱导4 h时主要为包涵体表达, 而在15 ℃诱导16 h检测到可溶性表达。由于重组蛋白带有一个His标签, 所以目的蛋白的分子量略大于其预测的理论分子量, 约为26.kDa。利用Ni-Agarose技术对超声波破碎菌体上清中的重组蛋白进行分离纯化, 电泳检测显示在目的带位置有一条单一主带, 这与预期结果一致。纯化的目的蛋白得率约为1.5 mg/L。
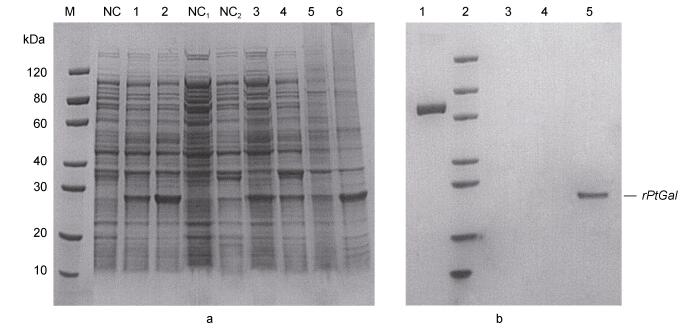 |
| 图 5 PtGal在大肠杆菌BL21(DE3)中表达及纯化的SDS-PAGE分析 Fig. 5 Expression and purification of the target fusion protein 注: a.泳道M:蛋白marker; 泳道NC:未诱导的全细胞裂解液; 泳道1: 15 ℃诱导16 h的全细胞裂解液; 泳道2: 37 ℃诱导4h的全细胞裂解液; 泳道NC1:未诱导的细胞裂解液上清; 泳道NC2:未诱导的细胞裂解液沉淀; 泳道3: 15 ℃诱导16 h的细胞裂解液上清; 泳道4: 15 ℃诱导16 h的细胞裂解液沉淀; 泳道5: 37 ℃诱导4h的细胞裂解液上清; 泳道6: 37 ℃诱导4h的细胞裂解液沉淀。b.泳道1: BSA对照; 泳道2:蛋白marker, 分子量同A; 泳道3、4:空白; 泳道5:纯化后的重组rPtGal蛋白 |
为了验证上述蛋白谱带就是重组目的蛋白, 对纯化蛋白普带进行了胶内酶解及MALDI-TOF/TOF质谱分析鉴定, 结果表明所切下的重组蛋白有三个肽段与三疣梭子蟹半乳糖凝集素推导的氨基酸序列完全匹配, 其中图 6为匹配序列-RAAGWGQEEATSSPAFARG-的二级质谱图。由此可以判定, 上述蛋白条带即为重组表达的目的蛋白rPtGal, PtGAL成功地获得了体外重组分泌表达。
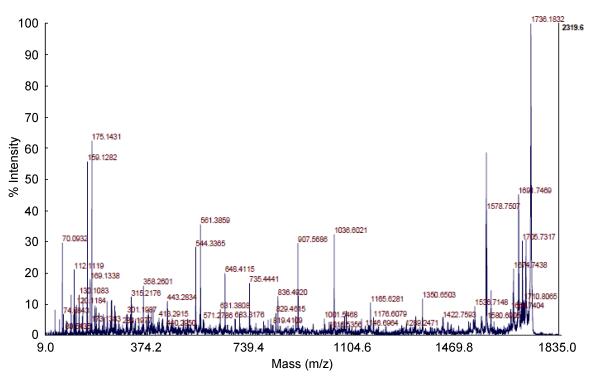 |
| 图 6 重组目的蛋白中与PtGal相匹配肽段的二级质谱图 Fig. 6 Characteristic spectrum of matched peptide fragments recombinant protein with PtGal |
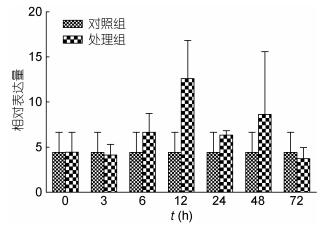 |
| 图 4 溶藻弧菌感染后PtGal在肝胰腺中的表达情况 Fig. 4 PtGal mRNA expression level after V. alginolyticus challenge in hepatopancreas |
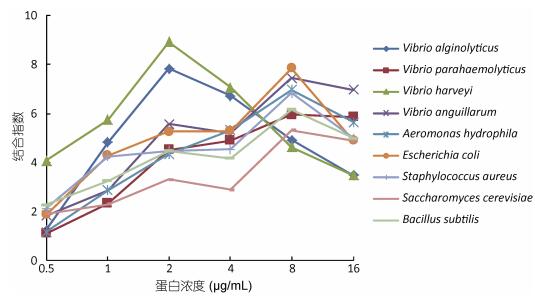
为了检测rPtGal能否与病原菌进行相互作用, 我们分别使用不同浓度的重组蛋白与革兰氏阳性菌代表菌2株、革兰氏阴性菌6株(代表株大肠杆菌及海水常见弧菌类)以及真菌(酵母菌)进行孵育, 然后进行ELISA检测, 发现蛋白会随着浓度的升高更好地与病菌结合, 结合指数最高达到8.9, 但每种菌的结合指数有一个高峰, 除了溶藻弧菌和哈维氏弧菌在蛋白浓度为2 µg/ mL时结合指数达到最高时, 其它均为8 µg/ mL时达到高峰(图 7)。
 |
|
图 7 rPtGal与细菌及真菌的结合
Fig. 7 Binding of rPtGal to bacteria and fungus
注:溶藻弧菌Vibrio alginolyticus; 副溶血弧菌Vibrio parahaemolyticus; 哈维氏弧菌Vibrio harveyi; 鳗弧菌Vibrio anguillarum; 嗜水气单胞菌Aeromonas hydrophila; 大肠杆菌Escherichia coli; 金黄色葡萄球菌Staphylococcus aureus; 酿酒酵母Saccharomyces cerevisiae; 枯草芽孢杆菌Bacillus subtilis 结合指数=蛋白的A450读数/PBS的A450读数, 结果为3次重复的平均值 |
半乳糖凝集素galectin是一种不依赖于钙离子的可溶性凝集素, 为S型凝集素, 由于其与b-半乳糖苷的特殊亲和力而得名(Barondes et al, 1994), 尽管其结构上与其它凝集素有不同, 但所有的凝集素成员都含有一个共同的结构, 称为糖识别结构域CRD, 赋予其结合糖结构的活性(Zelensky et al, 2005), 发挥着多种多样的生物学功能。本研究从三疣梭子蟹中筛选出了一个半乳糖凝集素基因PtGal, 通过对其序列及蛋白结构的分析, 发现PtGal与已知的无脊椎动物半乳糖结构相似, 没有信号肽而且只含有典型的半乳糖凝集素结构域, 这一点与脊椎动物的半乳糖凝集素结构也一致, 推测PtGal也是通过非经典的分泌方式到达细胞外(Almkvist et al, 2002), 但还需要进一步的实验验证。SMART分析结果表明PtGal在N末端有一个糖结合结构域CRD, 在C末端有两个富含脯氨酸/甘氨酸的低复杂区域(图 1b), 与已知的哺乳动物嵌合型半乳糖凝集素结构相似, 但CRD位置相反, 哺乳动物的CRD是在C末端(Yang et al, 2008), 这一现象在南美白对虾LvGal及中华绒螯蟹EsGal等结构中也被发现(Cha et al, 2015; Wang et al, 2016)。与其它甲壳类半乳糖凝集素进行同源性比对发现PtGal的结构域高度保守, 且与糖结合的氨基酸残基也都高度保守, 符合半乳糖凝集素家族成员具有保守糖识别位点的结构特征(Leffler, 2001)。
qRT-PCR检测PtGal在三疣梭子蟹各组织中的表达, 在被检测的8种组织中, 除了眼柄中没有表达, 在健康个体的不同组织都有表达, 这一点与其它甲壳类或贝类的galectin一样(Wang et al, 2011; 郑利兵等, 2015), 但表达量存在显著的差异, 其在性腺中表达量最高, 在肝胰腺中的表达量最低, 说明PtGal基因的表达不具有组织特异性, 但表达量具有一定的组织特异性。已有的研究表明, 水生动物经病原微生物感染后, 其体内的半乳糖凝集素基因mRNA水平上调, 如经鳗弧菌或藤黄微球菌感染的海湾扇贝, 其AiGal1、AiGal2 mRNA的表达量显著上调(Song et al, 2010; Song et al, 2011); 经溶藻弧菌感染的南美白对虾, 其Lvgalectin mRNA的表达量显著上调(Cha et al, 2015)等等。本研究中溶藻弧菌感染三疣梭子蟹后, PtGal基因的表达在3 h已开始慢慢的上调, 于12 h时表达量达到最大值, 为0 h的3.5倍, SPSS进行差异性分析为差异不显著。而Song等(2010)报道的海湾扇贝感染鳗弧菌后9h, 其AiGal1表达量达到最高, 为0 h的1.52倍, 差异显著(P < 0.05);感染藤黄微球菌后18h, AiGal1表达量达到最高, 为0 h的2.89倍, 差异极显著(P < 0.01), 分析原因为本试验的样本比较小, 而组间5个样本表达量差异较大, 导致其显著性水平受到了影响。
为了进一步探索PtGal的功能, 我们重组表达并纯化了rPtGal, 经质谱鉴定为目的蛋白后, 并用ELISA方法测定了纯化蛋白与病原菌的结合试验, 结果发现rPtGal对革兰氏阴性菌、阳性菌和真菌的菌体都有明显的结合, 而且这种结合会随着蛋白浓度的增加而增强, 但与每种菌的结合到了最适浓度时, 结合指数会有所下降(图 7)。这与Wang等(2016)报道的ELISA测定的中华绒螯蟹rEsGal与病原体相关分子模式(PAMPs) LPS、PGN、GLU的结合, 在所测定的浓度范围内具有浓度依赖性模式有所不同; 也与Cha等(2015)报道的ELISA测定的凡纳滨对虾rLvgalectin与多糖LPS、LTA及PGN的结合, 在所测定的浓度范围内具有浓度依赖性模式有所不同, 分析原因可能是半乳糖识别结合能力依赖于微生物表面的分布密度、呈现形式等, 而单独测定与这些表面多糖的结合不受其它因素影响, 会随着蛋白浓度的增加而增强(Shi et al, 2014), 但我们所用的为病原菌菌体, 一方面不同菌的表面多糖密度和结构有所不同, 因此会有不同的结合指数及最适结合指数; 另一方面蛋白与菌体表面多糖结合时, 会引起本身或其它产物的结构变化, 因而影响蛋白与多糖的结合, 以至于菌体与蛋白的结合不具有蛋白浓度依赖性, 具体结合指数及强度的不同, 还有待进一步研究。
综上, 本研究从三疣梭子蟹肝胰腺中克隆获得了一个半乳糖凝集素基因, 并对其序列结构及表达模式进行了分析, 对其结构域进行了原核重组表达及活性分析, 初步探讨了其在梭子蟹先天免疫中的可能作用, PtGal其它功能如其在梭子蟹生殖发育中的作用还需进一步研究, 这些工作为探索三疣梭子蟹半乳糖凝集素精确的生物功能提供有用的信息和资料。
| 王鹏, 王维, 吕志强, 2014. 家蚕半乳糖凝集素BmGalectin-4的表达、纯化及性质分析. 昆虫学报, 57 (7) : 806–814 |
| 王国良, 金珊, 李政, 等, 2006. 三疣梭子蟹(Portunus trituberculatus)乳化病的组织病理和超微病理研究. 海洋与湖沼, 37 (4) : 297–303 |
| 刘淇, 李海燕, 王群, 等, 2007. 梭子蟹牙膏病病原菌—溶藻弧菌的鉴定及其系统发育分析. 海洋水产研究, 28 (4) : 9–13 |
| 许文军, 徐汉祥, 施慧, 等, 2006. 三疣梭子蟹Portunus trituberculatus (Miers)血卵涡鞭虫病诊断与综合防治措施. 现代渔业信息, 21 (11) : 27–28, 19 |
| 郑利兵, 吴彪, 刘志鸿, 等, 2015. 魁蚶(Scapharca broughtonii)半乳糖凝集素(SbGal)基因cDNA的克隆及表达分析. 海洋与湖沼, 46 (5) : 1061–1070 |
| 贺雪明, 唐丽, 贺福初, 2012. 半乳糖凝集素1的免疫功能. 生物技术通讯, 23 (6) : 896–899 |
| 秦欣欣, 孙红梅, 赵海平, 等, 2012. 半乳糖凝集素1蛋白及其生物学功能. 中国畜牧兽医, 39 (6) : 141–145 |
| 阎斌伦, 张晓君, 梁利国, 等, 2012. 三疣梭子蟹病原弗氏柠檬酸杆菌的分离鉴定及定居因子抗原基因检测. 水产学报, 36 (3) : 391–398 |
| Almkvist J, Karlsson A, 2002. Galectins as inflammatory mediators. Glycoconjugate Journal, 19 (7-9) : 575–581 DOI:10.1023/B:GLYC.0000014088.21242.e0 |
| Barondes S H, 1984. Soluble lectins:a new class of extracellular proteins. Science, 223 (4642) : 1259–1264 DOI:10.1126/science.6367039 |
| Barondes S H, Cooper D N W, Gitt M A, et al, 1994. Galectins:structure and function of a large family of animal lectins. The Journal of Biological Chemistry, 269 (33) : 20807–20810 |
| Cha G H, Liu Y, Peng T, et al, 2015. Molecular cloning, expression of a galectin gene in Pacific white shrimp Litopenaeus vannamei and the antibacterial activity of its recombinant protein. Molecular Immunology, 67 (2) : 325–340 DOI:10.1016/j.molimm.2015.06.014 |
| Hao G J, Lin F, Mu C K, et al, 2015. SNP E4-205 C/T in C-type lectin of Portunus trituberculatus is association with susceptibility/resistance to Vibrio alginolyticus challenge. Aquaculture, 442 : 125–131 DOI:10.1016/j.aquaculture.2015.02.007 |
| Hou F J, Liu Y J, He S L, et al, 2015. A galectin from shrimp Litopenaeus vannamei is involved in immune recognition and bacteria phagocytosis. Fish & Shellfish Immunology, 44 (2) : 584–591 |
| Kawsar S M A, Fujii Y, Matsumoto R, et al, 2008. Isolation, purification, characterization and glycan-binding profile of a D-galactoside specific lectin from the marine sponge, Halichondria okadai. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 150 (4) : 349–357 DOI:10.1016/j.cbpb.2008.04.004 |
| Kim J Y, Kim Y M, Cho S K, et al, 2008. Noble tandem-repeat galectin of Manila clam Ruditapes philippinarum is induced upon infection with the protozoan parasite Perkinsus olseni. Developmental & Comparative Immunology, 32 (10) : 1131–1141 |
| Leffler H, 2001.Galectins structure and function-a synopsis.In:Crocker P R ed.Mammalian Carbohydrate Recognition Systems:Results and Problems in Cell Differentiation.Berlin Heidelberg:Springer, 33:57-83 |
| Li M, Wang J F, Song S Q, et al, 2016. Molecular characterization of a novel nitric oxide synthase gene from Portunus trituberculatus and the roles of NO/O2--generating and antioxidant systems in host immune responses to Hematodinium. Fish & Shellfish Immunology, 52 : 263–277 |
| Liu Y, Cui Z X, Li X H, et al, 2012. A new anti-lipopolysaccharide factor isoform (PtALF4) from the swimming crab Portunus trituberculatus exhibited structural and functional diversity of ALFs. Fish & Shellfish Immunology, 32 (5) : 724–731 |
| Livak K J, Schmittgen T D, 2001. Analysis of Relative gene expression data using real-time quantitative PCR and the 2-ΔΔCt method. Methods, 25 (4) : 402–408 DOI:10.1006/meth.2001.1262 |
| Maldonado-Aguayo W, Teneb J, Gallardo-Escárate C, 2014. A galectin with quadruple-domain from red abalone Haliotis rufescens involved in the immune innate response against to Vibrio anguillarum. Fish & Shellfish Immunology, 40 (1) : 1–8 |
| Pan L Q, Yue F, Miao J J, et al, 2010. Molecular cloning and characterization of a novel c-type lysozyme gene in swimming crab Portunus trituberculatus. Fish & Shellfish Immunology, 29 (2) : 286–292 |
| Shi X Z, Wang L, Xu S, et al, 2014. A galectin from the Kuruma shrimp (Marsupenaeus japonicus) functions as an opsonin and promotes bacterial clearance from hemolymph. PLoS One, 9 (3) : e91794 DOI:10.1371/journal.pone.0091794 |
| Song L S, Wang L L, Zhang H, et al, 2015. The immune system and its modulation mechanism in scallop. Fish & Shellfish Immunology, 46 (1) : 65–78 |
| Song X Y, Zhang H, Wang L L, et al, 2011. A galectin with quadruple-domain from bay scallop Argopecten irradians is involved in innate immune response. Developmental & Comparative Immunology, 35 (5) : 592–602 |
| Song X Y, Zhang H, Zhao J M, et al, 2010. An immune responsive multidomain galectin from bay scallop Argopectens irradians. Fish & Shellfish Immunology, 28 (2) : 326–332 |
| Vasta G R, 2009. Roles of galectins in infection. Nature Reviews Microbiology, 7 (6) : 424–438 DOI:10.1038/nrmicro2146 |
| Wang M Q, Wang L L, Huang M M, et al, 2016. A galectin from Eriocheir sinensis functions as pattern recognition receptor enhancing microbe agglutination and haemocytes encapsulation. Fish & Shellfish Immunology, 55 : 10–20 |
| Wang X W, Wang J X, 2013. Diversity and multiple functions of lectins in shrimp immunity. Developmental & Comparative Immunology, 39 (1-2) : 27–38 |
| Wang Z L, Jian J C, Lu Y S, et al, 2011. A tandem-repeat galectin involved in innate immune response of the pearl oyster Pinctada fucata. Marine Genomics, 4 (3) : 229–236 DOI:10.1016/j.margen.2011.06.004 |
| Wei X M, Yang J M, Liu X Q, et al, 2012. Identification and transcriptional analysis of two types of lectins (SgCTL-1 and SgGal-1) from mollusk Solen grandis. Fish & Shellfish Immunology, 33 (2) : 204–212 |
| Yamaura K, Takahashi K G, Suzuki T, 2008. Identification and tissue expression analysis of C-type lectin and galectin in the Pacific oyster, Crassostrea gigas. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 149 (1) : 168–175 DOI:10.1016/j.cbpb.2007.09.004 |
| Yang H, Yu S S, Chai Y M, et al, 2013. A galectin from roughskin sculpin, Trachidermus fasciatus:molecular cloning and characterization. Fish & Shellfish Immunology, 35 (3) : 815–824 |
| Yang R Y, Rabinovich G A, Liu F T, 2008. Galectins:structure, function and therapeutic potential. Expert Reviews in Molecular Medicine, 10 : e17 DOI:10.1017/S1462399408000719 |
| Zelensky A N, Gready J E, 2005. The C-type lectin-like domain superfamily. FEBS Journal, 272 (24) : 6179–6217 DOI:10.1111/EJB.2005.272.issue-24 |
| Zhang D L, Lv C H, Yu D H, et al, 2016. Characterization and functional analysis of a tandem-repeat galectin-9 in large yellow croaker Larimichthys crocea. Fish & Shellfish Immunology, 52 : 167–178 |
 2016, Vol. 47
2016, Vol. 47


