中国海洋湖沼学会主办。
文章信息
- 朱晓芳, 郭晓鸽, 张鼎元, 杨佳喆, 徐善良, 王丹丽. 2016.
- ZHU Xiao-Fang, GUO Xiao-Ge, ZHANG Ding-Yuan, YANG Jia-Zhe, XU Shan-Liang, WANG Dan-Li. 2016.
- 银鲳(Pampus argenteus)胰岛素样生长因子-I基因的克隆和表达分析
- CLONG AND EXPRESSION ANAYSIS OF INSULIN-LIKE GROWTH factor I GENE IN PAMPUS ARGENTEUS
- 海洋与湖沼, 47(6): 1221-1232
- Oceanologia et Limnologia Sinica, 47(6): 1221-1232.
- http://dx.doi.org/10.11693/hyhz20160600142
-
文章历史
- 收稿日期:2016-06-30
- 收修改稿日期:2016-08-15
胰岛素样生长因子(IGFs, insulin-like growth factors)因其结构与胰岛素原相类似而得名, 它是一种单链多肽, 包括IGF-I、IGF-Ⅱ(Perks et al, 1995)和IGF-Ⅲ(Wang et al, 2008; Li et al, 2011)。IGF-I由70个氨基酸组成, 分子量约为7.5 kDa (Vong et al, 2003), 能通过选择性地促进有丝分裂发生分化以及抑制细胞凋亡, 在生长、分化和繁殖调控中起着相当大的作用(Reinecke et al, 2005)。自Rinderknecht & Humber于1978年首次阐述了IGF-I的一级结构, 很多脊椎动物的IGF-I基因序列已经被克隆得到, 同时对它们的表达模式也进行了相应的研究(Rinderknecht et al, 1978)。在鱼类中, Cao等于1989年首次从鲑(Oncorhynchus tshauytscha)中克隆到鱼类IGF-I cDNA (Cao et al, 1989), 随后, 鲤形目的鲤(Cyprinus carpio) (华益民等, 2001)、草鱼(Ctenapharyngodon idellus) (白俊杰等, 2001)、胭脂鱼(Myxocyprirms asiaticus) (郑凯迪等, 2007), 鲈形目的鲷(Sparus aurata) (Tanaka et al, 1998)、大黄鱼(Larimichthys crocea) (常抗美等, 2012)、花鲈(Lateolabrax japonicus) (钱焜等, 2014)等几十种鱼类的IGF-I基因序列相继得到研究。
银鲳(Pampus argenteus)隶属鲈形目(Perciformes), 鲳科(Stromateidae), 鲳属(Pampus), 分布范围广泛。迄今, 对银鲳的研究涉及分类、资源评估、生态和繁殖特性、人工繁殖、营养成分分析、体成分分析等诸多方面(施兆鸿等, 2009, 2011; 彭士明等, 2010, 2013; 徐善良等, 2012, 2013; 周健恺等, 2014; 王腾飞等, 2015; 闫雪梅等, 2015), 目前对银鲳分子生物学方面的研究较少, 对银鲳胰岛素样生长因子(IGF)基因的克隆, 国内外尚无文献报道。作者在本文中采用同源克隆和RACE-PCR方法, 对养殖银鲳IGF-I的cDNA全长进行克隆, 采用实时荧光定量(Real-Time PCR)技术检测其mRNA的组织表达特性和在肝脏中的表达特性和定位, 以期为研究IGF-I在银鲳生长发育中的调控机理提供基础材料。
1 材料与方法 1.1 实验材料实验用银鲳取自浙江省宁波市象山鱼得水水产养殖有限公司的银鲳养殖池。选择摄食正常、无病无伤、健康的个体。在养殖的不同阶段, 分别捞取体重为1-5 g、5-15 g、15-30 g、30-50 g、50-100 g、100-150 g、 > 150 g的7种规格鱼体各15尾。立即在冰盘上用无菌解剖工具活体摘取肝脏、肌肉、肾脏、肠、垂体、心、嗅球、胃、鳃、卵巢共10种组织样品, 置于盛有RNA保护酶的冻存管中, 置于-80 ℃冰箱中保存备用。
实验期间养殖池水温25-27 ℃, pH值为8.21±0.3, 盐度为20.3±0.8。饲料为日本林傔株式会社产“鱼宝”5#饲料和新鲜马鲛鱼肉按1︰1反复绞碎制成的湿团状料。
1.2 引物设计从GenBank中获得已注册的花鲈(Lateolabrax japonicus, JN596878.2)、鳜(Siniperca chuatsi, HM164110.1)、斜带石斑鱼(Epinephelus coioides, AY513719.1)、河鲈(Perca fluviatilis, AJ586907.1)和金头鲷(Sparus aurata, AY996779.2) IGF-I基因的cDNA全长, 运用ClustalX1.83软件找到IGF-I基因的保守区, 并用Primer Premier 5软件设计兼并引物IGF-I-F和IGF-I-R, 进行PCR扩增, 得到一条长度约为762bp核心片段, 根据这部分序列设计5′RACE和3′RACE特异性引物IGF-I-5′R1, IGF-I-5′R2, IGF-I-3′F1, IGF-I-3′F2, 扩增出IGF-I全长cDNA序列, 进一步设计出实时荧光定量PCR引物IGF-I-RT-F, IGF-I-RT-R。基于银鲳18S (AJ564775.1)的cDNA序列, 设计内参基因序列引物18S F和18S R。检验后, 用一对内参基因引物18S-F/R以及一对特异性引物qIGF-I-F/R来检测银鲳不同组织和肝脏不同生长发育时期IGF-I mRNA的表达情况, 测序引物用菌体自带引物M13-R、M13-47-F (表 1)。
| 引物名称 | 序列(5′-3′) |
| 兼并引物 | |
| IGF-I-F1 | ATTGCCCGCATCTCATCYTC |
| IGF-I-R1 | GCTGGGCATTTGTCCATTCG |
| IGF-I-F2 | CAAGAGTGCGATGTGCTGTA |
| IGF-I-R2 | CTATGTCCAGGTRAAGGTCT |
| 基因特异性引物 | |
| IGF-I-5'R1 | GTAGGAGTCAGGGTGAGGACGCAC |
| IGF-I-5'R2 | CGCAACGCAGCTTGAAGACATCAC |
| IGF-I-3'F1 | CCTGGACATAGTCATTCGACCTTC |
| IGF-I-3'F2 | ACAGAATGTAGGGAAGGAGCGAATGG |
| UPM | CTAATACGACTCACTATAGGGCAAGCAGTGGTATCAACGCAGAGT |
| IGF-I-S | attgcccgcatctcatcttctt |
| IGF-I-V | ACAGTGAACCATTCCACAGGGGT |
| 测序引物 | |
| M13-47-F | CGCCAGGGTTTTCCCAGTCACGAC |
| M13-R | CAGGAAACAGCTATGAC |
| 基因特异性引物 | |
| qIGF-I-F | TTGTGGATGAGTGCTGCTTC |
| qIGF-I-R | GCTGTACTAACCTTGGGTGCT |
| 内参引物 | |
| 18S-F | GGTTTTCTCTCTGAACTGGGG |
| 18S-R | CCTCCGACTTTCGTTCTTGAT |
| 原位杂交探针引物 | |
| IGF-I-S | ACCCAAGGTTAGTACAGCAGG |
| IGF-I-A | TGAACCATTCCACAGGGGTA |
| 注: Y=C or T; R=A or G | |
采用RNA提取试剂盒(Axygen, RNA extraction kit)对同一时期不同组织和不同生长阶段肝脏总RNA分别进行提取。采用TaKaRa反转录试剂盒对上述RNA进行反转录, 获得cDNA。经37 ℃反转录15 min, 于85 ℃灭活反转录酶5 s。将合成得到的cDNA产物保存于-20 ℃或直接用于PCR。
1.4 对IGF-I基因cDNA核心片段进行克隆以银鲳的肝脏cDNA作为模板, 采用IGF-I-F/R简并引物, 进行PCR扩增。PCR反应体系为50 μL, 优化后的扩增条件如下: 94 ℃预变性5 min, 94 ℃变性30 s; 55 ℃退火30 s, 于72 ℃延伸1 min, 30个循环; 再于72 ℃延伸10 min; 在4 ℃保存。
将PCR产物于1.5%琼脂糖凝胶电泳检测, 并切胶回收目的片段。进行连接转化培养, 再根据电泳检测菌液PCR结果, 取阳性克隆菌液, 送上海Sunny生物科技有限公司测序。
1.5 银鲳IGF-IcDNA全长获取将测序结果在NCBI数据库(http://www.ncbi.nlm.nih.gov)中, 进行BlastX对比分析, 如果测序所得的IGF-I部分序列与其它物种的IGF-I同源, 即根据测得序列再设计5′RACE和3′RACE的特异性引物IGF-I-5′R1, IGF-I-5′R2, IGF-I-3′F1和IGF-I-3′F2, 用于RACE扩增。采用SMARTTM RACE cDNA试剂盒(Clontech)进行5′RACE和3′RACE, 以获得全长cDNA。
1.6 对IGF-I基因的信息学分析采用Protparam软件(http://web.expasy.org/protparam/)对蛋白的理化特性进行预测; 并利用http://www.ncbi.nlm.nih.gov网站上的BlastX工具核酸和蛋白序列相似性进行比较分析; 采用NCBI的ORF Finder分析开放阅读框, 预测氨基酸的序列; 用ExPASy-PROSITE网站(http://prosite.expasy.org/)预测氨基酸功能域; 采用Signal P4.1 Server对信号肽进行分析; 功能域的预测则采用Smart软件; 多序列比对分析则采用ClustalW软件。构建进化树采用MEGA5.05软件中的M-L (Maximum-Likelihood)法。并采用自展法(Bootstrap)进行1000次重复检验。
1.7 实时荧光定量PCR分析对体重大于100 g的成鱼肝脏、肌肉、肾脏、小肠、垂体、嗅球、胃、心脏、鳃、卵巢10种组织以及体重为1-5 g、5-15 g、15-30 g、30-50 g、50-100 g、100-150 g六个阶段的肝脏组织进行实时荧光定量PCR分析, 每个分析样3个重复。荧光定量PCR时, 先优化模板浓度, 将各类模板按10倍稀释5个浓度梯度, 并用引物分别扩增以确定最佳的模板浓度。并优化引物退火温度, 优化后反应条件为: 95 ℃预变性30 s; 95 ℃变性5 s, 59 ℃退火30 s, 40个循环; 95 ℃ 15 s, 60 ℃ 1 min, 95 ℃ 15 s。待反应结束, 确定Real-time PCR扩增曲线及溶解曲线, 在ABI StepOnePlusTM Instrument上进行数据采集和处理。所得数据以平均值±标准差(M±SD)表示, 采用SPSS17.0软件对所测数据进行统计分析, 用One-Way ANOVA法进行显著性检验, 多重比较采用Duncan检验法。本文根据Livak等(2001)方法进行引物效率的检测, 结果发现PCR产物溶解曲线未出现杂峰, 表明产物的特异性较好。采用2-DDCt法对qRT-PCR结果加以分析处理, 将ΔCt定义为:内标目的基因IGF-I Ct值与18S Ct值之间的差值。
1.8 原位杂交根据已克隆的IGF-I cDNA序列设计探针模板引物IGF-I-S和IGF-I-A, PCR扩增得到248bp目的序列, 经电泳验证后连接至pGEM-T载体, 转化后取阳性克隆测序鉴定。测序结果比对正确后, 扩培菌液用Omega质粒抽提试剂盒抽提质粒。对重组pGEM-T质粒用限制性内切酶Nco I和Spe I分别进行单酶切, 使得质粒线性化。用琼脂糖凝胶电泳检测酶切产物正确后, 用PCR纯化试剂盒(AxyGen, 美国)回收线性化的模板质粒, 采用0.1%的DEPC处理水溶解。将纯化质粒作为体外转录的DNA模板, 以DIG RNA Labeling Mix为底物, 参照Riboprobe® System (Promega)的实验程序, 用T7聚合酶和SP6聚合酶(Promega)进行体外转录合成DIG标记的正反义RNA探针。采用没有RNA酶活性DNA酶处理去除DNA模板, 再加入2.5 μL预冷的5 mol/L氯化锂(经DEPC处理)及75 μL冰预冷的无水乙醇, -20 ℃下放置过夜。用DEPC水配制的70%酒精洗沉淀, 吹干后向RNA沉淀中加入30 μL的DEPC水, 待其自然溶解后, 取5 μL进行电泳检测, 置于-80 ℃保存备用。
原位杂交步骤主要参照谢碧文(2008)和陈丽丽(2012)。具体调整方法如下:为保证细胞的完整性采用组织切片技术, 为增加细胞膜通透性采用蛋白酶K于37 ℃消化30 min, 为探针与模板最佳结合且降低非特异性染色采用60 ℃预杂交2 h, 洗掉预杂交液无酶条件干燥后滴加杂交液60 ℃过夜孵育(探针︰预杂交液=1︰100)。
2 结果与分析 2.1 银鲳IGF-I基因cDAN全长的克隆以银鲳cDNA全长为模板, 用兼并引物IGF-I-F、IGF-I-R扩增, 获得一条762bp的单一条带, 经BlastX分析, 显示与已登录的大黄鱼(Larimichthys crocea, KKF31429.1)、石斑鱼(Epinephelus lanceolatus, ABZ10841.1)、鳜(Siniperca chuatsi, ADO14142.1)、花鲈(Dicentrarchus labrax, AAV67967.1)、军曹鱼(Rachycentron canadum, ABG57072.1) IGF-I氨基酸同源性都达到了98%以上, 表明该片段是IGF-I基因的一部分。再用特异性引物IGF-I-3'F2扩增出190bp的cDNA片段, 测序后所得序列通过比对拼接得到了一条836bp的银鲳IGF-I cDNA序列(GenBank登录号: KT210886), 见图 1。再重新设计IGF-I_CDS-F和IGF-I_CDS-R克隆IGF-I全长序列, 以验证序列的可靠性, 结果发现与拼接结果一致, 证明了cDNA克隆是成功的。将银鲳IGF-I基因的cDNA命名为Pampus argenteusinsulin-like growth factor-I。
2.2 银鲳胰岛素样生长因子IGF-I序列特征分析银鲳IGF-I基因cDNA序列以及推导的氨基酸序列见图 1。该cDNA全长836bp, 含有128bp的5'非编码区(UTR)、605bp的开放阅读框(ORF)和92bp的3'-非编码区(UTR), 编码了201个氨基酸。IGF-I前体肽预测的理论等电点(pI)为9.72, 分子质量经计算约为22.00 kDa。据SignalP 4.1Server分析, 该多肽含有一段59个氨基酸残基的信号肽序列, 成熟肽B区31个氨基酸, A区19个, C区10个, D区7个, E区75个。成熟肽存在CysB6, CysB18, CysA6, CysA7, CysA11及CysA20等6个半胱氨酸残基。
 |
| 图 1 银鲳IGF-I基因cDNA序列及推导的氨基酸序列 Fig. 1 The cDNA sequence of P. argenteus IGF-I and deduced a mino acids sequence 注:信号肽和成熟肽的区域分别以英文名称标注; 浅灰色代表CysB6, CysB18, CysA4, CysA5, CysA9和CysA18六个半胱氨酸残基; 星号为终止密码子 |
银鲳IGF-I基因ORF中功能位点分析发现, 含有6个蛋白激酶C磷酸化位点(protein kinase C phosphorylation site); 1个N-糖基化位点(N-glycosylation site); 1个酪蛋白激酶Ⅱ磷酸化位点(casein kinase Ⅱ phosphorylation site); 以及1个豆蔻酰化位点(N-myristoylation site) (图 2)。
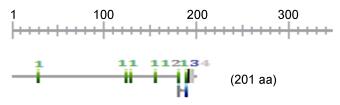 |
| 图 2 银鲳IGF-I基因ORF中功能位点示意图 Fig. 2 The functional sites in ORF of IGF-I from P. argenteu 注: 1.蛋白激酶C磷酸化位点(绿色29-31, 123-125, 129-131, 155-157, 180-182, 189-191); 2.酪蛋白激酶Ⅱ磷酸化位点(深灰180-183); 3. N端糖基化位点(蓝色188-191); 4.豆蔻酰化位点(浅灰192-197) |
利用ClustalW对银鲳IGF-I和其它20种脊椎动物IGF-I的编码氨基酸序列对比发现(图 3)。在不同物种中均存在6个保守的半胱氨酸(Cys)残基。由氨基酸序列同源性分析可见, 与11种鱼类IGF-I氨基酸同源性均在70.19%以上, 其中银鲳与河鲈(P. fluviatilis)的同源最高为91.40%;与鲈形目鱼类的同源性为83.52%-91.40%;与鲽形目牙鲆(Paralichthys lethostigma)、半滑舌鳎(Cynoglossus semilaevis)的同源性分别为90.86%、83.96%;与鲻形目鲻鱼(Mugil cephalus)的同源性为86.02%;鲑形目大西洋鲑鱼(Salmo salar)的同源性为81.82%;与鳗鲡目日本鳗鲡(Anguilla japonica)的同源性为73.75%;与鲤形目的同源性为70.19%-71.43%;各个功能区域间对比发现, B区和A区保守性较高, C区次之, 而D区和E区保守性较差(图 3)。
 |
| 图 3 脊椎动物IGF-I的氨基酸序列比对 Fig. 3 Multiple-sequence alignment of vertebrate IGF-I a mino acids sequence 注:星号表示所有的比对物种IGF-I氨基酸完全一致; 点表示只有少部分物种的氨基酸一致; 比号表示大部分的物种氨基酸一致。浅灰色表示与IGFBP s结合相关的氨基酸; 深灰色表示与IGF-I R结合相关的氨基酸; 方框表示6个保守的半胱氨酸残基 |
通过MEGA5.05软件, 对21个物种的IGF-I氨基酸进行了分子系统进化分析, 并在构建系统发生树基础上, 研究银鲳IGF-I和其它物种的进化关系, 见图 4。由图 4可知, 所有物种聚为两大亚群, 银鲳与硬骨鱼类聚为一大亚群, 即银鲳先与河鲈(P. fluviatilis)、牙鲆(P. lethostigma)、金头鲷(S. aurata)、点带石斑鱼(E. coioides)、鳜(S. chuatsi)、加州鲈(M. salmoides)、花鲈(L. japonicus)、鲻鱼(M. cephalus)聚为一支, 然后与红鳍笛鲷(L. erythropterus)、半滑舌鳎(C. semilaevis)、尼罗罗非鱼(O. niloticus)、大西洋鲑(S. salar)聚类, 最后与鲤鱼(C. carpio)、鲫鱼(Carassius auratus)和日本鳗鲡(A. japonica)聚为一个大的亚群; 另一个亚群中, 人(Homo sapiens)、野猪(Sus scrofa)、金仓鼠(Mesocricetus auratus)三种哺乳类先聚为一支, 再与鸟类原鸡(Gallus gallus)和爬行类中华鳖(Pelodiscus sinensis)聚为一大亚群。
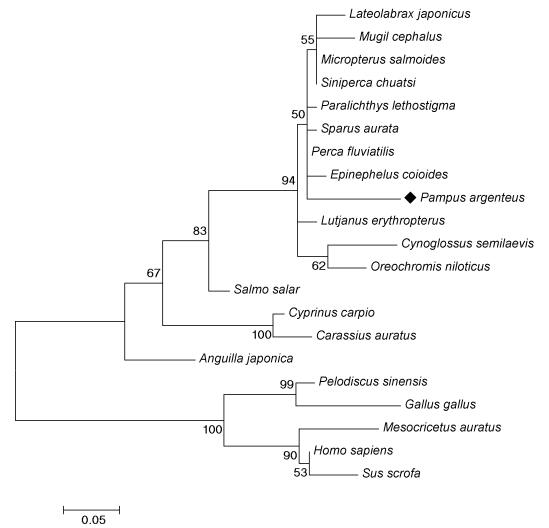 |
| 图 4 利用不同物种推导的IGF-I氨基酸序列构建的M-L进化树 Fig. 4 The maximum-likelihood tree reconstructed based on putative IGF-I amino acids residues 注:由MEGA 5.05软件Maximum-Likelihood方法构建进化树, 重复抽样次数为1000次; 标注“◆”为银鲳 |
通过进化关系图可见, 银鲳与同一鲈形目的河鲈(P. fluviatilis)、金头鲷(S. aurata)、点带石斑鱼(E. coioides)等亲缘关系最近; 与鲽形目和鲻形目亲缘关系较近; 与鲤形目和鳗鲡目等淡水鱼类较远, 与哺乳类、鸟类和爬行类的进化距离最远。
2.4 银鲳不同组织的IGF-I mRNA的表达采用半定量RT-PCR和Quantitative Real-time PCR方法检测了IGF-I基因在银鲳肝脏、肌肉、肾脏等10个不同组织中的表达情况(图 5)。IGF-I基因在银鲳10个不同组织中均有表达, 尤其是在肝脏中表达量最高, 显著高于其它组织(P < 0.05, n=3), 其次为肾脏、心脏、肌肉、脑等, 在嗅球和胃中表达较低。
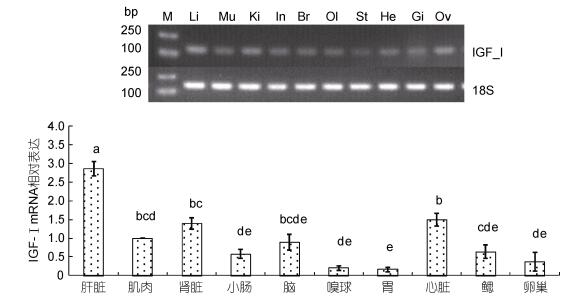 |
| 图 5 银鲳IGF-I mRNA在不同组织中的表达水平 Fig. 5 Levels of IGF-I mRNA transcription of different tissues with 18S acted housekeeping gene 注: M. Mark 2000, Li.肝脏, Mu.肌肉, Ki.肾脏, In.小肠, Br.脑, Ol.嗅球, St.胃, He.心脏, Gi.鳃, Ov.卵巢 |
通过半定量RT-PCR和Quantitative Real-time PCR方法检测银鲳IGF-I基因在不同生长阶段的表达情况(图 6)。银鲳幼鱼在体重小于30 g时, IGF-I表达略有下降, 在体重30-50 g时显著性增高(P <0.05), 且达最高峰值, 约为体重1-30 g阶段表达量的2.5-5倍; 到体重50-100 g时表达量显著下降(P < 0.05), 仅为体重30-50 g时表达量的1/2;此后表达量趋于平稳, 维持在中等水平。
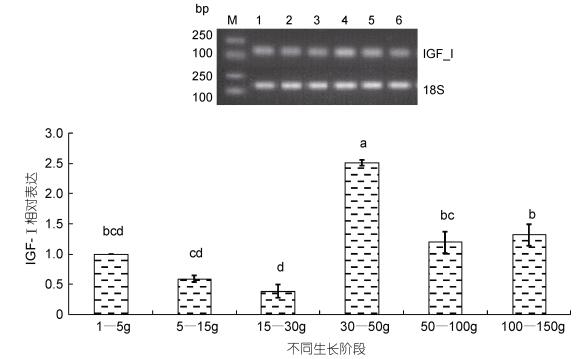 |
| 图 6 银鲳IGF-I mRNA在不同生长阶段表达水平 Fig. 6 Levels of IGF-I mRNA transcription in different growth stages with 18S acted housekeeping gene 注: M: Mark 2000, 1: 1-5 g, 2: 5-15 g, 3: 15-30 g, 4: 30-50 g, 5: 50-100 g, 6: 100-150 g |
实验组为DIG标记的反义RNA探针, 对照组为DIG标记的正义RNA探针, 同时用H.E染色作为对照组。从图 7可见, 肝细胞呈板状排列, 血窦在肝细胞索(肝板)之间, 肝细胞索的形状呈现弯曲、分支及吻合(图 7, A1, A2, C1, C2)。肝脏原位杂交结果显示, 地高辛标记的IGF-I反义RNA阳性杂交反应信号遍布于肝细胞中, 且杂交信号主要存在于细胞质中, 靠近细胞边缘处信号较强(图 7, A3, A4);正义探针对照组(图 7, B1, B2)没有检测到IGF-I mRNA的杂交阳性信号。
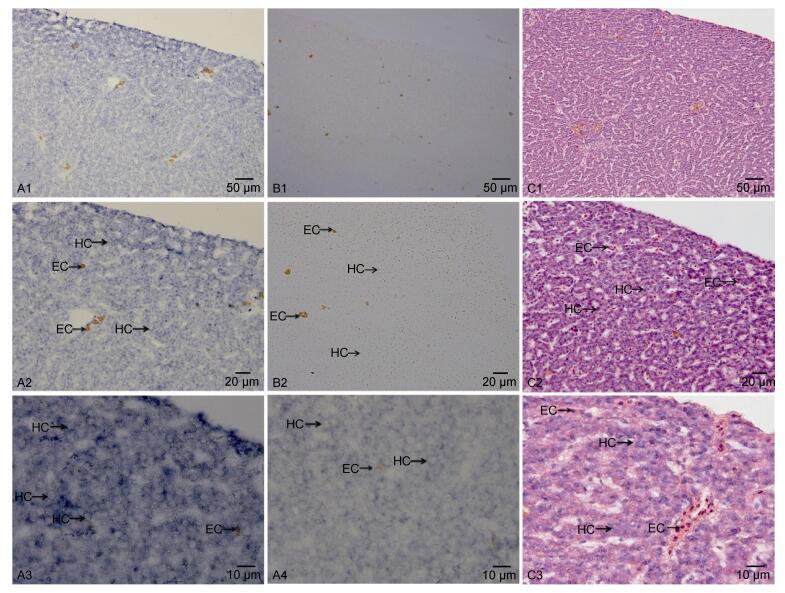 |
| 图 7 胰岛素样生长因子-I原位杂交及H.E染色结果 Fig. 7 In situ hybridization of P. argenteus, showing the location of insulin-like growth factor-I mRNA in liver 注: A1-A4: IGF-I反义探针杂交结果; B1-B2: IGF-I正义探针杂交结果(对照组); C1-C3: H.E染色结果(对照组); HC:肝脏细胞, EC:红细胞 |
本文首次克隆得到了银鲳IGF-I cDNA全长序列, 与斜带石斑鱼(Pedroso et al, 2006)、鳜(刘俊等, 2011)、花鲈(钱焜等, 2014)的IGF-I前体蛋白结构相同, 银鲳的IGF-I前体蛋白也由信号肽、成熟肽和E肽三部分组成, 而成熟肽则由B, C, A, D四个结构域组成。与人和其它脊椎动物的IGF-I一样, 银鲳IGF-I的成熟肽含6个极端保守的半胱氨酸(Cys)残基, 其中2个位于B结构域, 另外4个位于A结构域, 其参与形成的二硫键对蛋白质的正常折叠、空间结构的维持及生理作用的发挥具有重要意义(Hober et al, 1992; Magee et al, 1999)。
由氨基酸序列同源性分析可见, 银鲳IGF-I与其它鱼类氨基酸同源性在70.19%以上, 与哺乳动物的同源性在44.62%以上, 可见IGF-I在进化过程中是一个演变过程较慢的蛋白分子, 可以成为鱼类分类中的一个重要参考标记; B区和A区同源性分别为89.66%-100%和90.48%-100%, 结构域保守性很高, 它们包含与IGF-IR和IGFBPs结合的序列(Zhang et al, 1994; Magee et al, 1999), 可能与IGF-I的功能维持相关; 而C区(50.00%-100%)、D区(37.50%-100%)和E区(25.68%-97.3%)在不同物种中存在一定差异。目前已发现的IGF-I存在着4种不同的剪接体(Cao et al, 1989; Shamblott et al, 1993; Hashimoto et al, 1997), 根据E肽氨基酸大概长度分别命名为含35个氨基酸的Ea-1型, 含47个氨基酸的Ea-2型, 含62个氨基酸的Ea-3型, 以及含74个氨基酸的Ea-4型。银鲳IGF-I E肽序列长为75个氨基酸, 属于Ea-4型。Duguay等(1992)报道大麻哈鱼(Oncorhynchus keta)的心、脑、肾、脾及卵巢等组织中主要表达Ea-4型的IGF-I。同样, Chen等(1998)报道黑鲷(Acathopagrus schlegeli)的肝等组织也主要表达Ea-4型的IGF-I, 而Hashimoto等(1997)的研究表明鲤鱼(C. carpio)各组织主要表达Ea-2型的IGF-I。本研究得出的系统进化树基本反映了脊椎动物的系统分类关系, 与传统的形态学和生化特征分类基本一致。
3.2 IGF-I mRNA在不同组织中的表达分析本章采用半定量RT-PCR和quantitative real-time PCR方法检测了IGF-I基因在银鲳肝脏、肌肉、肾脏等10种组织中的表达情况, 结果与日本白鲫(Carassius cuvieri)(陶敏等, 2012)完全相同, 均在肝脏组织中的表达量最高, 这是因为IGF-I绝大部分由肝合成(Sjögren et al, 1999)。大量研究表明, IGF-I在鱼体各组织的表达呈多样性。郁建锋等(2012)采用半定量RT-PCR方法以鳡(Elopichthys bambusa)β-actin基因为内参照, 检测了IGF-I基因mRNA在鳡的6个不同组织的表达情况, 发现IGF-I基因mRNA在肝脏中表达量最高, 心脏中未见其明显表达, 肾脏、肠、心脏和肌肉中的表达量较肝脏明显偏低; 钱焜等(2014)和胡健(2012)分别检测花鲈(L. japonicus)和大菱鲆(Scophthalmus maximus) IGF-I mRNA在不同组织的表达水平, 发现肝脏IGF-I的表达水平最高, 肌肉中表达量相对较高, 在肾脏中表达量偏低; Otteson等则报道了在金鱼(Carassius auratus)视网膜中发现了IGF-I的表达(Hitchcock et al, 2001)。大量研究表明, 肝脏IGF-I mRNA表达水平不但与物种、体重、年龄、营养条件, 环境温度还有盐度有关, 也与个体所处的生长阶段有关(Duan et al, 1998; Metón et al, 2000; Larsen et al, 2001; Gabillard et al, 2003)。研究表明IGF-I在肝外组织可以分别以自分泌和旁分泌方式作用于相应器官, 发挥特定的生理功能(Reinecke et al, 1998; Roith et al, 2001)。
3.3 IGF-I mRNA在不同生长阶段的表达分析通过半定量RT-PCR和quantitative real-time PCR检测银鲳IGF-I基因在不同生长阶段的表达情况, 银鲳幼鱼在体重小于30 g前, IGF-I表达虽稍有降低, 但变化幅度不大。至体重30-50 g时表达量显著性增高(P < 0.05), 这与此时银鲳进入快速生长阶段完全相吻合, 夏末初秋水温在23-28 ℃范围, 正是银鲳最佳的生长期。随后因银鲳进入越冬期(体重50-100 g)生长减缓, IGF-I基因表达随之下跌过半, 翌年春天银鲳体重达到100-150 g, 由于性腺发育迅速, 生长反而受到影响, 故此时呈现IGF-I基因的表达量增幅不大的现象(Wen et al, 2002)。有关IGF-I调节鱼类生长发育的研究不多, Shamblott等(1993)检测虹鳟(Oncorhynchus mykiss)成鱼和幼鱼组织IGF-I mRNA的表达水平, 发现成鱼肝组织IGF-I mRNA水平约为幼鱼表达量的两倍; 而Duan等(1998)发现银大马哈鱼肝组织IGF-I mRNA水平随着年龄的增长而显著下降。
3.4 IGF-I基因在肝脏中的定位分析IGF-I介导生长激素(GH)的功能, 对机体组织和个体发育有非常重要的作用, 关于IGF-I的原位杂交研究主要集中在脊椎动物的整体原位杂交和组织原位杂交(李艳梅, 2008; 郭斌, 2008; Patruno et al, 2008)。本研究用DIG标记的RNA探针检测到IGF-I mRNA在肝脏细胞的细胞质中有大量表达, 与Patruno等(2008)在肝脏中的表达结果相似。Patruno等(2008)采用经DIG标记的RNA探针和荧光原位杂交技术, 检测到花鲈孵化后第一周有较强的IGF-I mRNA表达, 在幼鱼和成鱼的肝脏中也有IGF-I mRNA大量表达; 但也有学者在肝脏中并未发现IGF-I基因的表达, 如郭斌(2008)运用DIG标记的RNA探针检测IGF-I mRNA在成体文昌鱼不同组织中的表达, 发现IGF-I mRNA只在肝盲囊和后肠中表达。
| 王腾飞, 郭晓鸽, 谷江稳, 等, 2015. 饥饿及过量投喂下银鲳幼鱼形态学指标及体成分变化. 海洋学研究, 33 (4) : 83–89 |
| 白俊杰, 叶星, 李英华, 等, 2001. 草鱼胰岛素样生长因子-I基因克隆及序列分析. 水产学报, 25 (1) : 1–4 |
| 华益民, 林浩然, 2001. 营养状况对幼年鲤鱼肝脏IGF-I mRNA表达的影响. 动物学报, 47 (1) : 94–100 |
| 刘俊, 赵金良, 张敏, 等, 2011. 鳜胰岛素样生长因子-I cDNA全长克隆及组织表达分析. 动物学杂志, 46 (3) : 28–36 |
| 闫雪梅, 谷江稳, 郭晓鸽, 等, 2015. 饥饿银鲳幼鱼的能量利用规律及其生存策略. 动物营养学报, 27 (12) : 3975–3983 |
| 李艳梅, 2008.GHR、IGF-1、IGF-1R基因在鹿茸顶端的组织定位及鹿GHR基因cDNA克隆.杨凌:西北农林科技大学硕士学位论文 |
| 陈丽丽, 2012.鱼皮中胶原蛋白的提取、性质及其应用研究.南昌:江西科技师范大学硕士学位论文 |
| 郁建锋, 李建林, 徐建荣, 等, 2012. 鳡胰岛素样生长因子1基因的克隆及其组织特异性表达分析. 扬州大学学报(农业与生命科学版), 33 (3) : 32–39 |
| 周健恺, 徐善良, 邱成功, 等, 2014. 银鲳不同消化器官中消化酶活性的分布及其比较. 宁波大学学报(理工版), 27 (4) : 1–6 |
| 郑凯迪, 陈小川, 李英文, 2007. 胭脂鱼胰岛素样生长因子-I (IGF-I) cDNA的分子克隆、序列分析及组织表达. 动物学杂志, 42 (2) : 39–45 |
| 胡健, 2012.大菱鲆类胰岛素样生长因子和结合蛋白基因克隆及表达的研究.青岛:中国海洋大学硕士学位论文 |
| 施兆鸿, 赵峰, 王建钢, 等, 2009. 舟山渔场银鲳人工授精及孵化. 渔业现代化, 36 (1) : 18–21, 34 |
| 施兆鸿, 彭士明, 王建钢, 等, 2011. 人工养殖银鲳子代胚胎发育及仔稚幼鱼形态观察. 中国水产科学, 18 (2) : 267–274 |
| 钱焜, 温海深, 迟美丽, 等, 2014. 花鲈类胰岛素生长因子-1基因的全长cDNA分离与表达分析. 中国海洋大学学报, 44 (2) : 27–34 |
| 徐善良, 王丹丽, 徐继林, 等, 2012. 东海银鲳(Pampus argenteus), 灰鲳(P.cinereus)和中国鲳(P.sinensis)肌肉主要营养成分分析与评价. 海洋与湖沼, 43 (4) : 775–782 |
| 徐善良, 王丹丽, 徐继林, 等, 2013. 3种鲳属鱼不同组织脂肪酸组成的比较研究. 生物学杂志, 29 (6) : 53–58 |
| 郭斌, 2008.文昌鱼GH/IGF轴的证明:文昌鱼IGF的克隆、表达、功能及其受GH作用上调表达.青岛:中国海洋大学硕士学位论文 |
| 陶敏, 钟欢, 刘少军, 等, 2012. 日本白鲫IGF-I基因全长cDNA克隆及组织表达分析. 生命科学研究, 16 (4) : 295–300 |
| 常抗美, 郑孝亮, 刘慧慧, 等, 2012. 大黄鱼(Larimichthys crocea) IGF-I基因的克隆及序列分析. 海洋与湖沼, 43 (1) : 35–40 |
| 彭士明, 林少珍, 施兆鸿, 等, 2013. 饲养密度对银鲳幼鱼增重率及消化酶活性的影响. 海洋渔业, 35 (1) : 72–76 |
| 彭士明, 施兆鸿, 孙鹏, 等, 2010. 养殖密度对银鲳幼鱼生长及组织生化指标的影响. 生态学杂志, 29 (7) : 1371–1376 |
| 谢碧文, 2008.南方鲇POMC、TSHβ亚基和SL cDNA克隆及垂体激素基因的时空表达.重庆:西南大学博士学位论文 |
| Cao Q P, Duguay S T, Plisetskaya E, et al, 1989. Nucleotide sequence and growth hormone-regulated expression of salmon insulin-like growth factor I mRNA. Molecular Endocrinology, 3 (12) : 2005–2010 DOI:10.1210/mend-3-12-2005 |
| Chen M H C, Lin G H, Gong H Y, et al, 1998. Cloning and characterization of insulin-like growth factor I cDNA from black seabream (Acanthopagrus schlegeli). Zoological Studies, 37 (3) : 213–221 |
| Duan C M, 1998. Nutritional and developmental regulation of insulin-like growth factors in fish. The Journal of Nutrition, 128 (2) : 306S–314S |
| Duguay S J, Park L K, Samadpour M, et al, 1992. Nucleotide sequence and tissue distribution of three insulin-like growth factor I prohormones in salmon. Molecular Endocrinology, 6 (8) : 1202–1210 |
| Gabillard J C, Weil C, Rescan P Y, et al, 2003. Effects of environmental temperature on IGF1, IGF2, and IGF type I receptor expression in rainbow trout (Oncorhynchus mykiss). General and Comparative Endocrinology, 133 (2) : 233–242 DOI:10.1016/S0016-6480(03)00167-9 |
| Hashimoto H, Mikawa S, Takayama E, et al, 1997. Molecular cloning and growth hormone-regulated gene expression of carp insulin-like growth factor-I. Biochemistry and Molecular Biology International, 41 (5) : 877–886 |
| Hitchcock P F, Otteson D C, Cirenza P F, 2001. Expression of the insulin receptor in the retina of the goldfish. Investigative Ophthalmology & Visual Science, 42 (9) : 2125–2129 |
| Hober S, Forsberg G, Palm G, et al, 1992. Disulfide exchange folding of insulin-like growth factor I. Biochemistry, 31 (6) : 1749–1756 DOI:10.1021/bi00121a024 |
| Larsen D A, Beckman B R, Dickhoff W W, 2001. The effect of low temperature and fasting during the winter on metabolic stores and endocrine physiology (insulin, insulin-like growth factor-I, and thyroxine) of coho salmon, Oncorhynchus kisutch. General and Comparative Endocrinology, 123 (3) : 308–323 DOI:10.1006/gcen.2001.7677 |
| Li J Z, Liu Z H, Wang D S, et al, 2011. Insulin-like growth factor 3 is involved in oocyte maturation in zebrafish. Biology of Reproduction, 84 (3) : 476–486 DOI:10.1095/biolreprod.110.086363 |
| Livak K J, Schmittgen T D, 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCt method. Methods, 25 (4) : 402–408 DOI:10.1006/meth.2001.1262 |
| Magee B A, Shooter G K, Wallace J C, et al, 1999. Insulin-like growth factor I and its binding proteins:a study of the binding interface using B-domain analogues. Biochemistry, 38 (48) : 15863–15870 DOI:10.1021/bi9910070 |
| Metón I, Caseras A, CantóE, et al, 2000. Liver insulin-like growth factor-I mRNA is not affected by diet composition or ration size but shows diurnal variations in regularly-fed gilthead sea bream (Sparus aurata). The Journal of Nutrition, 130 (4) : 757–760 |
| Patruno M, Sivieri S, Poltronieri C, et al, 2008. Real-time polymerase chain reaction, in situ hybridization and immuno histochemical localization of insulin-like growth factor-I and myostatin during development of Dicentrarchus labrax (Pisces:Osteichthyes). Cell and Tissue Research, 331 (3) : 643–658 DOI:10.1007/s00441-007-0517-0 |
| Pedroso F L, De Jesus-Ayson E G T, Cortado H H, et al, 2006. Changes in mRNA expression of grouper (Epinephelus coioides) growth hormone and insulin-like growth factor I in response to nutritional status. General and Comparative Endocrinology, 145 (3) : 237–246 DOI:10.1016/j.ygcen.2005.09.001 |
| Perks C M, Denning-Kendall P A, Gilmour R S, et al, 1995. Localization of messenger ribonucleic acids for insulin-like growth factor I (IGF-I), IGF-Ⅱ, and the type 1 IGF receptor in the ovine ovary throughout the estrous cycle. Endocrinology, 136 (12) : 5266–5273 |
| Reinecke M, Björnsson B T, Dickhoff W W, et al, 2005. Growth hormone and insulin-like growth factors in fish:where we are and where to go. General and Comparative Endocrinology, 142 (1-2) : 20–24 DOI:10.1016/j.ygcen.2005.01.016 |
| Reinecke M, Collet C, 1998. The phylogeny of the insulin-like growth factors. International Review of Cytology, 183 : 1–94 DOI:10.1016/S0074-7696(08)60142-4 |
| Rinderknecht E, Humbel R E, 1978. Primary structure of human insulin-like growth factor Ⅱ. Febs Letters, 89 (2) : 283–286 DOI:10.1016/0014-5793(78)80237-3 |
| Roith D L, Scavo L, Butler A, 2001. What is the role of circulating IGF-I?. Trends in Endocrinology & Metabolism, 12 (2) : 48–52 |
| Shamblott M J, Chen T T, 1993. Age-related and tissue-specific levels of five forms of insulin-like growth factor mRNA in a teleost. Molecular Marine Biology & Biotechnology, 2 (6) : 351–361 |
| Sjögren K, Liu J L, Blad K, et al, 1999. Liver-derived insulin-like growth factor I (IGF-I) is the principal source of IGF-I in blood but is not required for postnatal body growth in mice. Proceedings of the National Academy of Sciences of the United States of America, 96 (12) : 7088–7092 DOI:10.1073/pnas.96.12.7088 |
| Tanaka M, Taniguchi T, Yamamoto I, et al, 1998. Gene and cDNA structures of flounder insulin-like growth factor-I (IGF-I):multiple mRNA species encode a single short mature IGF-I. DNA and Cell Biology, 17 (10) : 859–868 DOI:10.1089/dna.1998.17.859 |
| Vong Q P, Chan K M, Leung K, et al, 2003. Common carp insulin-like growth factor-I gene:complete nucleotide sequence and functional characterization of the 5'-flanking region. Gene, 322 : 145–156 DOI:10.1016/j.gene.2003.08.019 |
| Wang D S, Jiao B W, Hu C J, et al, 2008. Discovery of a gonad-specific IGF subtype in teleost. Biochemical and Biophysical Research Communications, 367 (2) : 336–341 DOI:10.1016/j.bbrc.2007.12.136 |
| Wen H S, Lin H R, Dong X, et al, 2002. Seasonal changes and neuroendocrine regulation of growth hormone secretion in feral Catfish (Silurus asotus). Acta Zoologica Sinica, 48 (2) : 213–220 |
| Zhang W, Gustafson T A, Rutter W J, et al, 1994. Positively charged side chains in the insulin-like growth factor-1 C-and D-regions determine receptor binding specificity. The Journal of Biological Chemistry, 269 (14) : 10609–10613 |
 2016, Vol. 47
2016, Vol. 47


