中国海洋湖沼学会主办。
文章信息
- 杨移斌, 杨秋红, 胥宁, 董靖, 刘永涛, 艾晓辉. 2016.
- YANG Yi-Bin, YANG Qiu-Hong, XU Ning, DONG Jing, LIU Yong-Tao, AI Xiao-Hui. 2016.
- 斑点叉尾鮰(Ictalunes punctatus)源中间气单胞菌(Aeromonas media)分离鉴定及药敏特性
- ISOLATION AND IDENTIFICATION OF AEROMONAS MEDIA FROM ICTALUNES PUNCTATUS AND ITS ANTIBIOTIC SENSITIVITY
- 海洋与湖沼, 47(6): 1199-1204
- Oceanologia et Limnologia Sinica, 47(6): 1199-1204.
- http://dx.doi.org/10.11693/hyhz20160500109
-
文章历史
- 收稿日期:2016-05-15
- 收修改稿日期:2016-08-20
2. 淡水水产健康养殖湖北省协同创新中心 武汉 430223
2. Hubei Freshwater Aquaculture Collaborative Innovation Center, Wuhan 430223, China
斑点叉尾鮰(Ictalures Punctatus)又名为美洲鲶及沟鲶, 其分类地位为鲶形目(Siluriformes)、鮰科(Ictaluridae), 在美洲广泛分布, 是北美主要的淡水养殖品种。1984年由湖北省水产科学研究所牵头首次将斑点叉尾鮰引入中国养殖, 目前其养殖已推广到湖南、四川、江西、湖北、安徽等多个省市, 年产量达20多万吨。随着广大养殖从业者及科研工作的努力, 掌握了斑点叉尾鮰繁育、养殖、加工等整套技术, 并进行了大范围应用推广, 使得斑点叉尾鮰形成了从鱼苗繁育、成鱼养殖、食品加工及出口完整的产业链条, 是中国淡水养殖业独具特色的产业。但近年来, 养殖户为了追求高产, 盲目扩大养殖规模, 提高养殖密度, 导致养殖水环境进一步恶化, 大规模病害时有发生, 引起了较大经济损失。目前报道的斑点叉尾鮰病原主要有气单胞菌属(刘堂水等, 2006; 刘韬等, 2016)、爱德华氏菌(梁万文等, 2007)、嗜麦芽寡养单胞菌(耿毅等, 2007)、海豚链球菌(陈德芳, 2011)、鲁氏耶尔森氏菌(范方玲等, 2010)等。疾病暴发导致药物滥用的现象频发, 不合理的用药剂量及方式常导致病害防控失败, 并可能使病原产生耐药性(张文文, 2014), 从而形成恶性循环。因此病害成为养殖产业发展的一大障碍。
2015年10月湖南常德地区网箱养殖的斑点叉尾鮰暴发大规模死亡, 发病迅速, 死亡率高, 发病波及整个养殖水面。发病规格主要为商品鱼, 养殖户损失较大。本研究从患病的斑点叉尾鮰体内分离到一株高致病性的菌株, 通过回归感染、鉴定及药敏分析等研究, 确定了斑点叉尾鮰该病的病原菌及其种类。
1 材料与方法 1.1 材料 1.1.1 病鱼及感染用鱼患病斑点叉尾鮰 (0.75±0.3kg, 体长25±2cm)10尾取自常德网箱养殖基地, 具备该病的典型症状; 健康斑点叉尾尾鮰 (75±10g, 体长10±0.8cm)购置武汉某水产市场, 体格健壮, 无伤病, 暂养7d无异常后进行实验。
1.1.2 主要试剂普通营养琼脂、普通营养肉汤、水解酪蛋白琼脂(Casein hydrolysate agar, 中文别名: M-H琼脂)、脑心浸出液(Brain Heart Infusion, BHI)、革兰氏染色液、药敏纸片及细菌生化微量鉴定管购自杭州微生物试剂有限公司; PCR所用试剂、特异性引物及细菌基因组DNA提取试剂盒均购自上海生工。
1.2 方法 1.2.1 病害临床诊断对网箱养殖斑点叉尾鮰发病死亡情况进行调查, 实地查看养殖水环境、密度及养殖面积等基本情况, 了解发病斑点叉尾鮰规格。通过肉眼及光学显微镜观察多个死亡病例, 掌握疾病的基本症状, 并取样进行细菌分离实验。
1.2.2 细菌分离实验选择腹部出血濒临死亡的斑点叉尾鮰10尾, 在无菌环境下取其肝、肾脏、脾脏、血水及腹水用于细菌分离, 用接种环蘸取各样品于NA及BHI平板上划线, 恒温28℃培养24h后, 挑取颜色相近、大小相同及数量较多的菌落再纯化, 将分离得到的菌株与25%甘油混匀后置于-80℃冰箱, 命名为zy02。
1.2.3 回归感染及LC50测定人工感染将zy02菌株接种于NA平板, 恒温28℃培养18 h, 用无菌生理盐水洗下菌苔, 并调整菌悬液浓度为5.8 × 108CFU/mL。
将感染用鱼分为实验组和对照组, 每组斑点叉尾鮰都是10尾, 实验组和对照组均设置2个重复。实验过程, 水体溶氧控制在6.0-7.5mg/L, 水温23-25℃, 实验过程中保持水质良好, 不投喂饵料。实验组斑点叉尾鮰腹腔注射zy02菌液0.1mL/尾, 对照组实验鱼在相同部位注射等量无菌生理盐水。每6h检查斑点叉尾鮰的活动情况, 以及鱼体有无出血, 记录发病死亡情况, 并对濒死的实验鱼解剖, 观察重要脏器病变症状, 进一步病原菌分离。
细菌LC50测定将分离的病原菌制成的菌悬液分别稀释成6.4×104、6.4×105、6.4×106、6.4×107、6.4×108、6.4×109 CFU/mL, 然后分别从腹鳍基部注射到健康的斑点叉尾鮰体内, 进行攻毒实验, 每尾注射剂量为0.1mL。对照组的斑点叉尾鮰注射等量的无菌生理盐水, 实验组及对照组均设置2个重复每组的实验鱼各10尾, 水温保持在23-25℃。实验周期为7d, 连续观察斑点叉尾鮰活动情况, 并记录实验鱼的死亡尾数, 并用概率单位图解法(徐叔云等, 2002)计算半数致死浓度(LC50)。
1.2.4 zy02菌株生理生化特性测定将zy02菌株划线于NA及BHI平板上, 恒温28℃培养24h后, 观察菌落大小、形态特征及其颜色, 并进行革兰氏染色, 采用细菌生化微量鉴定参照文献(东秀珠等, 2001)测定生理生化指标。
1.2.5 细菌16S rDNA与gyrB基因测序模板制备将菌株zy02接种于营养肉汤中, 置于摇床恒温28℃摇荡(200r/min)18 h, 将菌液经高速离心后收集菌体, 提取DNA即作为PCR模板。
16S rDNA测序引物为27F: 5′-AGAGTT TGATC (C/A) TGGCTCAG-3′, 反向1492R: 5′-GGTT ACCTTGTTACGACTT-3′。参照祝璟琳等(2010)方法进行PCR反应扩增目的基因。扩增产物确定为目的片段后送上海生工纯化及序列测定。
gyrB测序引物参照Yamamoto等(1995)为UP1(正向引物): 5′-GAA GTC ATC ATG ACC GTT CTG CAY GCNGGN GGN AAR TTY GA-3′, UP2(反向引物): 5′-AGCAGG GTA CGG ATG TGC GAG CCR TCN ACR TCNGCR TCN GTCAT-3′。PCR反应条件为参照邴旭文等(2009)。扩增片段送上海生工纯化测序。
构建系统发育树将zy02菌株16S rDNA及gryB基因与GenBank中已有序列进行比对, 根据比对结果检索出同源性较高的序列采用Clustal X软件进行多序列匹配分析, 通过MEGA5.1软件Neighbor-Joining法构建系统进化树, 1000次Bootstrap检验置信度。
1.2.6 zy02菌株药物敏感性实验本次通过K-B法, 将菌株zy02接种于营养肉汤中, 28℃震荡(200r/min)18h调整菌液浓度为1.0×107CFU/mL, 取稀释菌液200μL均匀涂布于水解酪蛋白琼脂培养基上, 贴上不同的药敏纸片, 恒温28℃培养24h后测量抑菌圈直径(mm), 根据杭州微生物试剂有限公司药敏纸片抑菌圈标准确定致病菌株对药物的敏感程度。
2 结果 2.1 临床诊断2015年10月对湖南常德地区网箱斑点叉尾鮰暴发性病害进行了临床诊断。网箱架设水域生活垃圾较多, 水质发黑, 氨氮偏高。斑点叉尾鮰发病死亡率高, 发病死亡规格主要集中在商品鮰鱼。其自然发病症状表现为体表腹部有明显出血点, 肛门红肿有大量血水流出。解剖后发现其肝脏及脾脏发黑, 肾脏严重充血, 心脏肿大, 腹腔内大量血水。
2.2 细菌分离从自然发病斑点叉尾鮰肝脏、肾脏、腹水及血水中分离到同一株优势菌zy02。经过人工感染实验, 分离菌株zy02对斑点叉尾鮰具有很强的致病力, 腹腔注射感染斑点叉尾鮰, 其在48h内死亡率达到100%。感染发病死亡的斑点叉尾鮰腹部有明显出血点, 解剖发现其腹腔有大量液体积聚, 各组织器官出现不同程度充血。并从人工回归感染濒死的病鱼体内再分离到与菌株zy02形态特征及理化特性一致的菌株。根据建立的实验鱼死亡率(%)与菌液浓度对数[lg (CFU/mL)]的关系曲线: y=0.27x-1.2787(图 1), 分离菌株zy02对斑点叉尾鮰半数致死浓度LC50=3.89×106CFU/mL, 根据Devesa (1985)对鱼类致病菌毒力的划分标准, 可判定分离菌株zy02对斑点叉尾鮰具有很强的毒力。
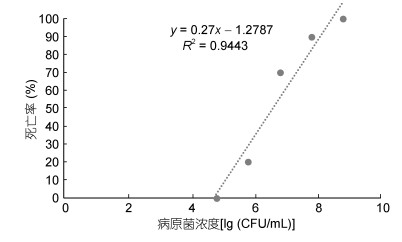 |
| 图 1 斑点叉尾鮰死亡率(%)与菌液浓度对数[lg (CFU/mL)]的关系曲线 Fig. 1 Relationship between I. punctatus mortality and logarithmic bacterial concentration |
分离菌株zy02为革兰氏阴性杆菌, 无运动性, 详细理化特性如表 1所述, zy02菌株理化特性与中间气单胞菌Aeromonas media一致。通过将16S rDNA及gyrB序列分析的结果与NCBI基因库中已有序列比对, 结果显示菌株zy02与气单胞菌属种类同源性最高, 通过构建系统发育树分析(图 2, 图 3), 其结果显示菌株zy02与中间气单胞菌Aeromonas media聚为一支, 同源性达到99% (图 2, 图 3)。综合生理生化特征测定结果, 菌株zy02判定为中间气单胞菌Aeromonas media。
| 测定项目 | 结果 | 测定项目 | 结果 | ||
| zy02 | A. media | zy02 | A. media | ||
| 革兰氏染色 | - | - | 硫化氢 | - | - |
| 运动性 | - | - | 丙二酸盐 | - | - |
| M.R反应 | + | + | 半乳糖 | + | + |
| V-P反应 | - | - | 甘油 | + | d |
| 产生吲哚 | - | d | 尿素 | - | - |
| KCN生长 | + | + | 阿拉伯糖醇 | - | - |
| 鸟氨酸脱羧酶 | - | - | 阿拉伯糖 | + | + |
| 苯丙氨酸脱氨酶 | + | d | 纤维二糖 | + | + |
| 赖氨酸脱羧酶 | - | - | 明胶液化 | + | + |
| 精氨酸双水解酶 | + | + | D-葡萄糖产酸 | + | + |
| 麦芽糖 | + | + | D-葡萄糖产气 | - | - |
| 阿东醇 | - | - | 蜜二糖 | - | - |
| 柠檬酸盐 | + | d | D-甘露糖 | + | + |
| D-甘露醇 | + | + | |||
| 注: “+”:阳性; “-”:阴性; “d”: 11%-89%菌株为阳性 | |||||
 |
| 图 2 zy02株根据16S rDNA基因序列构建的系统进化树 Fig. 2 Phylogenetic tree based on 16S rDNA gene sequence of strain zy02 |
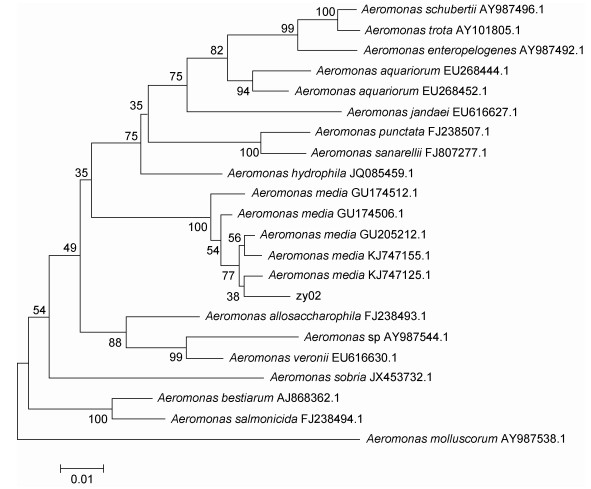 |
| 图 3 zy02株根据gyrB基因序列构建的系统进化树 Fig. 3 Phylogenetic tree based on gyrB gene sequence of strain zy02 |
药敏特性研究结果显示:菌株zy02对环丙沙星、氯霉素、氟苯尼考及诺氟沙星等13种药物高度敏感; 对红霉素中度敏感; 对阿莫西林、磺胺异噁唑、克林霉素及利福平等5种药物耐药。具体见表 2。
| 药物 | 抑菌圈直径判断标准(mm) | 药物含量(μg/片) | 抑菌圈直径(mm) | 敏感性 | ||
| 不敏感 | 中度敏感 | 高度敏感 | ||||
| 环丙沙星 | ≤15 | 16-20 | ≥21 | 5 | 30 | 高度敏感 |
| 阿莫西林 | ≤13 | 14-17 | ≥18 | 20 | 0 | 不敏感 |
| 磺胺异噁唑 | ≤12 | 13-16 | ≥17 | 300 | 0 | 不敏感 |
| 氯霉素 | ≤12 | 13-17 | ≥18 | 300 | 33 | 高度敏感 |
| 氟苯尼考 | ≤12 | 13-17 | ≥18 | 75 | 28 | 高度敏感 |
| 克林霉素 | ≤14 | 15-20 | ≥21 | 2 | 0 | 不敏感 |
| 利福平 | ≤16 | 17-19 | ≥20 | 5 | 6 | 不敏感 |
| 诺氟沙星 | ≤12 | 13-16 | ≥17 | 10 | 33 | 高度敏感 |
| 阿奇霉素 | ≤13 | 14-17 | ≥18 | 15 | 26 | 高度敏感 |
| 红霉素 | ≤13 | 14-22 | ≥23 | 15 | 22 | 中度敏感 |
| 新霉素 | ≤12 | 13-16 | ≥17 | 30 | 25 | 高度敏感 |
| 多西环素 | ≤12 | 13-15 | ≥16 | 30 | 24 | 高度敏感 |
| 左氧氟沙星 | ≤13 | 14-16 | ≥17 | 5 | 30 | 高度敏感 |
| 链霉素 | ≤11 | 12-14 | ≥15 | 10 | 22 | 高度敏感 |
| 妥布霉素 | ≤12 | 13-14 | ≥15 | 10 | 20 | 高度敏感 |
| 庆大霉素 | ≤12 | 13-14 | ≥15 | 10 | 24 | 高度敏感 |
| 丁胺卡那霉素 | ≤14 | 15-16 | ≥17 | 30 | 25 | 高度敏感 |
| 头孢噻肟 | ≤14 | 15-22 | ≥23 | 30 | 34 | 高度敏感 |
| 苯唑西林 | ≤10 | 11-12 | ≥13 | 1 | 0 | 不敏感 |
气单胞菌按照新的分类方式, 隶属于新建的气单胞菌科(Colwell et al, 1986), 是兼性厌氧革兰氏阴性杆菌种类。气单胞菌大部分种类广泛分布于水体、污泥、土壤及空气中, 其中数种如嗜水气单胞菌(陆承平, 1992)、维氏气单胞菌(马志宏等, 2009)、温和气单胞菌(刘方等, 2016)及杀鲑气单胞菌(杨嘉龙等, 2007)等都是水生动物重要病原菌, 可引起多种水产动物如斑点叉尾鮰 (刘堂水等, 2006; 梁万文等, 2007; 耿毅等, 2007)、大鲵(凌空等, 2015)、锦鲤(姜艳丽, 2015)、南方大口鲶(贺蓉等, 2005)、西伯利亚鲟(马志宏等, 2009)及黄颡鱼(刘方等, 2016)等大量死亡。而中间气单胞菌对水生动物致病的报道相对较少, 仅黄文明等(2013)报道了中间气单胞菌引起胭脂鱼发病及王高学等(2007)报道了中间气单胞菌引起刺参腐皮病。本研究通过病原分离纯化鉴定及人工感染等实验, 证实了本次斑点叉尾鮰出血性死亡是由中间气单胞菌感染引起的, 在国内尚属首次报道。水生动物出血病一般由气单胞菌种类引起, 但可能因地域差异、养殖水域环境及养殖种类等不同, 导致发病的病原也不尽相同, 本次报道中间气单胞菌引起斑点叉尾鮰出血性死亡, 为斑点叉尾鮰疾病防控提供了新的参考依据。
本对菌株zy02鉴定时, 不仅测定了其理化特性, 而且对其16S rDNA和gyrB基因序列进行了分析, 从分子角度进行鉴定。gyrB基因即促旋酶(Gyrase)的B亚单位基因, 该基因序列全长约为1.2-1.4kb, 其平均碱基替换率为100万年替换0.7%-0.8%, 比16S rDNA基因的每5000万年替换1%的替换率要快, 因此gyrB基因具有更高的分辨率, 特别在区分和鉴定近缘菌种方面较16S rDNA基因更具优势(郝云婕等, 2008), 从而使得本次中间气单胞菌的鉴定结果更加准确。
在病害防控过程中使用抗生素进行治疗, 以达到减少经济损失的目的通常采用的措施之一。但随着疾病暴发频率及规模不断升级, 抗生素滥用时有发生, 在此过程中很可能产生大量耐药菌株。本次以19种抗生素对分离菌株zy02进行了药敏测定, 结果显示菌株zy02对阿莫西林、磺胺异噁唑、克林霉素及利福平等5种抗生素耐药。黄文明等(2013)研究表明来自胭脂鱼体内分离的中间气单胞菌对庆大霉素、氟苯尼考等高度敏感, 对利福平中度敏感; 王高学等(2007)研究表明中间气单胞菌仅对氟苯尼考等高度敏感, 而对硫酸庆大霉素等耐药, 与本文结果有差异。其原因可能在于菌株来源、地理环境及用药情况等不同, 导致不同的耐药结果。为此我们在生产疾病防控时, 严格选择高度敏感药物交替使用, 同时注意使用药物的剂量及疗程, 最大程度上避免病原菌的耐药性产生。
| 马志宏, 杨慧, 李铁梁, 等, 2009. 西伯利亚鲟(Acipenser baerii)致病性维氏气单胞菌的分离鉴定. 微生物学报, 49 (10) : 1289–1294 |
| 王高学, 原居林, 赵云奎, 等, 2007. 刺参表皮溃烂病病原菌的分离鉴定与药敏试验. 西北农林科技大学学报:自然科学版, 35 (8) : 87–90 |
| 东秀珠, 蔡妙英, 2001. 常见细菌系统鉴定手册. 北京: 科学出版社, 116-118 |
| 刘方, 孟丽华, 杨淑英, 等, 2016. 黄颡鱼肌肉腐烂病研究及治疗技术初探. 中国渔业质量与标准, 6 (1) : 63–70 |
| 刘韬, 王二龙, 汪开毓, 等, 2016. 河南中牟地区斑点叉尾突发性败血症病原分离及鉴定. 中国预防兽医学报, 38 (1) : 53–57 |
| 刘堂水, 汪成竹, 陈昌福, 2006. 斑点叉尾细菌性病原的分离与鉴定. 华中农业大学学报, 25 (5) : 550–554 |
| 杨嘉龙, 周丽, 邢婧, 等, 2007. 养殖刺参溃疡病杀鲑气单胞菌的分离、致病性及胞外产物特性分析. 中国水产科学, 14 (6) : 981–989 |
| 邴旭文, 阎斌伦, 张晓君, 等, 2009. 泥鳅(Misgurnus anguillicaudatus)病原霍乱弧菌(Vibrio cholerae)的表型与分子鉴定. 海洋与湖沼, 40 (6) : 692–698 |
| 张文文, 2014.常用渔药有效含量、杀菌效果比较及抗生素耐药性初步研究.舟山:浙江海洋学院硕士学位论文 http://cdmd.cnki.com.cn/Article/CDMD-10340-1014219574.htm |
| 陆承平, 1992. 致病性嗜水气单胞菌及其所致鱼病综述. 水产学报, (3) : 282–288 |
| 陈德芳, 2011.斑点叉尾海豚链球菌病病原学、病理学和诊断方法研究.雅安:四川农业大学博士学位论文 http://cdmd.cnki.com.cn/Article/CDMD-10626-1011222372.htm |
| 范方玲, 汪开毓, 耿毅, 等, 2010. 斑点叉尾(Ictalunes punctatus)源鲁氏耶尔森氏菌的分离鉴定及系统发育分析. 海洋与湖沼, 41 (6) : 862–868 |
| 郝云婕, 韩素贞, 2008. gyrB基因在细菌系统发育分析中的应用. 生物技术通报, (2) : 39–41 |
| 姜艳丽, 2015.嗜水气单胞菌毒力基因检测及其在锦鲤组织中的分布研究.哈尔滨:东北林业大学硕士学位论文 http://cdmd.cnki.com.cn/Article/CDMD-10225-1015665374.htm |
| 祝璟琳, 杨弘, 邹芝英, 等, 2010. 海南养殖罗非鱼(Oreochromis niloticus)致病链球菌的分离、鉴定及其药敏试验. 海洋与湖沼, 41 (4) : 590–596 |
| 贺蓉, 陈礼强, 王金胜, 等, 2005. 南方大口鲶对温和气单胞菌的免疫反应. 西南农业大学学报:自然科学版, 27 (5) : 692–695 |
| 耿毅, 汪开毓, 陈德芳, 等, 2007. 斑点叉尾嗜麦芽寡养单胞菌的分离鉴定及系统发育分析. 中国兽医学报, 27 (3) : 330–335 |
| 徐叔云, 卞如濂, 陈修, 2002. 药理实验方法学. 3版. 北京: 人民卫生出版社, |
| 凌空, 丁诗华, 2015. 大鲵致病性嗜水气单胞菌主要毒力基因的生物信息学分析. 中国兽医杂志, 51 (5) : 83–86 |
| 黄文明, 王利, 冀国桢, 等, 2013. 胭脂鱼维氏气单胞菌和中间气单胞菌的鉴定及药物敏感性. 水产科学, 32 (4) : 210–214 |
| 梁万文, 陈明, 余晓丽, 等, 2007. 斑点叉尾肠败血症病原菌的分离与鉴定. 西南农业学报, 20 (5) : 1124–1129 |
| Colwell R R, Macdonell M T, de Ley J, 1986. Proposal to recognize the Family Aeromonadaceae fam. nov.Int J Syst Bacteriol, 36 (3) : 473–477 DOI:10.1099/00207713-36-3-473 |
| Devesa S, 1985. First report of vibriosis in turbot (Scophthalmus maximus) cultured in Northwestern Spain:fish and shellfish pathology. New York: Academic Press, |
| Yamamoto S, Harayama S, 1995. PCR amplification and direct sequencing of gyrB genes with universal primers and their application to the detection and taxonomic analysis of Pseudomonas putida strains. Appl Environ Microbiol, 61 (3) : 1104–1109 |
 2016, Vol. 47
2016, Vol. 47


