中国海洋湖沼学会主办。
文章信息
- 蓝昭军, 李强, 舒琥, 谷平华, 王杭军, 吴土金. 2016.
- LAN Zhao-Jun, LI Qiang, SHU Hu, GU Ping-Hua, WANG Hang-Jun, WU Tu-Jin. 2016.
- 基于线粒体细胞色素b基因的光倒刺鲃遗传多样性与遗传结构研究
- GENETIC DIVERSITY AND STUUCTURE OF SPINIBARBUS HOLLANDI BASED ON NUCLEOTIDE SEQUENCES OF MTDNA CYTOCHROME B GENE
- 海洋与湖沼, 47(6): 1158-1165
- Oceanologia et Limnologia Sinica, 47(6): 1158-1165.
- http://dx.doi.org/10.11693/hyhz20160300064
-
文章历史
- 收稿日期:2016-03-21
- 收修改稿日期:2016-05-27
2. 广州大学生命科学学院 广州 510006
2. School of Life Science, Guangzhou University, Guangzhou 510006, China
光倒刺鲃(Spinibarbus hollandi)隶属于鲤形目(Cypriniformes), 鲤科(Cyprinidae), 鲃亚科(Barbinae), 倒刺鲃属(Spinibarbus), 俗称青娟、鲣中、坑娟等, 分布于长江、钱塘江、闽江、九龙江、珠江、元江、台湾岛及海南岛等诸水系(中国水产科学研究院珠江水产研究所等, 1991; 乐佩琦, 2000)。光倒刺鲃体厚肉肥, 味鲜嫩, 是一种重要的经济鱼类。目前, 随着光倒刺鲃的人工驯养及繁育技术获得成功(罗钦洪等, 1999)及多年的推广养殖, 光刺倒鲃已成为华南及华东等地重要的养殖鱼类之一。了解其种群遗传多样性和遗传结构等方面的特征, 可为其种质资源的保护和利用提供科学依据。然而, 目前有关光倒刺鲃群体遗传多样性、遗传结构及亲缘地理等方面的研究较少(唐琼英等, 2003; 黄种持等, 2008), 且已有研究所涉及的种群较少。
线粒体DNA (mtDNA)遵循严格的母系遗传, 无遗传重组, 通常能够全面反映种群内和种群间的遗传变异, 这对于探讨种群遗传结构和进化关系具有很高的价值(郭新红等, 2004), 因此被广泛用于探讨种群遗传结构或有机体变异历史(肖武汉等, 2000; Liu et al, 2004), 且在水生动物群体遗传学和进化生物学研究中得到了广泛应用(刘云国, 2009)。在线粒体DNA中, 细胞色素b基因(Cytb)是线粒体13个蛋白编码基因中结构和功能被研究得最为清楚的基因之一, 且进化速度适中, 适合种群水平差异的检测(Mayer et al, 1990)。本研究中, 作者在中国南方采集了8个水系的光倒刺鲃样本, 对其线粒体Cyt b基因序列进行了测定与分析, 旨在更全面地了解其遗传多样性和遗传结构, 为其保护和利用提供科学依据。
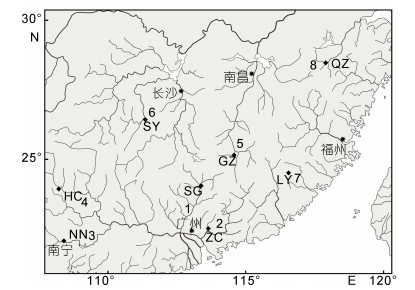
1 材料与方法 1.1 样品采集本研究所用样品均为2015年7-12月采自广西壮族自治区、广东省、湖南省、江西省、福建省和浙江省等地。将所有个体按所采样的水系进行种群划分, 即用水系名称对种群进行命名。具体的采样点见图 1, 各采样点样品信息见表 1。
| 群体 | 采集地 | 样品数 | 单倍型数 | 单倍型(个体数) | 单倍型多样性(h) | 核苷酸多样性(π) | |
| 珠江 | 1北江(BJ) | 韶关(SG) | 54 | 6 | H1(24)、H2(25)、H3(1)、H4(2)、H5(1)、H6(1) | 0.597 | 0.0136 |
| 2东江(DJ) | 增城(ZC) | 8 | 2 | H2(7)、H7(1) | 0.250 | 0.0002 | |
| 3郁江(YJ) | 南宁(NN) | 20 | 3 | H1(1)、H8(18)、H9(1) | 0.195 | 0.0003 | |
| 4柳江(LJ) | 河池(HC) | 20 | 3 | H1(13)、H8(1)、H10(6) | 0.511 | 0.0005 | |
| 长江 | 5赣江(GJ) | 赣州(GZ) | 45 | 3 | H2(5)、H11(39)、H12(1) | 0.241 | 0.0061 |
| 6资江(ZJ) | 邵阳(SY) | 6 | 3 | H13(1)、H14(1)、H15(4) | 0.600 | 0.0008 | |
| 7九龙江(JLJ) | 龙岩(LY) | 18 | 2 | H11(16)、H16(2) | 0.209 | 0.0051 | |
| 8钱塘江(QTJ) | 衢州(QZ) | 20 | 1 | H11(20) | 0 | 0 | |
| 全部样本 | - | 191 | 16 | - | 0.761 | 0.0120 | |
基因组DNA的提取参考庆宁等(2010)的方法, 即采用从生工生物工程(上海)股份有限公司购买的“基因组DNA抽提试剂盒”所示方法, 略有改动。PCR反应体系:反应体系约25μL, 按顺序分别将PCR Master Mix12.5μL、Primer F 1μL、Primer R 1μL、模板DNA 3μL及灭菌双蒸水7.5μL混合, 每一次反应都用ddH2O代替模板DNA做阴性对照。PCR扩增反应在TaKaRa (TP600型) PCR仪上进行, 具体扩增程序如下: ①95°C预变性3min, ②94°C变性30s, ③58°C退火30s, ④72°C延伸80s, 重复步骤②-④35次; 最后72°C延伸10min。利用Primer Primer 5软件设计PCR及测序所用引物L14322和H15638, 由生工生物工程(上海)股份有限公司合成, 其序列分别为: L14322: 5′-ACTGAGACCAATGATTTGAAGAAC-3′; H15638: 5′-TTAGAACTCTGGCTT TGGGAG -3′。PCR产物用1%琼脂糖电泳检验目的片段后, 由生工生物工程(上海)股份有限公司进行纯化并测序。
1.3 数据分析对测得的序列使用Clustal X 1.81软件进行排序比对, 并辅以人工校对。利用软件MEGA 5.0的Kimura’s two-parameter模型计算种群间的遗传距离, 并采用邻接法(Neighbor-joining method, NJ)构建分支系统树(Kumar et al, 2008)。利用Mrbayes 3.1.2和Modeltest v3.7构建贝叶斯树。用软件DNAsp 5.0统计各种群的核苷酸多样性(Nucleotide diversity π)与单倍型多样性(Haplotype diversity h)(Librado et al, 2009); 并利用该软件进行错配分布(Mismatch-distribution)分析及Tajima’s D和Fu’s Fs检验, 以检验种群是否发生过扩张。使用Network 5软件, 以Median-joining法构建各单倍型之间的网络关系图。利用Arlequin Ver 2000软件进行分子变异分析(AMOVA), 分析种群间与地理区间遗传变异程度(Excoffier et al, 1992)。
2 结果与分析 2.1 序列特征本研究共得到191尾光倒刺鲃的Cyt b基因全序列, 序列长1141bp, 无碱基的插入或缺失, Cyt b基因所有序列中, 共51个变异位点, 约占全序列的4.47%, 其中4个为单个多态位点, 47个为简约信息位点。在Cyt b序列中A、C、T、G平均含量分别为29.4%、27.8%、28.5%和14.4%, G的含量明显低于其他三种碱基含量, 表现出很强的碱基组成偏向性。
2.2 单倍型多样性和核苷酸多样性在191尾样本中, 共检测出了16个单倍型, 单倍型多样性为0.761, 核苷酸多样性为0.0120。单倍型多样性(h)分析表明(表 1), 北江、柳江及资江种群的单倍型多样性显著地高于其他种群, 均在0.500以上, 其他种群的单倍型多样性较低, 其中钱塘江种群只有一个单倍型, h值为0;而在核苷酸多样性方面, 北江、赣江及九龙江种群较其他种群高, π值均在0.005以上, 而东江、郁江、柳江、资江、九龙江及钱塘江的核苷酸多样性较低, π值均在0.001以下, 其中钱塘江的π值为0。
在所有16个单倍型中, 有4个为两个或两个以上种群共享的单倍型, 其中, 北江、郁江及柳江种群共享单倍型H1, 北江、东江及赣江种群共享单倍型H2, 郁江及柳江种群共享单倍型H8, 赣江、九龙江及钱塘江种群共享单倍型H11。
2.3 种群间遗传距离及遗传分化表 2显示了不同水系的光倒刺鲃基于Cyt b基因的遗传距离和遗传分化指数。由表 2可知, 东江种群与北江种群的遗传关系较近, 两者的遗传距离为0.0127, 但北江及东江种群与其他种群的遗传距离均相对较高, 北江种群与其他种群的遗传距离均大于0.0150, 而东江种群与其他种群的遗传距离均大于0.0200;除了北江及东江种群外, 其他种群间的遗传距离均相对较低, 其中赣江、资江、九龙江及钱塘江两两之间的遗传距离均小于0.0100。
| 种群 | 北江(BJ) | 东江(DJ) | 郁江(YJ) | 柳江(LJ) | 赣江(GJ) | 资江(ZJ) | 九龙江(JLJ) | 钱塘江(QTJ) |
| 北江(BJ) | - | 0.2839 | 0.4417 | 0.4200 | 0.4045 | 0.3713 | 0.4115 | 0.5098 |
| 东江(DJ) | 0.0127 | - | 0.9910 | 0.9848 | 0.7800 | 0.9812 | 0.8521 | 0.9977 |
| 郁江(YJ) | 0.0155 | 0.0279 | - | 0.6564 | 0.6479 | 0.9464 | 0.7575 | 0.9855 |
| 柳江(LJ) | 0.0150 | 0.0274 | 0.0011 | - | 0.6252 | 0.9142 | 0.7333 | 0.9710 |
| 赣江(GJ) | 0.0171 | 0.0227 | 0.0114 | 0.0108 | - | 0.2901 | -0.0028 | 0.0658 |
| 资江(ZJ) | 0.0158 | 0.0241 | 0.0069 | 0.0063 | 0.0062 | - | 0.3574 | 0.9503 |
| 九龙江(JLJ) | 0.0180 | 0.0247 | 0.0108 | 0.0103 | 0.0057 | 0.0056 | - | 0.0674 |
| 钱塘江(QTJ) | 0.0178 | 0.0261 | 0.0088 | 0.0083 | 0.0035 | 0.0034 | 0.0028 | - |
在遗传分化指数方面, 北江种群与其他种群的遗传分化指数均较低; 东江种群除了与北江种群遗传分化指数较低外, 与其他种群均较高; 钱塘江种群除与北江、赣江及九龙江的遗传分化指数较低外, 与其他种群均较高。
2.4 系统发育分析为更好地了解光倒刺鲃各种群之间的亲缘关系, 利用邻接法(NJ)对16个单倍型进行系统发育分析, 构建分子系统发育树(图 1), 以Mrbayes 3.1.2构建的贝叶斯树与NJ树的结果基本一致。在光倒刺鲃各种群间, 聚成Ⅰ和Ⅱ两支。资江、钱塘江、郁江和柳江的全部样本以及北江、赣江和九龙江的部分样本组成了Ⅰ支, 而东江水系的全部样本及北江、赣江和九龙江水系的部分样本则组成了Ⅱ支。在Ⅰ支中, 又可分为A和B两个姐妹群。A群全部为珠江水系的样本, 包含了柳江、郁江的全部样本及北江的部分样本; B群则包含了资江、钱塘江的全部样本及赣江和九龙江的大部分样本。在支系Ⅱ中, 又可分为C和D两个姐妹群。C群为九龙江的两尾样本; D群则为东江种群的全部样本及北江、赣江种群的部分样本。
2.5 单倍型网络分析图 2显示了光倒刺鲃基于Cyt b基因的单倍型网络亲缘关系, 珠江水系的北江、柳江及郁江种群与长江水系资江和赣江种群的亲缘关系十分密切, 两者各个单倍型之间的变异不大; 北江、东江及赣江种群的亲缘关系亦较为密切, 三者存在共享单倍型; 赣江、九龙江及钱塘江种群共享单倍型H11与资江种群的单倍型变异仅3-4步, 亲缘关系亦较近。单倍型网络图还揭示, 北江种群的特有单倍型H6与北江、东江、赣江共享的单倍型H2之间的变异达29步, H6与九龙江的特有单倍型H16的变异达28步, H2与H16的变异达15步, 表明这些种群的单倍型间发生了较显著的遗传分化。
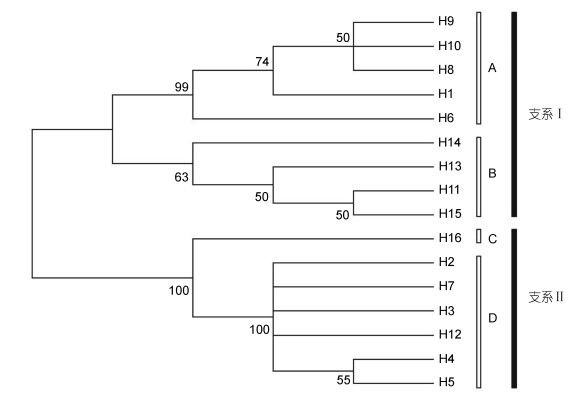 |
| 图 2 光倒刺鲃种群基于Cyt b基因的NJ树 Fig. 2 Neighbor-joining tree ofS. hollandipopulations based on Cyt b gene |
为了解光倒刺鲃种群分子变异的分布模式, 根据水系的不同将光倒刺鲃种群分成4个地理区, 进行分子变异分析(AMOVA)。其中珠江水系为一地理区, 包括西江支流柳江、郁江、北江及东江; 长江水系为一地理区, 包括资江及赣江; 九龙江为一地理区; 钱塘江为一个地理区。AMOVA分析分析表明, 光倒刺鲃地理区之间变异占1.61%, 地理区内种群间约占56.47%, 种群内的变异占45.14%(表 3)。这说明光倒刺鲃地理区之间的分化变异率低, 其Cyt b基因的遗传分化主要来自地理区内的种群之间及种群内。
| 变异来源 | 自由度 | 平方和 | 变异组成 | 变异百分比 |
| 地理区间 | 3 | 342.139 | -0.12161 | -1.61 |
| 地理区内种群间 | 4 | 336.252 | 4.27112 | 56.47 |
| 种群内 | 183 | 624.771 | 3.41405 | 45.14 |
| 合计 | 190 | 1303.162 | 7.56357 | 100.00 |
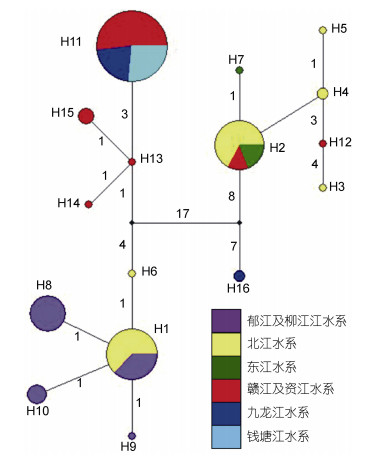 |
| 图 3 基于Cyt b基因的光倒刺鲃种群单倍型网络图 Fig. 3 The haplotype network of Cyt b sequences of S. hollandipopulations 注:两单倍型之间的数字表示单倍型间发生的核苷酸变异数 |
对所有种群进行错配分析发现, 其种群动态呈现多峰分布; 而中性检验也显示, 全部种群的Fu’s Fs和Tajima’s D值均没有呈现显著的负值, 表明其在历史上没有发生过明显的扩张。
在各种群中, 除北江和钱塘江种群外, Tajima’s D值均为负值, 但其统计检验均不显著(P > 0.05);而在Fu’s Fs检验统计中, 除郁江种群的Fu’s Fs值为显著的负值(0.01<P<0.05)外, 其余种群为正值或为负值但统计检验不显著。在错配分析(Mismatch-distribution)中, 各种群的歧点分布分析图谱均呈现多峰型。因此, 综合Tajima’s D检验、Fu’s Fs检验及错配分析的结果, 说明这些种群相对稳定, 没有发生过扩张。
| 种群 | Tajima’s D检验统计量 | Fu’s Fs检验统计量 | |||
| D | P值 | Fs | P值 | ||
| 北江(BJ) | 3.2232 | 0.9940 | 21.0184 | 1 | |
| 东江(DJ) | -1.0548 | 0.2180 | -0.1820 | 0.2130 | |
| 郁江(YJ) | -1.1407 | 0.1990 | -1.2064 | 0.0350 | |
| 柳江(LJ) | -0.0900 | 0.4040 | -0.0601 | 0.3950 | |
| 赣江(GJ) | -0.0698 | 0.5360 | 15.0125 | 0.9990 | |
| 资江(ZJ) | -0.0500 | 0.4380 | -0.4268 | 0.1650 | |
| 九龙江(JLJ) | -1.1223 | 0.1310 | 11.3365 | 0.9990 | |
| 钱塘江(QTJ) | 0 | 1 | 0 | - | |
遗传多样性即基因多样性, 存在于生物个体内、单个物种内以及物种间, 是适应性和进化的基础, 种内的遗传多样性与该物种对环境的适应能力呈正向线性关系(胡静等, 2014)。从遗传和进化角度看, 一个物种的遗传多样性与其适应能力、生存能力和进化潜力等密切相关(孙鹏等, 2011; 陈竹等, 2011)。丰富的遗传多样性可以维持种群的多样性, 其表现出来的遗传多样性也越丰富, 对环境的适应能力就越强, 越容易扩展分布范围和新的生存环境, 而遗传多样性的贫乏或缺失会威胁到种群的生存(沈浩等, 2001)。单倍型间的核苷酸多态性(π)和平均遗传距离是衡量一个种群mtDNA遗传变异的两个重要指标(周慧等, 2006)。由于π值考虑各种mtDNA单倍型在群体中所占比例的特性, 故其更能精确的揭示一个群体的mtDNA的多态程度(肖明松等, 2013)。
在本研究中, 北江、赣江及九龙江种群的π值在0.005以上, 其中北江种群最高, 达0.0136;而东江、郁江、柳江、资江、九龙江及钱塘江的核苷酸多样性较低, 均在0.001以下, 其中钱塘江种群的π值为0。除北江、赣江和九龙江种群外, 其他种群均表现出了较低的核苷酸多样性或单倍型多样性。黄种持等(2008)基于cyt b基因对赣江、九龙江、漓江等三个光倒刺鲃种群的研究亦表明其遗传多样性相对较低。这说明光倒刺鲃目前的遗传多样性较低。
造成此现象的原因之一可能是光倒刺鲃资源遭到了较严重的人为破坏, 导致遗传多样性降低。一方面, 光倒刺鲃目前已成为一种重要养殖鱼类, 然而目前其苗种来源仍以捕捞江河苗种为主, 导致补充群体数量严重不足, 且亲本数量由于捕捞而日益减少, 使其遗传多样性降低。另一方面, 随着各个流域大量各种规格水利工程的建设, 造成光倒刺鲃的栖息地严重萎缩且成片段化、破碎化分布, 阻隔了其基因交流, 导致遗传多样降低。贫乏的遗传多样性必将给物种种质资源的保护和利用带来不利影响(肖志忠等, 2013), 而最大限度地维持种内遗传多样性水平, 是持续利用种质资源的前提和基础(韩承慧等, 2016)。因此, 应加强对光倒刺鲃种质资源的保护, 根据本研究的结果, 可将北江、赣江及九龙江种群作为重点保护单元。
3.2 种群间的遗传分化本研究结果显示, 在珠江水系中, 东江种群与北江种群的遗传关系较近, 两者的遗传距离为0.0127, 但东江种群与西江水系支流郁江和柳江种群的遗传距离分别为0.0279和0.0274, 大于东江与赣江、资江、九龙江和钱塘江的遗传距离, 而系统树和单倍型网络图均得出了类似的结果。这表明东江种群与西江种群存在较大的遗传分化。这与斑鱯(Hemibagrus guttatus)(Yang et al, 2008)、宽鳍鱲(Zacco platypus)(梁晓旭等, 2010)等鱼类不同, 这些鱼类西江、北江及东江种群间的遗传分化不大。从目前珠江水系三大支流的联系来看, 除了西江和北江在广东三水通过思贤滘连通之外, 东江被狮子洋将其与其他两条支流隔离。因此, 造成东江种群与北江种群关系相对较近而与西江种群关系相对较远的原因可能为在间冰期时由于海平面上升东江与北江隔离, 使得东江种群与北江、西江种群发生了分化, 而这三条河流在冰期海平面大幅下降的时候发生了汇聚(Wang et al, 1999; Liu et al, 2003), 使得东江与北江的种群得以交流。另一方面, 从单倍型分布特征及单倍型网络图可知, 东江水系种群与赣江水系种群存在共享单倍型, 而与九龙江种群的部分个体虽存在一定的遗传分化(约15步), 但两者间的亲缘关系较东江与西江、资江及钱塘江种群近。据此, 我们推测东江水系与九龙江水系种群有着较近的亲缘关系, 而随着华南大陆东部的莲花山脉的隆起, 两者间逐渐发生了分化; 而东江水系与赣江水系紧邻, 水系间的袭夺及连接事件可促进种群间的基因交流, 使得东江水系种群与赣江水系种群部分个体存在较近的亲缘关系。这说明东江种群与其流域两侧水系的种群既存在一定程度的隔离, 又存在着基因交流。这可从东江水系鱼类组成特征得到印证:东江水系既有珠江水系特有鱼类, 如沙花鳅(Cobitis arenae)(中国水产科学研究院珠江水产研究所等, 1991)、北江光唇鱼(林小涛等, 2013)等; 亦有与韩江及九龙江等水系共同特有的鱼类, 如裸腹原缨口鳅(Vanmanenia gymnetrus)(叶富良等, 1991)、带刺光唇鱼(Acrossocheilus spinifer)(蓝昭军等, 2015)等; 还有东江水系特有的鱼类, 如三线拟鲿(Pseudobagrus trilineatus)、白线纹胸鮡(Glyptothorax pallozonum)等(叶富良等, 1991; 褚新洛等, 1999)。
NJ树及单倍型网络图还显示, 西江及北江种群与长江水系的资江及赣江水系种群亲缘关系较近, 与马口鱼(Opsariichthys bidens)(Li et al, 2009)和大鳍鳠(Hemibagrus macropterus)(Yang et al, 2009)等鱼类有相似之处。但NJ树亦显示, 光倒刺鲃西江及北江种群与长江水系的资江及赣江水系种群分别位于不同的分支, 说明它们之间存在一定的遗传分化, 其原因可能是南岭山脉的隔离。有研究表明, 南岭山脉在11.06-8.04百万年前已经形成(地质矿产部《南岭项目》构造专题组, 1988)。南岭的隆起, 限制了其南北两侧水系种群的基因交流, 使得其两侧的种群产生了一定程度的遗传分化。
此外, 单倍型分布特征、系统发育分析及单倍型网络图均显示赣江种群与九龙江、钱塘江种群之间的亲缘关系较近。黄种持等(2008)的研究也显示赣江与九龙江种群有着很近的亲缘关系。造成此现象的原因可能是长江水系与九龙江、钱塘江等东南沿海水系发生过袭夺或者连接, 促进了这些种群间的基因交流。
3.3 光倒刺鲃的亲缘地理模式根据单倍型分布的特征、单倍型网络图及NJ树, 可发现光倒刺鲃种群可分为两支, 东江种群与西江种群之间的遗传分化较大, 大于西江种群与长江、钱塘江等种群的遗传分化。而且, 在两个支系中均含有北江水系的样本, 即北江水系内部不同个体存在较大的遗传差异, 表明可能存在二次接触事件。单倍型网络图还显示, 珠江水系的单倍型多位于网络图的中央。
据此, 我们推测光倒刺鲃存在两个扩散中心:北江、西江水系扩散中心及东江水系扩散中心。其扩散路径为:西江及北江水系的种群往北向长江水系扩散, 长江种群尔后往华东沿海的钱塘江及九龙江等水系扩散; 东江水系的种群扩散路径可分为三支, 一支往北向长江水系扩散, 一支往东向北江水系扩散, 一支往西向九龙江等水系扩散, 九龙江水系的种群尔后由于莲花山隆起造成隔离, 与东江水系种群发生了一定程度的遗传分化。
4 结论本研究基于线粒体Cyt b基因分析光倒刺鲃的遗传多样性和群体遗传结构, 为其种质资源的遗传多样性评估、保护利用提供了科学依据。经过遗传多样性分析显示, 除北江、赣江和九龙江种群外, 其他种群均表现出了较低的核苷酸多样性或单倍型多样性。这对光倒刺鲃的保护和合理利用是十分不利的, 故应加强对光倒刺鲃种质资源的保护, 建议将北江、赣江及九龙江种群作为重点保护单元。根据系统发育分析、单倍型网络分析, 光倒刺鲃种群可划分为两支, 据此我们推测光倒刺鲃存在两个扩散中心:北江、西江水系扩散中心及东江水系扩散中心。本研究结果为了解光倒刺鲃的遗传结构和亲缘地理模式提供了科学依据。
| 中国水产科学研究院珠江水产研究所, 华南师范大学, 暨南大学等, 1991.广东淡水鱼类志.广州:广东科技出版社, 140-141 |
| 叶富良, 杨萍, 宋蓓玲, 1991. 东江鱼类区系研究. 湛江水产学院学报, 11 (2) : 1–7 |
| 乐佩琦, 2000. 中国动物志硬骨鱼纲鲤形目(下卷). 北京: 科学出版社, 38-41 |
| 地质矿产部《南岭项目》构造专题组, 1988. 南岭区域构造特征及控岩控矿构造研究. 北京: 地质出版社, 15-25 |
| 庆宁, 丘城锋, 廖伟群, 等, 2010. 华南沿海西部美丽小条鳅基于线粒体控制区的种群遗传变异及亲缘地理格局. 生态学报, 30 (1) : 258–264 |
| 刘云国, 2009. 水产生物DNA分子标记技术. 北京: 科学出版社, 59-62 |
| 孙鹏, 彭士明, 尹飞, 等, 2011. 南海海区鲻鱼(Mugil cephalus) COⅠ基因序列的遗传多样性分析. 海洋与湖沼, 42 (1) : 131–136 |
| 肖志忠, 肖永双, 任桂静, 等, 2013. 条石鲷(Oplegnathus fasciatus)养殖群体与野生群体线粒体控制区序列遗传变异研究. 海洋与湖沼, 44 (1) : 249–254 |
| 肖武汉, 张亚平, 2000. 鱼类线粒体DNA的遗传与进化. 水生生物学报, 24 (4) : 384–391 |
| 肖明松, 崔峰, 康健, 等, 2013. 长吻鮠养殖群体与野生群体遗传多样性分析. 水生生物学报, 37 (1) : 90–99 |
| 沈浩, 刘登义, 2001. 遗传多样性概述. 生物学杂志, 18 (3) : 5–7, 4 |
| 陈竹, 钟山, 罗大极, 等, 2011. 基于线粒体D-loop区比较分析野生与养殖斜带髭鲷种群的遗传多样性. 水生生物学报, 35 (5) : 761–767 |
| 林小涛, 张洁, 2013. 东江鱼类生态及原色图谱. 北京: 中国环境出版社, 109-120 |
| 罗钦洪, 林义浩, 钟良明, 等, 1999. 光倒刺鲃的人工繁殖技术研究. 福建水产, (4) : 48–52 |
| 周慧, 李迪强, 张于光, 等, 2006. 藏羚羊mtDNA D-loop区遗传多样性研究. 遗传, 28 (3) : 299–305 |
| 胡静, 侯新远, 尹绍武, 等, 2014. 基于mtDNA COⅠ和Cyt b基因序列对南中国海不同海域波纹唇鱼群体遗传多样性的研究. 水生生物学报, 38 (6) : 1008–1016 |
| 郭新红, 刘少军, 刘巧, 等, 2004. 鱼类线粒体DNA研究新进展. 遗传学报, 31 (9) : 983–1000 |
| 唐琼英, 杨秀平, 刘焕章, 2003. 刺鲃基于线粒体细胞色素b基因的生物地理学过程. 水生生物学报, 27 (4) : 352–356 |
| 黄种持, 黄柳婷, 林学文, 等, 2008. 黑脊倒刺鲃线粒体DNA多样性分析. 中国海洋大学学报, 38 (2) : 259–262 |
| 梁晓旭, 庆宁, 杨柯林, 等, 2010. 广东地区宽鳍鱲种群遗传变异和亲缘地理. 水生生物学报, 34 (4) : 806–814 |
| 韩承慧, 马海涛, 姜海滨, 等, 2016. 许氏平鲉(Sebastes schlegeli)微卫星标记开发及野生、养殖群体遗传多样性分析. 海洋与湖沼, 47 (1) : 213–220 |
| 蓝昭军, 黄小林, 赵俊, 2015. 珠江水系鱼类一新纪录--带刺光唇鱼(鲤形目:鲤科). 动物学杂志, 50 (3) : 390–395 |
| 褚新洛, 郑葆珊, 戴定远, 等, 1999. 中国动物志硬骨鱼纲鲇形目. 北京: 科学出版社, 51-68 |
| Excoffier L, Smouse P E, Quattro J M, 1992. Analysis of molecular variance inferred from metric distances among DNA haplotypes:application to human mitochondrial DNA restriction data. Genetics, 131 (2) : 479–491 |
| Kumar S, Nei M, Dudley J, et al, 2008. MEGA:a biologist-centric software for evolutionary analysis of DNA and protein sequences. Briefings in Bioinformatics, 9 (4) : 299–306 DOI:10.1093/bib/bbn017 |
| Li G Y, Wang X Z, Zhao Y H, et al, 2009. Speciation and phylogeography of Opsariichthys bidens (Pisces:Cypriniformes:Cyprinidae) in China:analysis of the cytochrome b gene of mtDNA from diverse populations. Zoological Studies, 48 (4) : 569–583 |
| Librado P, Rozas J, 2009. DNASP v5:a software for comprehensive analysis of DNA polymorphism data. Bioinformatics, 25 (11) : 1451–1452 DOI:10.1093/bioinformatics/btp187 |
| Liu Z F, Trentesaux A, Clemens S C, et al, 2003. Clay mineral assemblages in the northern South China Sea:implications for East Asian monsoon evolution over the past 2 million years. Marine Geology, 201 (1-3) : 133–146 DOI:10.1016/S0025-3227(03)00213-5 |
| Liu Z J, Cordes J F, 2004. DNA marker technologies and their applications in aquaculture genetics. Aquaculture, 238 (1-4) : 1–37 DOI:10.1016/j.aquaculture.2004.05.027 |
| Mayer A, Wilson A C, 1990. Origin of tetrapods inferred from their mitochondrial DNA affiliation to lungfish. Journal of Molecular Evolution, 31 (5) : 359–364 DOI:10.1007/BF02106050 |
| Wang L, Sarnthein M, Erlenkeuser H, et al, 1999. East Asian monsoon climate during the Late Pleistocene:high-resolution sediment records from the South China Sea. Marine Geology, 156 (1-4) : 245–284 DOI:10.1016/S0025-3227(98)00182-0 |
| Yang L, He S P, 2008. Phylogeography of the freshwater catfish Hemibagrus guttatus (Siluriformes, Bagridae):implications for South China biogeography and influence of sea-level changes. Molecular Phylogenetics and Evolution, 49 (1) : 393–398 DOI:10.1016/j.ympev.2008.05.032 |
| Yang L, Mayden R L, He S P, 2009. Population genetic structure and geographical differentiation of the Chinese catfish Hemibagrus macropterus (Siluriformes, Bagridae):evidence for altered drainage patterns. Molecular Phylogenetics and Evolution, 51 (2) : 405–411 DOI:10.1016/j.ympev.2009.01.004 |
 2016, Vol. 47
2016, Vol. 47