中国海洋湖沼学会主办。
文章信息
- 郁迪, 丁冬各, 王斌. 2016.
- YU Di, DING Dong-Ge, WANG Bin. 2016.
- 绿鳍马面鲀(Navodon septentrionalis)鱼皮胶原蛋白的分离纯化及理化性质研究
- ISOLATION AND CHARACTERIZATION OF COLLAGENS FROM SKIN OF BLUEFIN LEATHERJACKET (NAVODON SEPTENTRIONALIS)
- 海洋与湖沼, 47(5): 1055-1062
- Oceanologia et Limnologia Sinica, 47(5): 1055-1062.
- http://dx.doi.org/10.11693/hyhz20160600129
-
文章历史
- 收稿日期:2016-06-20
- 收修改稿日期:2016-07-07
胶原蛋白广泛分布于皮肤、骨骼、肌腱、血管系统和结缔组织中, 约占动物体内总蛋白的30%(Chen et al, 2016)。目前, 已发现的胶原蛋白种类有29种(类型I—XXIX), 且每种胶原蛋白都具有独特的结构和生理功能(Matmaroh et al, 2011)。传统上, 胶原蛋白主要来自于陆地动物如牛、猪和家禽的加工副产物(Yang et al, 2016), 被广泛应用于生物医学材料、药品、食物添加剂和化妆品等领域(Li et al, 2013a; Liu et al, 2015)。然而, 疯牛病(BSE)和口蹄疫(FMD)等病毒性疾病的发生致使人们对陆源胶原蛋白的安全性产生疑虑(张雪等, 2015; Chuaychan et al, 2015)。此外, 宗教等原因也限制了胶原蛋白的应用范围(Veeruraj et al, 2015)。因此, 寻找陆源胶原蛋白的替代资源成为研究热点。
据联合国粮食及农业组织(FAO)报道, 全球每年鱼捕获量约有1.5亿吨, 加工过程中产生占捕获量30%以上的加工下脚料, 多数未得到有效利用, 既浪费了宝贵的资源, 也给环境造成了较大压力(Yu et al, 2014; Wu et al, 2015)。现有研究表明, 水产加工下脚料, 特别是鱼皮、鱼骨、鱼鳞和鱼头中富含胶原蛋白(Subhan et al, 2015), 且已从鱿鱼皮(张雪等, 2015)、金枪鱼鱼骨(Yu et al, 2014)、海参体壁(Cui et al, 2007)、大黄鱼和小黄鱼鱼鳞(Wu et al, 2015)、鳕鱼鱼骨(Żelechowska et al, 2010)和罗非鱼鱼皮(Zeng et al, 2009)中制备得到胶原蛋白, 并对其性质进行了系统研究, 为水产胶原蛋白的开发利用奠定了基础。另外, 现有研究证明源于海洋生物的胶原蛋白具有低抗原性、低过敏性等特性, 较陆源胶原蛋白具有更广泛的用途(Li et al, 2013b)。因此, 以水产加工下脚料进行胶原蛋白的开发利用既能保护环境, 又可以增加水产加工附加值。
绿鳍马面鲀(Navodon septentrionalis)属于单角鲀科, 俗名剥皮鱼、皮匠鱼、橡皮鱼等, 在我国主要产于东海及黄海、渤海, 是我国重要的海产经济鱼类之一。我国马面鲀的年加工数量约为20万吨, 产生10万吨左右的副产物, 而其皮肤强韧, 利用价值较低, 常作为废料丢弃。基于此, 本论文以绿鳍马面鲀鱼皮为原料, 从中制备酸溶性胶原蛋白(ASC)和酶溶性胶原蛋白(PSC), 并对其性质进行了系统研究, 为马面鲀加工下脚料的后续开发利用奠定实验基础。
1 材料与方法 1.1 材料绿鳍马面鲀(Navodon septentrionalis)购于浙江省舟山市丰茂菜市场, 种属由浙江海洋大学海洋科学与技术学院赵盛龙教授鉴定, 标本于-20°C存放于浙江海洋大学食品与医药学院药学实验室。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)试剂为Bio-Rad产品, 牛胰蛋白酶(Trypsin, 1:250)、猪胃蛋白酶(Pepsin, 160000U/g)和牛皮胶原蛋白标准品(CSC)为Sigma产品。其它试剂均为国产分析纯, 购买于上海国药集团化学试剂有限公司。
1.2 实验方法 1.2.1 ASC和PSC的提取手工剥取绿鳍马面鲀鱼皮, 用冷蒸馏水洗净, 然后用剪刀切成小块后组织捣碎机破碎, 按照料液比1:15(W/V)加入0.1mol/L NaOH溶液于4℃下搅拌浸泡24h(每6h换液一次), 9000g离心20min, 沉淀物用冷水洗至中性; 充分沥干后, 按料液比1:20(V/V)加入15%正丁醇溶液搅拌浸泡48h(每12h更换一次)除去残留的脂肪, 脱脂鱼皮用蒸馏水洗净。
脱脂鱼皮按料液比1:15(W/V)浸泡于0.5mol/L的乙酸中24h, 混合物以9000g离心20min, 上清液装入截留分子量为3500Da的透析袋, 于NaCl浓度为2.6mol/L的Tris-HCl缓冲液(0.05mol/L, pH7.5)中透析24h, 于20000g离心15min, 沉淀物用乙酸溶液(0.5mol/L)复溶后依次用乙酸溶液(0.1mol/L)和蒸馏水透析24h和36h, 最后透析液冻干得酸溶性胶原蛋白(ASC)。
将ASC提取后的残渣按照料液比1︰15 (W/V)置于0.5mol/L乙酸溶液, 加入3%猪胃蛋白酶后在4°C下搅拌提取48h, 于20000g离心30min后得上清液, 将上清液装入截留分子量为3500Da的透析袋, 于NaCl浓度为2.6mol/L的Tris-HCl缓冲液(0.05mol/L, pH 7.5)中透析24h, 于20000g离心15min得沉淀物, 沉淀物用0.5mol/L的乙酸溶液复溶后依次用0.1mol/L的乙酸和蒸馏水透析24h和36h, 透析液冷冻干燥得酶溶性胶原蛋白(PSC)。
ASC和PSC的得率按照下面公式计算:
得率(%)=冷冻干燥胶原蛋白重量(g)/鱼皮干重(g)×100
1.2.2 基本成分和氨基酸组成分析水分、灰分、脂肪和蛋白质的测定分别按照AOAC(2003)中的950.46B、920.153、960.39(a)和928.08方法进行分析。氨基酸组成分析参考赵等(2015)方法进行。
1.2.3 SDS-PAGEASC和PSC的电泳根据Chi等(2014)的方法略作修改。分离胶浓度为7.5%, 浓缩胶浓度为4%。样品(6.0mg/mL, 20μL)与上样缓冲液(60mmol/L Tris-HCl, pH 8.0, 包含25%甘油, 2% SDS, 0.1%溴酚蓝)按4︰1(V/V)置于β-巯基乙醇中, 然后将样品、CSC和蛋白标准品分别加入样品槽中, 以100V恒定电压电泳大约4h后, 用考马司亮蓝R-250染色液(考马斯亮蓝0.5g, 甲醇225mL, 蒸馏水225mL, 冰醋酸50mL)染色15min, 脱色液(甲醇100mL, 冰醋酸100mL, 蒸馏水800mL)脱色并拍照分析。
1.2.4 ASC和PSC的肽谱胶原蛋白样品溶解于0.5mol/L乙酸中配成浓度为3.5mg/mL的溶液, 按照酶/胶原蛋白1:20(W/W)比例加入胰蛋白酶于37℃下酶解3h, 加入SDS-PAGE样品缓冲液于沸水中保温5min终止酶解反应。其它胶原蛋白样品的酶解时间调整为3min。然后所有样品用12.0%的分离胶电泳。
1.2.5 傅里叶变换红外光谱(FTIR)称取充分干燥后的胶原蛋白样品1—2mg按照质量比1︰100与干燥KBr充分混合, 手动压片, 采用傅里叶变换红外光谱仪对样品在450—4000cm–1区间内进行吸收波谱扫描。
1.2.6 黏度测定黏度的测定按照赵玉勤等(2015)方法进行。ASC和PSC水溶液(0.6%)的温度按4°C /min的速度从4°C上升到40°C。相对黏度为测定时的黏度与4°C黏度的比值。Td定义为相对黏度降低50%时的温度。黏度分数按照下列公式计算:
黏度分数=(最大黏度–测量黏度)/(最大黏度–最小黏度)
1.2.7 溶解度测定 1.2.7.1 pH值对溶解度的影响取ASC和PSC溶液(3mg/mL, 8mL)分别加入到50mL离心管中, 用6mol/L的NaOH/HCl溶液调节溶液pH值从1—11。用相同pH的NaOH/HCl溶液将体积补足至10mL, 4°C下轻轻搅拌30min后, 于4°C、15000g离心60min。离心得到的上清液, 测定其蛋白质的含量。相对溶解度按照下列公式计算:
相对溶解度=当前pH值下蛋白浓度/最大溶解度的pH值下的蛋白浓度
1.2.7.2 氯化钠浓度对溶解度的影响分别向ASC和PSC溶液(6mol/L, 5mL)中加入5mL的0.5mol/L的乙酸溶液, 按质量体积比向溶液中加入NaCl, 使NaCl最终浓度分别达到0%, 1%, 2%, 3%, 4%, 5%和6%。将调好浓度的溶液于4°C下轻轻搅拌30min, 于4°C、15000g离心60min, 测定上清液的蛋白质含量。相对溶解度按照下列公式计算:
相对溶解度=当前NaCl浓度下蛋白浓度/最大溶解度的NaCl浓度下的蛋白浓度
1.2.8 超微结构观察ASC和PSC溶解于0.5mol/L乙酸中配制成浓度为5%(W/V)溶液, 用25倍体积的蒸馏水透析24h后冻干, 用JEOL JFC-1200精细镀膜仪镀金90s, 电子显微镜下观察超微结构。
2 结果与讨论 2.1 ASC和PSC的得率绿鳍马面鲀鱼皮中酸溶性胶原蛋白(ASC)和酶溶性胶原蛋白(PSC)的得率分别为0.87%±0.15%和9.52%±0.41%(按鱼皮干重计算)。酸法提取是采用低离子浓度酸性条件破坏分子间盐键和希夫碱, 引起胶原纤维膨胀、溶解, 可将没有交联的胶原分子或者含有醛胺类交联键的胶原纤维释放到溶剂中。但是, 由于部分胶原在体内通过末端肽里的赖氨酸(Lys)或羟赖氨酸形成的共价键交联结合, 难于溶解到酸性溶液中。而蛋白酶可以将胶原末端肽切除, 导致三螺旋结构的主体部分溶于稀有机酸而被提取出来, 提高胶原蛋白的产率。因此, 蛋白酶(如胃蛋白酶、胶原酶和木瓜蛋白酶等)可以作为胶原蛋白提取的辅助工具显著提高胶原蛋白的得率(Liu et al, 2012; Mohammadi et al, 2016)。
2.2 基本成分分析绿鳍马面鲀鱼皮、ASC和PSC的基本成分组成如表 1所示。鱼皮的水分、粗蛋白、粗脂肪、灰分含量分别为62.12%±2.93%、19.83%±0.76%、3.08%±0.11%和14.32%±0.24%。与鱼皮原料相比, 胶原蛋白提取过程中已经除去绝大部分杂质, ASC和PSC的蛋白质含量分别为97.93%±0.54%和97.97%±0.38%, 而脂质(ASC: 0.47%±0.12%, PSC: 0.51%±0.09%), 灰分(ASC: 1.29%±0.11%, PSC: 1.42%±0.37%)和水分含量(ASC: 0.18%±0.04%, PSC: 0.16%±0.01%)则显著降低。
| 成分 | 鱼皮(%) | ASC(%) | PSC(%) |
| 水分 | 62.12±2.93 | 0.18±0.04 | 0.16±0.01 |
| 灰分 | 14.32±0.24 | 1.29±0.11 | 1.42±0.37 |
| 脂肪 | 3.08±0.11 | 0.47±0.12 | 0.51±0.09 |
| 蛋白质 | 19.83±0.76 | 97.93±0.54 | 97.97±0.38 |
绿鳍马面鲀鱼皮中ASC和PSC的氨基酸组成如表 2所示。结果表明: ASC和PSC具有类似的氨基酸组成, 含量最高的是氨基酸为Gly, 含量分别为323.3残基/1000残基和321.7残基/1000残基; 其次是Ala、Pro和Hyp。根据文献报道(Chi et al, 2013; Li et al, 2013a, b), 除了N-端的14个氨基酸残基和C-端10个氨基酸残基外, 胶原蛋白都是由重复的Gly三肽(Gly-X-Y)参与的三重螺旋形成, 其中X一般是Pro, Y主要是Hyp。另外, 绿鳍马面鲀鱼皮中ASC和PSC的Gly含量明显低于刺河豚鱼皮中得到的ASC(353残基/1000残基)和PSC(340残基/1000残基)(Huang et al, 2011), 而略高于从条纹鲶鱼鱼皮中得到的ASC(309残基/1000残基)和PSC(317残基/1000残基) (Singh et al, 2011)。
| 氨基酸 | ASC | PSC | CSC |
| Hyp | 75.4 | 72.6 | 94 |
| Asp | 47.5 | 46.3 | 45 |
| Thr | 19.8 | 21.9 | 18 |
| Ser | 33.7 | 34.6 | 33 |
| Glu | 70.9 | 67.8 | 75 |
| Pro | 115.7 | 110.8 | 121 |
| Gly | 323.3 | 321.7 | 330 |
| Ala | 129.1 | 131.4 | 119 |
| Cys | 2.5 | 2.8 | 0 |
| Val | 27.6 | 23.7 | 21 |
| Met | 11.5 | 12.4 | 6 |
| Ile | 13.9 | 13.8 | 11 |
| Leu | 24.2 | 24.9 | 23 |
| Tyr | 3.7 | 3.8 | 3 |
| Phe | 15.8 | 16.9 | 3 |
| Hyl | 5.4 | 5.6 | 7 |
| Lys | 22.5 | 26.7 | 26 |
| His | 5.9 | 7.1 | 5 |
| Arg | 51.6 | 55.2 | 50 |
| Total | 1000 | 1000 | 1000 |
| Imino acid | 191.1 | 183.4 | 215 |
此外, Chi等(2013)报道亚氨基酸(Pro和Hyp)对胶原蛋白结构的完整性至关重要, 吡咯烷环的Pro和Hyp限制多肽链的构象, 并可在它们富集区域形成氢键, 从而稳定胶原蛋白的结构。因此, 亚氨基酸的含量有利于提高胶原蛋白螺旋结构的热稳定性。绿鳍马面鲀鱼皮ASC和PSC的亚氨基酸含量分别为191.1残基/1000残基和183.4残基/1000残基, 低于CSC(215残基/1000残基), 说明绿鳍马面鲀鱼皮ASC和PSC的螺旋结构的稳定性弱于哺乳动物胶原蛋白。
2.4 SDS-PAGE和肽谱现有研究证明:除了氨基酸组成外, 分子量分布、亚基种类和比例也对胶原蛋白结构产生较大影响。如图 1所示, 使用7.5%分离胶对ASC、PSC和CSC进行SDS-PAGE分析。结果表明绿鳍马面鲀鱼皮中的ASC含有两种α肽链(α1和α2), 其中, α1肽链的分子量约为130kDa, 含量较高, α2肽链的分子量约为110kDa, 含量较低; 除α肽链外, ASC和PSC尚含有大量β肽链(α肽链二聚体), 其分子质量约为200kDa。另外, 在β肽链上方还存在一条高分量的条带, 为γ肽链(α肽链三聚体), 相对分子质量约为300kDa。SDS-PAGE结果表明ASC电泳图谱与CSC(图 1)、大黄鱼鱼鳞ASC(Wu et al, 2015)、金枪鱼鱼骨ASC(Yu et al, 2014)、灰星鲨鱼皮ASC(Chi et al, 2014), 以及马鲛鱼鱼皮和鱼骨ASC(Li et al, 2013a, b)类似, 属于Ⅰ型胶原蛋白。然而, PSC的SDS-PAGE图谱和ASC和CSC明显不同。胰蛋白酶处理后, 高分子量的亚基成分, 包括α、β和γ-肽链裂解成70-110kDa的低分子量片段。
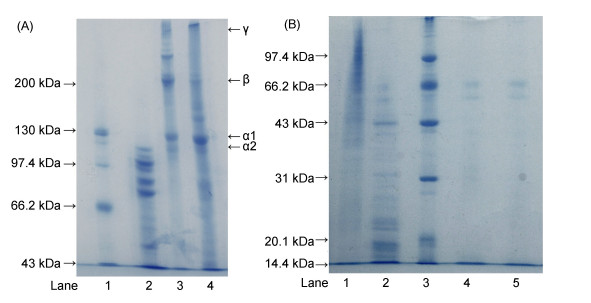 |
| 图 1 马面鲀鱼皮ASC和PSC的SDS-PAGE图谱(A)和肽谱(B) Fig. 1 SDS-PAGE pattern (A) and peptide mapping (B) of ASC and PSC from skin of bluefin leatherjacket 注: A. 1:高分子量蛋白标准品; 2: PSC; 3: ASC; 4: CSC; B. 1:胰蛋白酶在pH 2.5降解的ASC片段; 2:胰蛋白酶在pH 2.5降解的PSC片段; 3:蛋白标准品; 4:胰蛋白酶在pH 7.8降解的ASC片段; 5:胰蛋白酶在pH 7.8降解的PSC片段 |
在pH值为2.5和7.8条件下, 利用胰蛋白酶分别对ASC和PSC进行酶解, 使用12%分离胶对酶解物进行电泳分析, 结果如图 1B所示:经胰蛋白酶在pH为2.5、37 ℃处理3 h后, ASC的β和γ等高分子量肽链几乎完全消失, 而低于130.0kDa的片段显著增多; PSC未酶解时主要组成片段集中在66—100kDa之间, 而胰蛋白酶酶解后, 大于66kDa的片段基本消失, 低于66.0kDa的片段显著增多。另外, 随着pH值从2.5调整到胰蛋白酶最佳pH 7.8, ASC和PSC的水解程度都显著增加。
ASC和PSC的SDS-PAGE图谱和肽谱说明: ASC和PSC的蛋白质一级结构、亚基、水解产物和氨基酸序列存在较大差别, ASC组成亚基分子量更大, 更难酶解。
2.5 FTIR绿鳍马面鲀鱼皮ASC和PSC的FTIR如图 2所示。结果表明: ASC和PSC的FTIR具有显著的胶原蛋白特征, 且类似于大黄鱼鱼鳞(Wu et al, 2015)、金枪鱼鱼骨(Yu et al, 2014)、灰星鲨鱼皮(Chi et al, 2014), 以及马鲛鱼鱼皮和鱼骨(Li et al, 2013a, b)等鱼类来源的胶原蛋白。
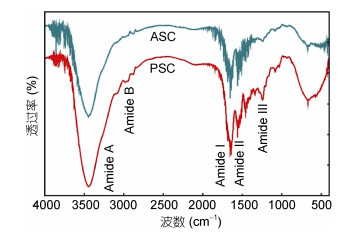 |
| 图 2 马面鲀鱼皮ASC和PSC的红外光谱(FTIR) Fig. 2 FTIR spectra of ASC and PSC from skin of bluefin leatherjacket |
酰胺A带与N-H伸缩频率有关, 3400cm–1附近是N-H伸缩振动峰, 当肽的N-H基团中包含氢键时, 振动转向低频率。ASC和PSC的酰胺A带都在3432cm–1, 表明ASC和PSC的N-H基团中氢键含量较少。ASC和PSC的酰胺B带的波数分别为2925cm–1和2926cm–1, 代表了C-H伸缩振动峰。酰胺I带、酰胺Ⅱ带和酰胺Ⅲ带的伸缩振动与胶原蛋白的成分有直接关系(Heu et al, 2010)。酰胺I带在1600-1700cm–1范围有很强的吸光度, 这主要与多肽链的C=O的伸缩振动相关, 能作为多肽二级结构的标记。ASC和PSC酰胺I带的波数分别为1640cm–1和1642cm–1。由于C-N的伸缩振动与N-H的弯曲振动相耦合, 酰胺Ⅱ带通常出现在1550—1600cm–1, 当有氢键存在时转向低波数, ASC和PSC的酰胺Ⅱ带波数为1548cm–1和1549cm–1, 该数据进一步证实绿鳍马面鲀鱼皮ASC和PSC中存在少量氢键。此外, 酰胺Ⅲ带(1220—1320cm–1)与N-H变形和C-N伸缩频率有关。ASC和PSC的酰胺Ⅲ带波数为1240cm–1, 其峰面积与1452cm–1峰面积之比约等于1证明ASC和PSC存在3股螺旋结构(Heu et al, 2010; Li et al, 2013a, b)。
2.6 ASC和PSC溶液的黏度随着温度的升高, 胶原蛋白的分子内氢键会逐渐断裂, 由氢键维系的胶原蛋白三螺旋结构转化为无规则卷曲状态, 并伴随着物理性质, 如黏度、溶解度、沉降、扩散、光散射和光学活动等的变化(Chi et al, 2014)。如图 3所示, ASC和PSC从4℃(ASC: 7453.33±27.92mPa·s, PSC: 7332.30±4318.13mPa·s)加热至32℃(ASC: 361.27±11.95mPa·s, PSC: 233.67±9.28mPa·s), 黏度快速下降, 在32℃以上黏度的变化很小。
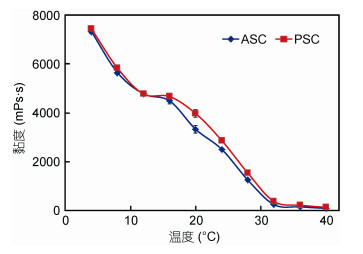 |
| 图 3 温度对马面鲀鱼皮ASC和PSC黏度的影响(n=3) Fig. 3 Thermal behaviours of ASC and PSC from skin of bluefin leatherjacket (n=3) |
变性温度(Td)为相对黏度降低50%时的温度。ASC和PSC的Td分别为21.5℃和18.9℃。PSC的Td值略低于ASC, 该结果表明胃蛋白酶的酶解破坏了胶原蛋白分子的部分氢键, 造成胶原蛋白分子量降低, 稳定性减弱。绿鳍马面鲀生活在温度为13—20℃的海洋, 其鱼皮胶原蛋白的变性温度比阿根廷鳕鱼(10.0℃)、波罗海鳕鱼(15.0℃)和阿拉斯加狭鳕(16.8℃)等冷水鱼高, 并低于热带鱼类, 如常见的鲭鱼(26.1℃)、鳗鱼(29.3℃)、七星鲈鱼(26.5℃)、鲣鱼(29.7℃)、香鱼(29.7℃)、澳洲乌鲂(28.4℃)和尼罗河鲈鱼(36.5℃)(Li et al, 2013a, b; Sionkowska et al, 2015)。该结果与Zeng等(2009)报告相一致, 即:环境和机体温度与胶原蛋白的热稳定性有关。此外, Td结果进一步证实亚氨基酸含量较低会影响胶原蛋白的热稳定性。
另一方面, 绿鳍马面鲀鱼皮的ASC和PSC的变性温度低于牛皮和猪皮胶原蛋白的变性温度(37℃) (Huang et al, 2011), 该数据表明绿鳍马面鲀鱼皮中的胶原蛋白的稳定性弱于哺乳动物胶原蛋白, 更适合作为胶原肽的制备原料。
2.7 溶解度 2.7.1 NaCl浓度对胶原蛋白溶解度的影响图 4(A)表明当NaCl浓度从0上升至6%(W/V)时, 绿鳍马面鲀鱼皮ASC和PSC的溶解度变化曲线略有不同。当NaCl浓度到达2%(W/V)时, ASC的溶解度高(90%以上), 当NaCl浓度为2%—4%(W/V)时溶解度大幅下降, 之后当NaCl浓度为4%—6%(W/V)时降幅减小。当NaCl浓度为6%(W/V)时溶解度仅为20.0%±1.2%。该结果与NaCl浓度对金枪鱼鱼骨、赤魟软骨、孔鳐软骨、灰星鲨鱼皮和软骨、条纹鲶鱼鱼皮胶原蛋白溶解度的影响类似(Chi et al, 2013; Li et al, 2013a, b; Matmaroh et al, 2011; Singh et al, 2011)。胶原蛋白在水溶液中的溶解度由其周围亲水基团与水形成水化膜的程度, 以及所带电荷的情况决定。随着NaCl浓度的增加, NaCl对水分子的亲和力大于胶原蛋白, 于是胶原蛋白分子周围的水化膜层减弱乃至消失。同时, NaCl加入溶液后, 离子强度发生改变, 蛋白质表面电荷大量被中和, 进而导致胶原蛋白溶解度降低, 使胶原蛋白分子之间聚集而沉淀。
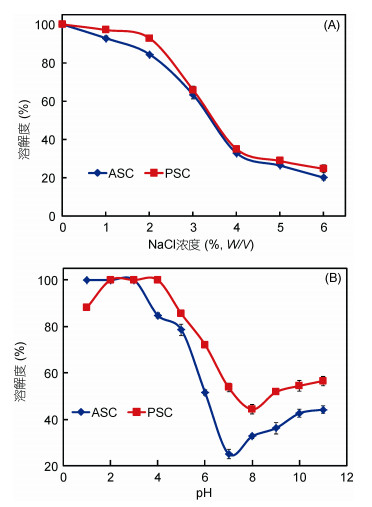 |
| 图 4 NaCl浓度(A)和pH(B)对马面鲀鱼皮ASC和PSC溶解度的影响(n=3) Fig. 4 Solubility of ASC and PSC from skin of bluefin leatherjacket at different pH (A) and NaCl concentrations (B) (n=3) |
与ASC溶解度图相比, 当NaCl浓度到达2%(W/V)时PSC的溶解度显著下降, 但在相同的NaCl浓度下PSC比ASC表现出更大的溶解度, 主要因为经胃蛋白酶酶解后, PSC的分子量显著低于ASC, 亲水性更强, 从而溶解度更大。
2.7.2 pH值对胶原蛋白溶解度的影响pH值对ASC和PSC溶解度的影响如图 4(B)所示。ASC和PSC的溶解度在酸性pH值介于1—3时最大, 当pH上升至3—7时溶解度显著降低, 当pH为7—8时ASC和PSC的溶解度达到最小值, 分别为25.2%±1.9%和44.4%±2.0%。文献报道, 当pH值低于或高于蛋白等电点(pI), 蛋白质分子的负电荷或正电荷会随之增加, 相互之间的排斥力变大, 溶解度升高; 相反, 等电点时蛋白质之间排斥力最小, 则沉淀析出。所以, ASC和PSC的等电点分别为pH值7和8, 与已有报道胶原蛋白的等电点在6—9之间相一致(Huang et al, 2011; Chi et al, 2013; 赵玉勤等, 2015)。
2.8 超微结构图 5结果表明:冻干的绿鳍马面鲀鱼皮ASC呈现片状结果, 而相同处理下的PSC呈现疏松片状和多孔结构。ASC与PSC超微结构的差异主要由其分子量差异导致溶解度的不同, 进而在溶液中PSC分步更加均匀。但是ASC和PSC均显示出良好的成膜性能, 可以作为药物载体进行开发。同时本研究结果说明分子量和溶解度对胶原蛋白的超微结构均有一定影响, 后续研究可以根据需求调整胶原蛋白的分子量和溶解度来制备所需的生物材料(Mohammadi et al, 2016)。
 |
| 图 5 马面鲀鱼皮ASC(A)和PSC(B)的超微结构图 Fig. 5 SEM images of ASC (A) and PSC (B) from skin of bluefin leatherjacket |
本实验利用酸提法和酶提法从绿鳍马面鲀鱼皮中制备了两种胶原蛋白, 成分分析和SDS-PAGE电泳结果表明, 提取的酸溶性胶原蛋白(ASC)和酶溶性胶原蛋白(PSC)具有较高的纯度; 氨基酸组成分析、SDS-PAGE和FTIR证实ASC属于Ⅰ型胶原蛋白, 但是PSC在亚基组成和分子量等方面与ASC存在一定差异; ASC和PSC的变性温度低于热带鱼类和哺乳动物来源的胶原蛋白, 适合作为胶原肽的制备原料进行开发利用; 超微结构揭示可以根据需求调整马面鲀鱼皮胶原蛋白的分子量和溶解度, 进行生物材料开发。因此, 本研究为绿鳍马面鲀鱼皮的高值化利用提供了一种新的思路, 也为马面鲀鱼皮胶原蛋白应用于食品和生物医药行业提供理论依据。
| 张雪, 令狐青青, 童晓倩, 等, 2015. 响应面法优化鱿鱼(Ommastrephes bartrami)皮胶原蛋白提取液脱色工艺. 海洋与湖沼, 46 (1) : 221–227 |
| 赵玉勤, 王玉梅, 王斌, 等, 2015. 绿鳍马面鲀(Navodon septentrionalis)鱼头酸溶性与酶溶性胶原蛋白的分离纯化及理化性质研究. 海洋与湖沼, 46 (3) : 703–709 |
| Chen S J, Chen H, Xie Q N, et al, 2016. Rapid isolation of high purity pepsin-soluble type I collagen from scales of red drum fish (Sciaenops ocellatus). Food Hydrocolloid, 52 : 468–477 DOI:10.1016/j.foodhyd.2015.07.027 |
| Chi C F, Wang B, Li Z R, et al, 2013. Characterization of acid-soluble collagens from the cartilages of scalloped hammerhead (Sphyrna lewini), red stingray (Dasyatis akajei), and skate (Raja porosa). Food Sci Biotechnol, 22 (4) : 909–916 DOI:10.1007/s10068-013-0163-0 |
| Chi C F, Wang B, Li Z R, et al, 2014. Characterization of acid-soluble collagen from the skin of hammerhead shark(Sphyrna lewini). J Food Biochem, 38 (2) : 236–247 DOI:10.1111/jfbc.2014.38.issue-2 |
| Chuaychan S, Benjakul S, Kishimura H, et al, 2015. Characteristics of acid-and pepsin-soluble collagens from scale of seabass (Lates calcarifer). LWT-Food Sci Technol, 63 (1) : 71–76 DOI:10.1016/j.lwt.2015.03.002 |
| Cui F X, Xue C H, Li Z J, et al, 2007. Characterization and subunit composition of collagen from the body wall of sea cucumber Stichopus japonicus. Food Chem, 100 (3) : 1120–1125 DOI:10.1016/j.foodchem.2005.11.019 |
| Heu M S, Lee J H, Kim H J, et al, 2010. Characterization of acidand pepsin-soluble collagens from flatfish skin. Food Sci Biotechnol, 19 (1) : 27–33 DOI:10.1007/s10068-010-0004-3 |
| Huang Y R, Shiau C Y, Chen H H, et al, 2011. Isolation and characterization of acid and pepsin-solubilized collagens from the skin of balloon fish (Diodon holocanthus). Food Hydrocolloid, 25 (6) : 1507–1513 DOI:10.1016/j.foodhyd.2011.02.011 |
| Li Z R, Wang B, Chi C F, et al, 2013a. Isolation and characterization of acid soluble collagens and pepsin soluble collagens from the skin and bone of Spanish mackerel(Scomberomorous niphonius). Food Hydrocolloid, 31 (1) : 103–113 DOI:10.1016/j.foodhyd.2012.10.001 |
| Li Z R, Wang B, Chi C F, et al, 2013b. Influence of average molecular weight on antioxidant and functional properties of cartilage collagen hydrolysates from Sphyrna lewini, Dasyatis akjei and Raja porosa. Food Res Int, 51 (1) : 283–293 DOI:10.1016/j.foodres.2012.12.031 |
| Liu D S, Liang L, Regenstein J M, et al, 2012. Extraction and characterisation of pepsin-solubilised collagen from fins, scales, skins, bones and swim bladders of bighead carp(Hypophthalmichthys nobilis). Food Chem, 133 (4) : 1441–1448 DOI:10.1016/j.foodchem.2012.02.032 |
| Liu D S, Zhang X, Li T C, et al, 2015. Extraction and characterization of acid-and pepsin-soluble collagens from the scales, skins and swim-bladders of grass carp(Ctenopharyngodon idella). Food Biosci, 9 : 68–74 DOI:10.1016/j.fbio.2014.12.004 |
| Matmaroh K, Benjakul S, Prodpran T, et al, 2011. Characteristics of acid soluble collagen and pepsin soluble collagen from scale of spotted golden goatfish (Parupeneus heptacanthus). Food Chem, 129 (3) : 1179–1186 DOI:10.1016/j.foodchem.2011.05.099 |
| Mohammadi R, Mohammadifar M A, Mortazavian A M, et al, 2016. Extraction optimization of pepsin-soluble collagen from eggshell membrane by response surface methodology(RSM). Food Chem, 190 : 186–193 DOI:10.1016/j.foodchem.2015.05.073 |
| Singh P, Benjakul S, Maqsood S, et al, 2011. Isolation and characterisation of collagen extracted from the skin of striped catfish (Pangasianodon hypophthalmus). Food Chem, 124 (1) : 97–105 DOI:10.1016/j.foodchem.2010.05.111 |
| Sionkowska A, Kozłowska J, Skorupska M, et al, 2015. Isolation and characterization of collagen from the skin of Brama australis. Int J Biol Macromol, 80 : 605–609 DOI:10.1016/j.ijbiomac.2015.07.032 |
| Subhan F, Ikram M, Shehzad A, et al, 2015. Marine Collagen: An Emerging Player in Biomedical applications. J Food Sci Technol, 52 (8) : 4703–4707 DOI:10.1007/s13197-014-1652-8 |
| Veeruraj A, Arumugam M, Ajithkumar T, et al, 2015. Isolation and characterization of collagen from the outer skin of squid(Doryteuthis singhalensis). Food Hydrocolloid, 43 : 708–716 DOI:10.1016/j.foodhyd.2014.07.025 |
| Wu Q Q, Li T, Wang B, et al, 2015. Preparation and characterization of acid and pepsin-soluble collagens from scales of croceine and redlip croakers. Food Sci Biotechnol, 24 (6) : 2003–2010 DOI:10.1007/s10068-015-0264-z |
| Yang Y N, Li C Y, Song W, et al, 2016. Purification, optimization and physicochemical properties of collagen from soft-shelled turtle calipash. Int J Biol Macromol, 89 : 344–352 DOI:10.1016/j.ijbiomac.2016.04.048 |
| Yu D, Chi C F, Wang B, et al, 2014. Characterization of acid-and pepsin-soluble collagens from spines and skulls of skipjack tuna (Katsuwonus pelamis). Chin J Nat Med, 12 (9) : 712–720 |
| ŻelechowskaE, SadowskaM, TurkM, 2010. Isolation and some properties of collagen from the backbone of Baltic cod(Gadus morhua). Food Hydrocolloid, 24 (4) : 325–329 |
| Zeng S K, Zhang C H, Lin H, et al, 2009. Isolation and characterisation of acid-solubilised collagen from the skin of Nile tilapia (Oreochromis niloticus). Food Chem, 116 (4) : 879–883 DOI:10.1016/j.foodchem.2009.03.038 |
 2016, Vol. 47
2016, Vol. 47


