中国海洋湖沼学会主办。
文章信息
- 马军, 王耀嵘, 侯萍, 魏明婉, 陈燕, 李麒麟. 2016.
- MA Jun, WANG Yao-Rong, HOU Ping, WEI Ming-Wan, CHEN Yan, LI Qi-Lin. 2016.
- 一株源于红树林根际土壤产纤维素酶芽孢杆菌的鉴定及其酶学性质分析
- IDENTIFICATION AND ENZYMATIC PROPERTY OF CELLULASE-PRODUCING BACILLUS SUBTILIS ISOLATED FROM MANGROVE RHIZOSPHERE SOIL
- 海洋与湖沼, 47(5): 997-1004
- Oceanologia et Limnologia Sinica, 47(5): 997-1004.
- http://dx.doi.org/10.11693/hyhz20160400089
-
文章历史
- 收稿日期:2016-04-25
- 收修改稿日期:2016-06-28
2. 三亚航空旅游职业学院 三亚 572000
2. Sanya Aviation and Tourism College, Sanya 572000, China
随着陆源微生物资源的日益匮乏, 海洋微生物资源的开发及利用已逐渐成为微生物研究领域的新热点。红树林位于热带、亚热带陆海交汇的海岸潮间带, 是陆地生态与海洋生态的过渡生态系统, 这里的微生物资源极为特殊和多样化(龙寒等, 2005)。先前研究表明, 红树林土壤环境中微生物以细菌和真菌为主, 占微生物资源总量的91%, 而芽孢杆菌属(Bacillus)是细菌中的主要成员(Alongi, 1988; 林鹏等, 2005)。
纤维素酶在食品、纺织、饲料、酿酒、石油勘探、中药成分提取等众多领域有广泛用途, 特别是在纺织、洗涤、造纸和生物能源等工业应用上具有重要价值。研究表明, 红树林区绝大多数真菌能产生可降解木质纤维素的酶类(Pointing et al, 1999), 某些放线菌也能产生相应的酶类参与到落叶等凋落物的分解过程中(Wu, 1993), 而针对产纤维素酶细菌的研究还相对较少。近年来, 纤维素酶生产菌株的选育范围已经从真菌逐步转移到细菌, 尤其是对环境变化具有较强适应性的芽孢杆菌属。
作为饲料添加剂领域的常用菌株, 芽孢杆菌属不仅可以稳定地酶解饲料中的大分子物质, 促进动物消化吸收(王学东等, 2008), 还可作为益生菌调节肠道正常菌群平衡, 改善机体免疫功能, 提高动物的生产性能(李宝玉等, 2000; 刘德海等, 2000; 沈文英等, 2011)。本研究对从红树林根际土壤中分离出的一株产纤维素酶芽孢杆菌进行分类鉴定及纤维素酶学性质分析, 以期为该菌株在水产饲料添加剂中的进一步研究与应用提供参考依据。
1 材料与方法 1.1 实验材料 1.1.1 菌株菌株JCHL0207从三亚白鹭公园红树林保护区根际土壤中分离纯化获得(马军等, 2015), 向纯化的菌株中添加终浓度为15%的甘油后, 保存于-80℃。
1.1.2 培养基固体培养基的组分包括细菌学蛋白胨5g、酵母粉5g、葡萄糖5g、磷酸氢二钾4g、琼脂18g, 调整pH为7.4, 用去离子水定容至1000mL, 121℃下灭菌20min; 种子培养基的组分包括牛肉膏5g、细菌学蛋白胨10g、氯化钠5g, 调整pH为7.4, 用去离子水定容至1000mL, 121℃下灭菌20min; 液体培养基的组分包括羧甲基纤维素钠20g、蛋白胨5g、酵母膏5g、氯化钠5g、磷酸二氢钾1g, 调整pH为7.4, 用去离子水定容至1000mL, 121℃下灭菌20min。
1.2 实验方法 1.2.1 菌株初步鉴定观察待鉴定菌株JCHL0207所形成的菌落特征及革兰氏染色后显微镜下的菌体形态, 进行接触酶、糖/醇利用、V-P反应、淀粉水解、吲哚形成、明胶液化、硝酸盐、柠檬酸盐利用、硫化氢利用等生理生化试验, 相关试验方法参考《常见细菌系统鉴定手册》(东秀珠等, 2001)和《伯杰氏细菌鉴定手册》(布坎南等, 1984)。
1.2.2 16S rRNA基因序列分析及鉴定使用试剂盒(AXYGEN: AP-MN-BT-GDNA-50)提取细菌基因组DNA。菌株16S rRNA基因保守序列使用通用引物5′-AGAGTTTGATCCTGGCTCAG-3′(F)和5′-GGTTA CCTTGTTACGACTT-3′(R)进行PCR扩增(周煜, 1999)。将测得的菌株16S rRNA基因序列在GenBank数据库中进行BLAST分析, 获取相似的同源参考序列, 利用ClustalW 1.6进行全序列比对, 构建系统发育树采用Mega 6.0软件的Neighbor-Joining算法, 进化距离使用Kimura 2-parameter模型进行计算(Ettoumi et al, 2013), 系统发育树使用1000次重复的Bootstraps进行统计学检验。
1.2.3 粗酶液的制备将菌株活化接种于固体培养基上, 挑选单个菌落, 接种到种子培养基中, 在37℃下以200r/min转速摇床培养18h。以1%的接种量将种子液接种在液体培养基中, 在37℃下以120r/min转速摇床培养48h, 吸取菌液, 5000g离心5min, 上清液为粗酶液。
1.2.4 酶活力测定及计算纤维素酶活力测定方法参考Horikoshi法(Horikoshi et al, 1984)。吸取粗酶液1mL加入到25mL比色管中, 每管加入4mL醋酸-醋酸钠底物缓冲液(pH=6.8)。50℃水浴30min后, 每管加入2mol/L的氢氧化钠溶液1mL, 震荡终止反应, 加入2mL的DNS, 沸水浴10min, 冰浴5min, 加水稀释至20mL, 在520nm波长下测定吸光值, 以加灭活酶液的反应体系为空白管。
酶活力根据下式计算:
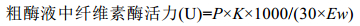
其中P为葡萄糖浓度, 可在葡萄糖标准曲线中查出; K为酶液稀释倍数; 1000为mg换算为μg; 30为酶发生反应所需要的时间, 单位为分钟; Ew为测酶活力时的酶液体积。酶活定义为:在50℃、pH6.8的条件下, 每分钟将羧甲基纤维素钠水解产生1μg葡萄糖定义为一个酶活单位(U/mL)。
1.2.5 菌株生长曲线及酶活变化曲线的绘制将产纤维素酶菌株JCHL0207以2%接种量转接至48个装有30mL液体培养基(pH=7.0)的100mL锥形瓶中, 在37℃下以180r/min转速恒温连续培养96h。从0h开始, 每隔4h取3个平行样; 48h后, 每隔6h取3个平行样; 60h后, 每隔12h取3个平行样。以接种前培养基为空白, 将发酵液充分摇匀, 取1mL菌液, 测定时确定稀释倍数, 用分光光度计测定菌液在660nm时的吸光度。同时, 每个时间点取菌液2mL, 以5000g离心5min, 取1mL上清液为粗酶液, 参考Horikoshi法(Horikoshi et al, 1984)测定纤维素酶活力, 并以时间为横坐标, 以660nm处吸光度及对应酶活力为纵坐标绘制生长曲线和酶活变化曲线。
2 结果与分析 2.1 菌株初步鉴定待测菌株在筛选培养基上30℃培养24h生长较好, 菌落乳白色, 不透明, 扁平、圆形或近圆形, 边缘不齐, 绒毛状(如图 1a所示); 显微镜下观察菌体形态为革兰氏阳性、杆状、有芽孢, 芽孢位于菌体近中的位置(如图 1b所示)。
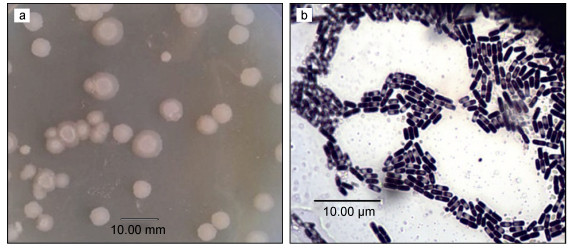 |
| 图 1 菌落形态与菌株形态观察 Fig. 1 Colony and cell morphology 注: a.菌落形态; b.菌株形态(油镜×100) |
生理生化特征结果表明, 该菌株接触酶、甲基红、VP和吲哚反应呈阳性, 能够水解明胶、纤维素、可溶性淀粉和干酪素, 能够利用葡萄糖、木糖、甘露醇、硝酸盐和柠檬酸盐, 不能利用硫化氢和丙酸盐, 与一株兔源枯草芽孢杆菌T2-shier-5(龙淼等, 2015)较为相似(如表 1所示), 参考《常见细菌系统鉴定手册》(东秀珠等, 2001)和《伯杰氏细菌鉴定手册》 (布坎南等, 1984), 结合菌株形态及菌落特征初步鉴定为芽孢杆菌属。
| 实验类型 | JCHL0207 | T2-shier-5 | 实验类型 | JCHL0207 | T2-shier-5 |
| 接触酶反应 | + | + | 甘露醇产酸 | + | + |
| 甲基红染色 | + | + | 甘露糖产气 | – | / |
| VP反应 | + | + | 硝酸盐利用 | + | + |
| 吲哚形成 | + | – | 柠檬酸盐利用 | + | + |
| 明胶水解 | + | – | 硫化氢利用 | – | – |
| 葡萄糖产酸 | + | + | 丙酸盐利用 | – | – |
| 葡萄糖产气 | – | / | 纤维素水解 | + | / |
| 木糖产酸 | + | + | 淀粉水解 | + | + |
| 木糖产气 | – | / | 干酪素水解 | + | – |
| 注: “+”表示该指标为阳性; “-”表示该指标为阴性; “/”表示该指标未检测 | |||||
枯草芽孢杆菌近缘种群是一群表型相似的革兰氏阳性、产芽孢的杆菌, 目前该种群不但包括较早命名的枯草芽孢杆菌(Bacillus subtilis)、地衣芽孢杆菌(B. licheniformis)、短小芽孢杆菌(B. pumilus)、解淀粉芽孢杆菌(B. amyloliquefaciens) (Priest et al, 1987)、深褐(萎缩)芽孢杆菌(B. atrophaeus) (Nakamura, 1989)5个种外, 还包括新命名的莫哈韦(莫杰夫)芽孢杆菌(B. mojavensis) (Roberts et al, 1994)、死谷芽孢杆菌(B. vallismortis)(Roberts et al, 1996)、索诺拉沙漠芽孢杆菌(B. sonorensis) (Palmisano et al, 2001)、特基拉芽孢杆菌(B. tequilensis) (Gatson et al, 2006)、暹罗芽孢杆菌(B. siamensis) (Sumpavapol et al, 2010), 共10个有效发表种(曹凤明等, 2014)。16S rRNA序列分析表明, 枯草芽孢杆菌近缘种群10个有效菌种与待测菌株JCHL0207(KP834902)一起形成了一个大的分支, 并且菌株JCHL0207与枯草芽孢杆菌近缘种群内索诺拉沙漠芽孢杆菌(DQ993679)的相似度为97.91%, 与深褐(萎缩)芽孢杆菌(AB021181)的相似度为98.96%, 与其它枯草芽孢杆菌近缘种群菌株相似性均在99%以上。值得注意的是, 菌株JCHL0207与枯草芽孢杆菌(AM062688)相似度最高, 达到99.79%, 这说明JCHL0207菌株与枯草芽孢杆菌种更为接近(如图 2所示)。
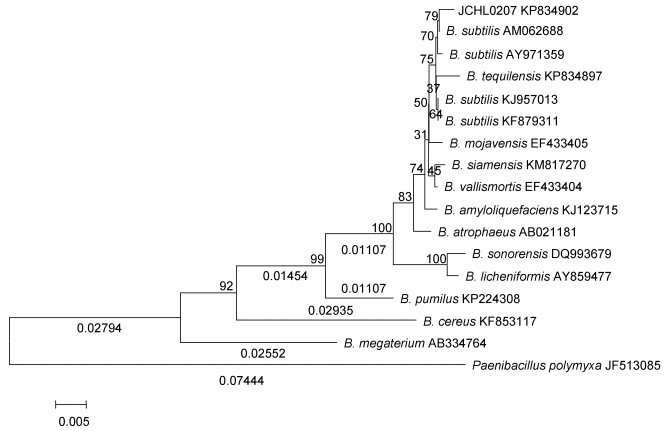 |
| 图 2 基于16S rRNA序列构建的系统发育树 Fig. 2 The phylogenetic tree of Bacillus derived from the 16s rRNA gene sequence 注:分支支持强度 < 50的未显示, 分支上的数字为自展支持率, 标尺为进化距离 |
由图 3可见, 菌株JCHL0207的生长很快, 生长延滞期较短, 很快进入对数生长期, 24h达到生长最大化, 其吸光度为(1.88±0.008), 24—32h期间菌体数量略有下降且处于生长稳定期, 从60h后菌体进入生长衰亡期。由此得出, 菌株JCHL0207的最佳种龄为24h。从酶活变化曲线可以得出, 菌株JCHL0207的纤维素酶活力从12h开始急剧上升, 24h时酶活力为(686.32±27.21)U/mL, 24—60h期间, 酶活力变化存在一定的波动, 但整体维持在700U/mL左右, 60h后纤维素酶活力上升明显, 至96h后酶活力达到(1105.1±28.723)U/mL。总体来说, 菌株JCHL0207的产酶与菌体生长呈生长偶联型关系, 菌体生长速率与酶活性变化趋势基本同步。尽管菌体进入衰亡期后, 酶活力呈明显的上升趋势, 但这可能是由于衰亡期菌体自溶释放出了部分胞内纤维素酶, 致使菌株JCHL0207的纤维素酶活力在60h后明显上升。
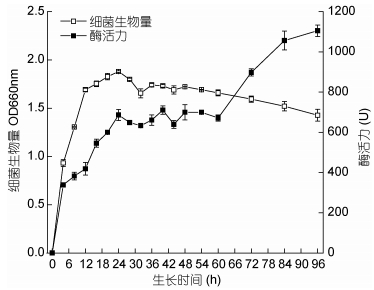 |
| 图 3 菌株JCHL0207的生长曲线及酶活变化曲线 Fig. 3 Growth and enzyme activity curve of strain JCHL0207 |
在最适合的反应温度下, 纤维素酶的反应速度将达到最大。将粗酶液混合于不同温度的底物缓冲液中, 并在相对应的温度下测定酶活性。从图 4中可以看出, 从30℃开始, 随着温度的上升, 酶活性持续增加, 在55℃时表现出最大值, 达到(1253.2±16.629)U/mL, 随着温度的不断升高, 酶活性不断下降, 这说明该酶属于中温适应性酶, 最适反应温度为55℃, 当温度超过60℃, 酶活性下降迅速, 对高温较为敏感。
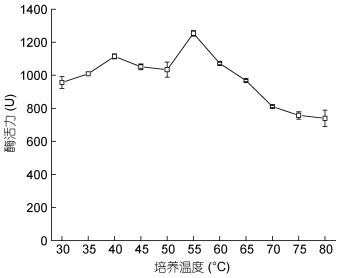 |
| 图 4 温度对酶活性的影响 Fig. 4 The effect of temperature on the enzymatic activity |
将粗酶液分别在35、45、55和65℃的水浴中保温不同的时间后测定残余酶活, 以不经保温处理的粗酶液酶活为100%计算相对酶活。从图 5可以看出, 该纤维素酶在35、45和55℃时, 随着保温时间的延长, 酶活力变化程度相对较小, 其中55℃对纤维素酶稳定性影响最小, 在保温2小时后仍有80%以上的酶活性, 而在65℃保温2小时后, 酶活力下降迅速, 残留酶活减少了50%以上, 这进一步说明该酶适用于中温环境, 但不适合在高温下的应用。
 |
| 图 5 温度对酶稳定性的影响 Fig. 5 Effect of temperature on enzyme stability |
与最适反应温度一样, 酶的最适pH也是影响酶活性的重要因素之一。将粗酶液与不同pH的底物缓冲液一起孵育后测定酶活性。从图 6中发现, 该纤维素酶在pH为5—7时, 粗酶液保持较高活性, 其中在pH为6时, 酶活性最高, 达到(1153.9±47.303)U/mL; 随着pH的不断升高, 酶活性也不断下降, 可能是由于偏碱性环境对导致酶活产生一定的损失。
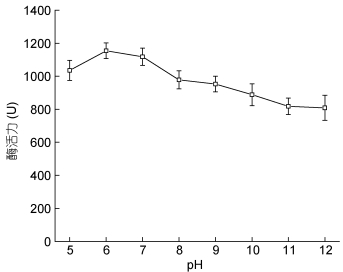 |
| 图 6 pH对酶活性的影响 Fig. 6 The effect of pH on enzymatic activity. |
用稀盐酸或氢氧化钠将粗酶液的pH调节至4—9, 在室温下放置1h后, 分别测定残余酶活力。由图 7可知, 该纤维素酶具有较广的pH耐受范围:在pH为4的环境下保存1h后, 残留酶活性仍然有60%以上; 随着pH的上升, 酶稳定性也随之上升, 在pH为5—7时, 残留酶活性均能保持在80%左右; 当pH超过7以后, 酶活性明显降低, 但在pH升高到9时, 仍然能保持60%以上的酶活性, 这说明该酶在pH为5—7的环境中较为稳定, 在pH为4—9的范围内仍具有一定的应用价值。
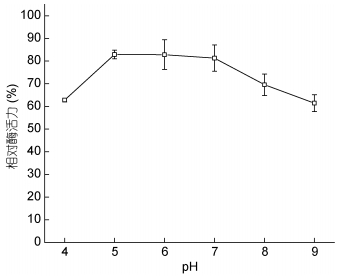 |
| 图 7 pH对酶稳定性的影响 Fig. 7 Effect of pH on enzyme stability |
在酶与底物反应混合物中加入1mmol/L的各种金属离子, 按酶活力测定方法测定其酶活, 以不加金属离子的酶活为100%计算相对酶活。结果表明, 仅Cu2+对酶活有一定的抑制作用, Ba2+对该酶的影响不明显, Zn2+、Fe3+、Mg2+、Ca2+、Fe2+、Mn2+和Co2+均对酶活有一定的促进作用, 结果见表 2。
| 金属离子 | 相对酶活(%) |
| 对照 | 100.00 |
| Ca2+ | 124.90 |
| Mg2+ | 110.79 |
| Fe2+ | 127.63 |
| Fe3+ | 113.42 |
| Cu2+ | 82.99 |
| Mn2+ | 127.37 |
| Zn2+ | 108.95 |
| Ba2+ | 100.26 |
| Co2+ | 139.21 |
枯草芽孢杆菌是当今酶生产中应用最广泛的菌种之一, 由于其能够分泌植酸酶、蛋白酶、纤维素酶、淀粉酶、脂肪酶等十几种酶类, 并且能够形成芽孢, 在酸性、碱性、高温等应用环境中具有明显的优势(杨锋等, 2011)。研究表明, 红树林生态系统中芽孢杆菌属在土壤细菌中属于优势种群(Alongi, 1988; 林鹏等, 2005), 因此从红树林生态系统中分离及筛选产酶枯草芽孢杆菌能够较好地获取独特的菌株资源。通过生理生化特征分析发现, JCHL0207菌株除了具有芽孢杆菌属的基本特性外, 还具有产淀粉酶、蛋白酶和纤维素酶的能力。16S rRNA序列分析表明, 该菌株能够与枯草芽孢杆菌近缘种群中10个有效菌种形成一个大的分支, 并且与枯草芽孢杆菌(AM062688)相似度最高, 达到99.79%, 结合生理生化特征, 进一步说明JCHL0207菌株为枯草芽孢杆菌。
研究发现, 大多数芽孢杆菌所产的纤维素酶的最适反应温度在30—40℃, 最适pH为6—8(杨柳等, 2008; 钱林等, 2010; 崔海洋等, 2014)。菌株JCHL0207所产的纤维素酶的最适反应温度为55℃, 最适pH为6, 较为少见, 这与禤金彩等(2014)从原始林区泥样中分离的蜡样芽孢杆菌L-30所产纤维素酶的最适反应pH和最适温度值较为一致。酶学性质分析发现, 菌株JCHL0207所产的纤维素酶在30—55℃时具有较好的热稳定性, 其在55℃下保温1h后, 相对酶活保持在90%左右, 而保温2h后, 相对酶活仍保持在80%以上, 其热稳定性略优于方卫东等(2015)分离的海洋生境地衣芽孢杆菌FA08所产的纤维素酶, 该酶在50—70℃保温1h后, 相对酶活维持在75—80%。同时, 菌株JCHL0207拥有较为广泛的pH耐受范围, 在pH为5.0—7.0的环境中, 酶稳定性较高, 基本维持在80%左右, 当pH降低到4或者升高到9时, 该酶仍然具有60%以上的酶活性, 这对于海水偏碱性(pH为7.5—8.2)的环境来说, 仍具有一定的适用性。尽管钱林等(2010)分离的蜡状芽孢杆菌DSH所产生的纤维素酶在pH为6—8的情况下, 相对酶活可以达到80%以上, 但需要在37℃下经过66h才能达到酶活高峰, 而菌株JCHL0207在37℃、pH为7的条件下发酵培养24h即可达到酶活高峰, 这也为该菌株的生产应用提供了一定的优势。
较多的研究认为在纤维素酶中添加一些金属离子或活性剂对酶活力有一定的影响, 但不同金属离子对不同菌株所产的纤维素酶的影响程度不同。如田新玉等(1998)报道Fe2+和Cu2+对嗜碱芽孢杆菌N6-27碱性纤维素酶活力有强烈抑制作用, Mn2+有部分抑制作用, 而Ca2+和Mg2+能略微提高酶活力; 沈雪亮等(2002)报道Ca2+和Mn2+对芽孢杆菌属ZU-04菌株所产的纤维素酶有一定的促进作用; 胥兵等(2006)研究发现Zn2+和Fe3+对枯草芽孢杆菌C-36所产的纤维素酶有强抑制作用, 而Ba2+和Fe2+对该酶反应有一定的促进作用。本研究中发现绝大多数金属离子对菌株JCHL0207所产的纤维素酶均有不同程度的促进作用, 其中Co2+对纤维素酶的促进作用最为明显, 提高了39.21%, 仅发现Cu2+对该酶有一定的抑制作用, 使酶活性下降了17.01%。这一结果说明为该菌株所产的纤维素酶对金属离子有较好的适应性, 为其进一步被应用于水产饲料生产提供了一定的优势。
4 结论红树林独特的生态环境能够孕育特殊的微生物群体, 而在红树林土壤细菌中处于优势菌群的芽孢杆菌属是选育较强环境适应性工程菌的天然宝库。本研究从红树林根际土壤中筛选到一株产多酶系的枯草芽孢杆菌, 并对该菌株所产的纤维素酶进行了酶学性质分析, 通过热稳定性和pH稳定性分析确定该菌株所产的纤维素酶具有较好的温度及pH适应性, 尤其适用于环境温度较高的热带及亚热带地区。同时, 环境中常见的Fe3+、Mg2+、Ca2+、Fe2+、Mn2+等金属离子都对该菌株所产的纤维素酶有不同程度的促进作用, 仅Cu2+离子对其有一定的抑制作用, 这表明菌株具有较好的金属离子适应范围, 为其在水产饲料添加剂中的进一步研究与应用提供参考依据。
| 马军, 马芮, 叶佳琪, 等, 2015. 红树林根际土壤中产三种酶枯草芽孢杆菌的分离鉴定. 琼州学院学报, 22 (5) : 61–66 |
| 王学东, 呙于明, 姚娟, 等, 2008. 芽孢杆菌在仔猪日粮中的应用效果初探. 中国畜牧杂志. 2008, 44 (21) : 46–48 |
| 方卫东, 唐旭, 刘源森, 等, 2015. 一株海洋生境芽孢杆菌FA08的筛选、鉴定及其酶学特性和抗菌性能分析. 海洋与湖沼, 46 (5) : 1228–1234 |
| 布坎南R E, 吉本斯N E, 1984. 伯杰氏细菌鉴定手册. 北京: 科学出版社, 274-297 |
| 龙淼, 何润霞, 刘敏月, 等, 2015. 一株兔源枯草芽孢杆菌的分离鉴定及产酶能力研究. 中国饲料, (9) : 23–25, 34 |
| 龙寒, 向伟, 庄铁城, 等, 2005. 红树林区微生物资源. 生态学杂志, 24 (6) : 696–702 |
| 东秀珠, 蔡妙英, 2001. 常见细菌系统鉴定手册. 北京: 科学出版社, 349-398 |
| 田新玉, 王欣, 1998. 嗜碱芽孢杆菌N6-27碱性纤维素酶的纯化及性质. 微生物学报, 38 (4) : 310–312 |
| 刘德海, 杨玉华, 李新杰, 等, 2000. 纤维素复合酶对奶牛的应用效果. 饲料研究, (5) : 29 |
| 李宝玉, 姜建阳, 马永喜, 等, 2000. 纤维素酶在生长猪日粮中的应用. 中国饲料, (3) : 16–17 |
| 杨柳, 魏兆军, 朱武军, 等, 2008. 产纤维素酶菌株的分离、鉴定及其酶学性质研究. 微生物学杂质, 28 (4) : 65–69 |
| 杨锋, 章亭洲, 2011. 枯草芽孢杆菌生物学特性的研究. 饲料研究, (3) : 34–36 |
| 沈文英, 李卫芬, 梁权, 等, 2011. 饲料中添加枯草芽孢杆菌对草鱼生长性能、免疫和抗氧化功能的影响. 动物营养学报, 23 (5) : 881–886 |
| 沈雪亮, 夏黎明, 2002. 产纤维素酶细菌的筛选及酶学特性研究. 林产化学与工业, 22 (1) : 47–51 |
| 林鹏, 张瑜斌, 邓爱英, 等, 2005. 九龙江口红树林土壤微生物的类群及抗菌活性. 海洋学报, 27 (3) : 133–141 |
| 周煜, 1999. 16S rRNA序列分析法在医学微生物鉴定中的应用. 生物技术通讯, 10 (4) : 297–305 |
| 胥兵, 陈惠, 韩学易, 等, 2006. 枯草芽孢杆菌C-36纤维素酶的纯化及酶学性质. 四川农业大学学报, 24 (4) : 398–401 |
| 钱林, 郑巧利, 付瑾, 等, 2010. 一株高效纤维素降解菌株的分离鉴定及其酶学性质. 微生物学通报, 37 (4) : 524–528 |
| 曹凤明, 杨小红, 马鸣超, 等, 2014. 枯草芽孢杆菌近缘种群鉴定方法研究进展. 微生物学通报, 41 (5) : 968–974 |
| 崔海洋, 程仕伟, 黄田红, 等, 2014. 产纤维素酶的解淀粉芽孢杆菌分离鉴定及酶学性质研究. 食品科学技术学报, 32 (3) : 43–47 |
| 禤金彩, 廖龙, 龙寒, 等, 2014. 一株产纤维素酶蜡样芽孢杆菌的分离鉴定及酶学性质初步研究. 南方农业学报, 45 (6) : 984–988 |
| Alongi D M, 1988. Bacterial productivity and microbial biomass in tropical mangrove sediments. Microbial Ecology, 15 (1) : 59–79 DOI:10.1007/BF02012952 |
| Ettoumi B, Guesmi A, Brusetti L, et al, 2013. Microdiversity of Deep-Sea Bacillales Isolated from Tyrrhenian Sea Sediments as Revealed by ARISA, 16S rRNA Gene Sequencing and BOX-PCR Fingerprinting. Microbes and Environments, 28 (3) : 361–369 DOI:10.1264/jsme2.ME13013 |
| Gatson J W, Benz B F, Chandrasekaran C, et al, 2006. Bacillus tequilensis sp. nov., isolated from a 2000-year-old Mexican shaft-tomb, is closely related to Bacillus subtilis. International Journal of Systematic and Evolutionary Microbiology, 56 (7) : 1475–1484 DOI:10.1099/ijs.0.63946-0 |
| Horikoshi K, Nakao M, Kurono Y, et al, 1984. Cellulases of an alkalophilic Bacillus strain isolated from soil. Canadian Journal of Microbiology, 30 (6) : 774–779 DOI:10.1139/m84-118 |
| Nakamura L K, 1989. Taxonomic relationship of black-pigmented Bacillus subtilis strains and a proposal for Bacillus atrophaeus sp. nov. International Journal of Systematic Bacteriology, 39 (3) : 295–300 DOI:10.1099/00207713-39-3-295 |
| Palmisano M M, Nakamura L K, Duncan K E, et al, 2001. Bacillus sonorensis sp. nov., a close relative of Bacillus licheniformis, isolated from soil in the Sonoran Desert, Arizona. International Journal of Systematic and Evolutionary Microbiology, 51 (5) : 1671–1679 DOI:10.1099/00207713-51-5-1671 |
| Pointing S B, Buswell J A, Jones E B G, et al, 1999. Extracellular cellulolytic enzyme profiles of five lignicolous mangrove fungi. Mycological Research, 103 (6) : 696–700 DOI:10.1017/S0953756298007655 |
| Priest F G, Goodfellow M, Shute L A, et al, 1987. Bacillus amyloliquefaciens sp. nov., nom. rev. International Journal of Systematic Bacteriology, 37 (1) : 69–71 DOI:10.1099/00207713-37-1-69 |
| Roberts M S, Nakamura L K, Cohan F M, 1994. Bacillus mojavensis sp. nov., distinguishable from Bacillus subtilis by sexual isolation, divergence in DNA sequence, and differences in fatty acid composition. International Journal of Systematic Bacteriology, 44 (2) : 256–264 DOI:10.1099/00207713-44-2-256 |
| Roberts M S, Nakamura L K, Cohan F M, et al, 1996. Bacillus vallismortis sp. nov., a close relative of Bacillus subtilis, isolated from soil in Death Valley, California. International Journal of Systematic Bacteriology, 46 (2) : 470–475 DOI:10.1099/00207713-46-2-470 |
| Sumpavapol P, Tongyonk L, Tanasupawat S, et al, 2010. Bacillus siamensis sp.nov., isolated from salted crab (poo-khem) in Thailand. International Journal of Systematic and Evolutionary Microbiology, 60 (10) : 2364–2370 DOI:10.1099/ijs.0.018879-0 |
| Wu R Y, 1993. Studies on the microbial ecology of Tansui Estuary. Botanical Bulletin of Academia Sinica, 34 (1) : 13–30 |
 2016, Vol. 47
2016, Vol. 47


