中国海洋湖沼学会主办。
文章信息
- 徐成勋, 李琪, 张景晓, 孔令. 2016.
- XU Cheng-Xun, LI Qi, ZHANG Jing-Xiao, KONG Ling-Feng. 2016.
- 近交对壳金长牡蛎(Crassostrea gigas)幼虫期与稚贝期生长和存活的影响
- EFFECTS OF INBREEDING ON GROWTH AND SURVIVAL OF LARVAL AND JUVENILE GOLDEN-SHELL PACIFIC OYSTER (CRASSOSTREA GIGAS)
- 海洋与湖沼, 47(5): 977-981
- Oceanologia et Limnologia Sinica, 47(5): 977-981.
- http://dx.doi.org/10.11693/hyhz20160300057
-
文章历史
- 收稿日期:2016-03-17
- 收修改稿日期:2016-06-25
近交(inbreeding)是指有亲缘关系的个体通过相互交配, 使一个群体内纯合基因型增加的现象(Keller et al, 2002)。随着人们对水产品的需求量逐渐增大, 水产品的人工捕捞量逐年增加, 依靠人工养殖来替代部分人工捕捞以满足需求渐渐成为趋势。水产动物养殖苗种的亲本大多来源于养殖群体, 由于水产动物产卵量大, 育苗生产中使用的亲本数量往往有限, 因而养殖群体内近交的发生是不可避免的。近交常常会造成物种的某些性状衰退, 这种效应被称为近交衰退(inbreeding depression)。相比于形态学性状, 与适应性相关的综合性状更容易表现出近交衰退(马大勇等, 2005), 如生存能力、繁殖能力和竞争能力等。目前对水产动物近交衰退的研究主要针对鱼类, 如团头鲂(Megalobrama amblycephala)(Li et al, 2003), 银大马哈鱼(Oncorhynchus kisutch)(Myers et al, 2001; Gallardo et al, 2004), 大西洋鲑(Salom salar)(Rye et al, 1998)等, 研究的焦点主要集中在鱼类的生长、存活和性腺发育程度等相关性状的近交衰退上。针对海产贝类, 国内外学者围绕贝类幼虫、稚贝和成体的生长与存活等方面开展了近交衰退的影响研究(Beattie et al, 1987; 张海滨, 2005; Zheng et al, 2012; 梁健等, 2013; 傅强等, 2015)。
长牡蛎(Crassostrea gigas), 又称太平洋牡蛎, 具有生长快、适应性强、肉质细腻和营养丰富等优点, 是世界性的牡蛎养殖种。自20世纪80年代以来, 我国长牡蛎的人工养殖技术得到快速发展, 经过长时间的探索和完善后已经相对成熟, 长牡蛎的养殖量也逐年攀升。2014年我国牡蛎养殖总产量超过435万吨, 占全国贝类养殖总产量的33.1%(农业部渔业渔政管理局, 2015)。虽然目前统计资料没有区分养殖牡蛎的具体种类, 但据估计长牡蛎的养殖产量应占总量的1/3左右(于瑞海等, 2008)。近年来, 随着长牡蛎养殖规模不断扩大, 产量不断提高, 长牡蛎养殖也出现了种质退化现象。为了维护长牡蛎养殖业的健康可持续发展, 国内学者先后对长牡蛎展开了遗传育种的研究工作, 针对壳形, 壳色, 生长存活等性状方面的遗传改良工作已取得一定进展(王庆志, 2011; 王庆志等, 2013; 丛日浩, 2014), 并培育出壳色为金色的壳金长牡蛎新品系(丛日浩等, 2014; 葛建龙等, 2015)。
为探讨近交对壳金长牡蛎生长和存活性状的影响, 本研究以壳金长牡蛎品系为材料, 通过构建近交家系, 研究了近交对壳金长牡蛎家系幼虫期与稚贝期生长和存活的影响, 以期为壳金长牡蛎的进一步培育工作提供依据和参考。
1 材料和方法 1.1 亲贝来源及实验设计实验用亲贝来自于2014年以第四代壳金长牡蛎群体构建的全同胞壳金长牡蛎家系G19(近交系数Fx=0.25)。从壳金长牡蛎家系G19一龄贝中, 挑选壳色性状优良、壳型规则、外表无损伤的雌雄成贝各10个, 通过进行单对兄妹交配获得10个全同胞F1家系。同时从山东省乳山长牡蛎野生群体中选取壳型规则、外表无损伤的个体雌雄成贝各10个, 逐一单对交配获得10个全同胞家系作为对照组。实验在山东省莱州市海益苗业有限公司的育苗基地进行。
1.2 亲贝促熟和人工授精孵化2015年5月将从乳山采集的亲贝运往莱州市海益苗业有限公司的育苗基地进行室内暂养。暂养期间投喂球等鞭金藻(Isochrysis galbana)和小新月菱形藻(Nitzschia closterium)进行人工育肥。挑选性腺发育良好的亲贝, 进行人工解剖授精。剖开牡蛎, 挑取少量性腺组织于载玻片上辨别雌雄, 呈烟雾状为雄性, 呈颗粒状散开则为雌性。雌雄各辨别出10个, 分别利用250目和300目筛绢获取卵子和精子。将10个雌性亲贝的卵子分别置于盛有海水10个15L桶中, 水温保持为25°C。卵子经过15min熟化后, 将10个雄性亲贝的精子分别与之逐一充分混合。各组孵化密度为每毫升50-70个卵, 孵化期间微充气。各家系的实验器具单独使用, 避免污染。各家系的建立均在1天内完成。
1.3 选优和幼虫培育经过22h孵化, 受精卵发育成D形幼虫。选优前, 停止充气15min。用350目的筛绢网进行选优, 将选出的幼虫置于100L聚乙烯塑料桶中进行培育, 调节培育密度为5ind./mL。培育温度为24-26°C。持续充气, 每日换水2次, 每次换水量为原体积的1/3。每日投饵4次, 培育前期投喂球等鞭金藻, 后期补充投喂扁藻(Platymonas sp.)。充气、换水和投饵等一系列操作保持一致, 并且每次使用实验器具后用淡水进行冲洗, 防止家系间的污染。
1.4 采苗和稚贝养成幼虫发育20天后, 出现眼点。眼点幼虫达总数1/3时, 投放栉孔扇贝壳作为附着基。室内附着10天后, 将附着好的附着基放入室外暂养池暂养30天后, 转移到荣成俚岛镇海区进行稚贝的浮筏暂养。待自然海区无野生牡蛎浮游幼虫时, 转至乳山海阳所镇海区进行笼式浮筏稚贝养成。实验组与对照组的养殖密度、水层深度均保持一致。
1.5 数据测量和分析分别测量壳金F1家系和对照组长牡蛎1、5、10、15、20、85、130、190日龄的壳高、壳长和存活率, 每组随机测量30个个体。将D形幼虫放在显微镜下测量, 稚贝用游标卡尺测量。幼虫存活率为单位体积内幼虫数与初始幼虫数的百分比, 稚贝存活率为不同日龄存活稚贝个数与初始稚贝个数的百分比。
壳金F1家系各日龄的壳高、壳长和存活的近交衰退率的计算公式如下(Crnokrak et al, 1999; Zheng et al, 2008):
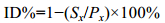
式中, Sx为壳金F1家系的壳高、壳长或存活率, Px为对照组壳高、壳长或存活率。
实验数据用SPSS 19.0软件进行单因素方差分析(ANVOA), 并进行T检验(T–test)显著性检验, 显著性设置为α=0.05。
2 结果 2.1 壳金F1家系在幼虫和稚贝期壳高的变化及近交衰退壳金F1家系和对照组幼虫期的壳高变化和近交衰退率如表 1所示。方差分析和T检验结果表明, 壳金F1家系壳高在幼虫期的生长速度(9.57μm/d)低于对照组(11.04μm/d), 且两者之间的差异仅在1日龄时不显著(P > 0.05)。在1日龄至10日龄间, 壳金F1家系壳高的近交衰退率呈递增的趋势, 在10日龄时达到最大, 为13.70%, 之后稳定在11%左右。
| 实验组 | 幼虫日龄 | 生长速度 | ||||
| 1 | 5 | 10 | 15 | 20 | ||
| F1家系壳高 | 65.06±2.67a | 81.62±4.68a | 102.80±12.18a | 163.99±17.52a | 246.84±49.78a | 9.57 |
| 对照组壳高 | 65.61±4.23a | 87.06±5.19b | 119.12±8.91b | 185.94±21.19b | 275.32±23.76b | 11.04 |
| 近交衰退率 | 0.85% | 6.25% | 13.70% | 11.81% | 10.34% | |
| 注:壳高单位为μm, 生长速度单位为μm/d, 同一列中上标为相同字母表示没有显著性差异(P > 0.05) | ||||||
壳金F1家系和对照组稚贝期的壳高变化和近交衰退率如表 2所示。在稚贝期, 壳金F1家系的壳高仍小于对照组, 但两者的差异在逐渐减小, 在85日龄和130日龄时差异显著(P < 0.05), 在190日龄时差异不显著(P > 0.05)。壳金F1家系壳高的近交衰退率在稚贝期呈递减趋势, 在190日龄时达到最低, 为6.16%。
| 实验组 | 稚贝日龄 | ||||||||
| 85 | 130 | 190 | |||||||
| 壳高 | 壳长 | 壳高 | 壳长 | 壳高 | 壳长 | ||||
| F1家系组 | 13.19±2.40a | 9.69±2.02a | 31.16±6.88a | 18.61±4.71a | 32.08±9.60a | 21.33±7.36a | |||
| 对照组 | 14.64±4.13b | 11.30±3.56b | 33.89±6.43b | 20.75±5.21b | 34.19±5.93a | 21.72±4.42a | |||
| 近交衰退率 | 9.90% | 14.21% | 8.04% | 10.31% | 6.16% | 1.76% | |||
| 注:壳长和壳高单位为mm, 同一列中上标为相同字母表示没有显著性差异(P > 0.05) | |||||||||
壳金F1家系和对照组幼虫期的壳长变化和近交衰退率如表 3所示。在幼虫期, 与壳高的变化相似, 壳金F1家系壳长的生长速度(7.67μm/d)也低于对照组(8.32μm/d), 两者壳长的差异仅在1日龄差异不显著(P > 0.05)。在1日龄至10日龄间, 壳金F1家系壳长的近交衰退率呈递增的趋势, 在10日龄时达到最大, 为10.83%, 之后稳定在6%左右。
| 实验组 | 幼虫日龄 | 生长速度 | ||||
| 1 | 5 | 10 | 15 | 20 | ||
| F1家系壳长 | 73.67±2.51a | 86.10±4.16a | 97.09±9.24a | 146.04±15.99a | 219.49±35.45a | 7.67 |
| 对照组壳长 | 74.22±4.17a | 89.54±3.83b | 108.89±6.31b | 158.44±18.22b | 232.22±18.65b | 8.32 |
| 近交衰退率 | 0.75% | 3.84% | 10.83% | 7.83% | 5.48% | |
| 注:壳长单位为μm, 生长速度单位为μm/d, 同一列中上标为相同字母表示没有显著性差异(P > 0.05) | ||||||
壳金F1家系和对照组稚贝期的壳长变化和近交衰退率如表 2所示。在稚贝期, 壳金F1家系的壳长仍小于对照组, 但两者的差异在逐渐减小, 在85日龄和130日龄时差异显著(P < 0.05), 在190日龄时差异不显著(P > 0.05)。壳金F1家系壳长的近交衰退率在稚贝期呈递减趋势, 在190日龄时达到最低, 为1.76%。
2.3 壳金F1家系在幼虫期和稚贝期的存活率及近交衰退率壳金F1家系和对照组在幼虫期和稚贝期的存活率及近交衰退率如表 4、表 5所示。在幼虫期各日龄, 壳金F1家系的存活率均低于对照组, 且两者之间的差异仅在20日龄时显著(P < 0.05)。壳金F1家系的近交衰退率也随时间的增加而增加, 在20日龄时达到最大, 为27.44%。
| 实验组 | 幼虫日龄 | ||||
| 1 | 5 | 10 | 15 | 20 | |
| F1家系存活率 | 88.71±3.27a | 77.27±3.76a | 60.74±6.91a | 40.88±6.64a | 27.09±5.96a |
| 对照组存活率 | 92.63±3.35a | 81.57±3.65a | 67.07±5.45a | 48.03±7.61a | 37.33±6.18b |
| 近交衰退率 | 4.24 | 5.27 | 9.43 | 14.89 | 27.44 |
| 注:同一列中上标为相同字母表示没有显著性差异(P > 0.05) | |||||
| 实验组 | 稚贝日龄 | ||
| 85 | 130 | 190 | |
| F1家系存活率 | 36.16±4.14a | 27.62±4.01a | 19.63±3.76a |
| 对照组存活率 | 36.87±2.80a | 30.77±4.18a | 20.93±2.53a |
| 近交衰退率 | 1.92 | 4.18 | 2.53 |
| 注:同一列中上标为相同字母表示没有显著性差异(P > 0.05) | |||
在稚贝期, 壳金F1家系的存活率依旧低于对照组。但两者之间的差异并不显著(P > 0.05)。其存活的近交衰退率没有明显的变化趋势, 稳定在3%左右。
3 讨论通常情况下, 近交会使物种的所有性状都衰退, 但不同性状受到近交衰退的影响并不完全相同。一般来说, 近交更倾向于使一些与生物适应度密切相关的性状出现衰退(Charlesworth et al, 2009)。在本研究中, 壳金长牡蛎的壳高、壳长和存活率在幼虫期与稚贝期均发生了一定程度的近交衰退。与生长相关的壳高和壳长在大部分情况下与对照组差异明显, 而存活率与对照组的差异却不显著(P > 0.05)。这与Beattie等对长牡蛎全同胞家系后代研究发现壳大小和肉重等都有显著衰退(Beattie et al, 1987), 及Lannan研究发现长牡蛎全同胞家系后代存活率没有衰退的结果相似(Lannan, 1980)。这说明相对于存活, 与生长相关的壳高、壳长等指标更容易受到近交衰退的影响。越来越多的学者支持产生近交衰退的“显性假说”(Cheptou et al, 2000; Zheng et al, 2008), 即近交使在杂合状态下不表达的隐性有害等位基因纯合, 这种隐性有害等位基因表达后容易被淘汰, 从而导致相关表型性状的衰退。本研究中壳高和壳长与存活率相比更容易受到影响, 可能是由于控制壳高和壳长的基因在壳金F1家系中有较高的杂合度, 因此在近交时更容易使隐性有害等位基因纯合, 导致产生相对较小的个体。
幼虫期, 壳金F1家系壳高和壳长的生长都慢于对照组, 但二者之间的差异仅在1日龄时不显著(P > 0.05), 其原因可能与母性效应有关。Cruz在对扇贝杂交的研究中也观察到类似现象(Cruz et al, 1997)。幼虫期, 壳金F1家系的存活率普遍低于对照组, 但仅在20日龄时其存活率与对照组差异显著(P < 0.05), 这可能与环境胁迫对幼虫变态发育的影响有关。20日龄左右, 幼虫开始出现眼点, 正值附着变态的关键时期, 对环境的变化相对敏感, 环境因子的波动可能会导致遗传基础薄弱的个体死亡。因此可以推测, 控制长牡蛎附着变态的基因在壳金长牡蛎品系的群体中杂合度相对较高, 近交时容易使隐性有害等位基因纯合, 从而造成附着变态期的高死亡率。
在本研究中, 稚贝期壳金F1家系壳高和壳长虽慢于对照组, 但二者的差异在逐渐缩小, 至190日龄时, 壳金F1家系壳高和壳长与对照组无显著差异(P > 0.05)。这可能与环境胁迫有关, 稚贝初期, 幼虫经过附着变态, 从室内人工培育移至室外暂养, 室内外的不同环境因子可能会对壳金长牡蛎发生胁迫。Armbruster等(2005)认为环境胁迫会加剧近交衰退的程度, 从而导致稚贝初期壳金长牡蛎壳高和壳长的低生长率。稚贝期壳金F1家系的存活率与对照组相比无显著差异(P > 0.05), 这说明近交对壳金F1家系稚贝期存活的影响不大, 与张景晓等(2014)对长牡蛎近交研究的结果类似。
4 结论品系的稳定性和适应性是遗传改良的重要目标(张国范等, 2006)。在遗传育种时, 不仅要考虑通过近交使优良的性状得到纯化, 还要考虑如何避免近交给其它性状带来的衰退效应。本研究中, 虽然壳金长牡蛎家系近交所产生后代的壳色性状得到了保留和纯化, 但在壳高、壳长与存活率方面都发生了一定程度的衰退。因此, 在长牡蛎遗传育种工作中, 不能一味通过增加近交代数来获得纯系, 还应该结合选择育种、杂交育种、分子辅助育种等多种手段来优化选育进程, 这样才能培育出优良的长牡蛎新品种。
| 于瑞海, 李琪, 王昭萍, 等, 2008. 我国北方太平洋牡蛎育苗及养殖现状. 科学养鱼, (6) : 3–5 |
| 马大勇, 胡红浪, 孔杰, 2005. 近交及其对水产养殖的影响. 水产学报, 29 (6) : 849–856 |
| 王庆志, 2011.长牡蛎品种选育与生长性状的遗传参数估计.青岛:中国海洋大学博士学位论文, 113-119. |
| 王庆志, 李琪, 孔令锋, 等, 2013. 长牡蛎第三代选育群体生长性状的选择效应. 水产学报, 37 (10) : 1487–1494 |
| 丛日浩, 2014.长牡蛎快速生长品系选育及重要功能基因与生长和糖原含量相关性研究.青岛:中国海洋大学博士学位论文, 67-77 http://cdmd.cnki.com.cn/article/cdmd-10423-1014369153.htm |
| 丛日浩, 李琪, 葛建龙, 等, 2014. 长牡蛎4种壳色家系子代的表型性状比较. 中国水产科学, 21 (3) : 494–502 |
| 农业部渔业渔政管理局, 2015. 中国渔业统计年鉴. 北京: 中国农业出版社, |
| 张国范, 刘晓, 2006. 关于贝类遗传改良几个问题的讨论. 水产学报, 30 (1) : 130–137 |
| 张海滨, 2005.海湾扇贝近交生物学效应和遗传改良研究.青岛:中国科学院研究生院(海洋研究所)博士学位论文. http://cdmd.cnki.com.cn/article/cdmd-80068-2005042073.htm |
| 张景晓, 李琪, 葛建龙, 等, 2014. 近交对长牡蛎幼虫和稚贝生长与存活的影响. 水产学报, 38 (12) : 2005–2011 |
| 梁健, 闫喜武, 霍忠明, 等, 2013. 不同近交系数蛤仔橙色品系的生长和成活研究. 南方水产科学, 9 (4) : 87–93 |
| 葛建龙, 李琪, 于红, 等, 2015. 长牡蛎3种壳色家系间杂交子代生长和存活比较. 水产学报, 39 (3) : 345–352 |
| 傅强, 王师, 赵亮, 等, 2015. 不同近交系数的虾夷扇贝近交衰退研究. 中国海洋大学学报, 45 (11) : 43–48 |
| Armbruster P, Reed D H, 2005. Inbreeding depression in benign and stressful environments. Heredity, 95 (3) : 235–242 DOI:10.1038/sj.hdy.6800721 |
| Beattie J, Perdue J, Hershberger W, et al, 1987. Effects of inbreeding on growth in the Pacific oyster (Crassostrea gigas). Journal of Shellfish Research, 6 (1) : 25–28 |
| Charlesworth D, Willis J H, 2009. The genetics of inbreeding depression. Nature Reviews Genetics, 10 (11) : 783–796 DOI:10.1038/nrg2664 |
| Cheptou P O, Berger A, Blanchard A, et al, 2000. The effect of drought stress on inbreeding depression in four populations of the Mediterranean outcrossing plant Crepis sancta(Asteraceae). Heredity, 85 (3) : 294–302 DOI:10.1046/j.1365-2540.2000.00759.x |
| Crnokrak P, Roff D A, 1999. Inbreeding depression in the wild. Heredity, 83 (3) : 260–270 DOI:10.1038/sj.hdy.6885530 |
| Cruz P, Ibarra A M, 1997. Larval growth and survival of two catarina scallop (Argopecten circularis, Sowerby. 1835) populations and their reciprocal crosses. Journal of Experimental Marine Biology and Ecology, 212 (1) : 95–110 DOI:10.1016/S0022-0981(96)02742-6 |
| Gallardo J A, García X, Lhorente J P, et al, 2004. Inbreeding and inbreeding depression of female reproductive traits in two populations of Coho salmon selected using BLUP predictors of breeding values. Aquaculture, 234 (1-4) : 111–122 DOI:10.1016/j.aquaculture.2004.01.009 |
| Keller L F, Waller D M, 2002. Inbreeding effects in wild populations. Trends in Ecology & Evolution, 17 (5) : 230–241 |
| Lannan J E, 1980. Broodstock management of Crassostrea gigas:I. Genetic and environmental variation in survival in the larval rearing system. Aquaculture, 21 (4) : 323–336 |
| Li S F, Cai W Q, 2003. Genetic improvement of the herbivorous blunt snout bream (Megalobrama amblycephala). Naga, 26 (1) : 20–23 |
| Myers J M, Heggelund P O, Hudson G, et al, 2001. Genetics and broodstock management of coho salmon. Aquaculture, 197 (1-4) : 43–62 DOI:10.1016/S0044-8486(01)00582-8 |
| Rye M, Mao I L, 1998. Nonadditive genetic effects and inbreeding depression for body weight in Atlantic salmon(Salmo salar L.). Livestock Production Science, 57 (1) : 15–22 DOI:10.1016/S0301-6226(98)00165-1 |
| Zheng H P, Li L, Zhang G F, 2012. Inbreeding depression for fitness-related traits and purging the genetic load in the hermaphroditic bay scallop Argopecten irradians irradians(Mollusca: Bivalvia). Aquaculture, 366-367 : 27–33 DOI:10.1016/j.aquaculture.2012.08.029 |
| Zheng H P, Zhang G F, Guo X M, et al, 2008. Inbreeding depression for various traits in two cultured populations of the American bay scallop, Argopecten irradians irradians Lamarck (1819) introduced into China. Journal of Experimental Marine Biology and Ecology, 364 (1) : 42–47 DOI:10.1016/j.jembe.2008.06.027 |
 2016, Vol. 47
2016, Vol. 47


