中国海洋湖沼学会主办。
文章信息
- 杨洋, 孙晓霞. 2016.
- YANG Yang, SUN Xiao-Xia. 2016.
- 南黄海网采浮游植物碳含量及群落结构的季节变化
- SEASONAL VARIATIONS OF NET PHYTOPLANKTON IN CARBON BIOMASS AND COMMUNITY STRUCTURE IN THE SOUTH YELLOW SEA
- 海洋与湖沼, 47(5): 954-962
- Oceanologia et Limnologia Sinica, 47(5): 954-962.
- http://dx.doi.org/10.11693/hyhz20160400072
-
文章历史
- 收稿日期:2016-04-01
- 收修改稿日期:2016-05-24
2. 中国科学院大学 北京 100049;
3. 青岛海洋国家实验室海洋生态与环境科学功能实验室 青岛 266071
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. Laboratory for Marine Ecology and Environmental Science, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071, China
浮游植物是海洋生态系统中最重要的初级生产者, 其类群组成、数量及分布的变动与海洋生态环境的变化密切相关(Nuccio et al, 2003; Irwin et al, 2006)。研究者在中国近海针对浮游植物的群落变动开展了大量生态调查。在北黄海(刘述锡等, 2013)、黄海中南部(王俊, 2003; Gao et al, 2013)、东海海域(刘海娇等, 2015; 赵其彪等, 2015)、南海海域(朱根海等, 2003; 马威, 2012)等区域的浮游植物调查结果显示, 不同季节浮游植物的分布和类群结构存在显著差异, 优势种具有明显季节演替, 反映出浮游植物在不同季节具有不同的生态适应性。
然而, 浮游植物群落结构的研究往往是以各个类群的丰度为基础, 未考虑到不同种群、不同细胞个体之间形态和大小上存在的差异(孙军等, 2000)。而细胞体积的差异在一定程度上导致各浮游植物类群在生态系统中的贡献不同。由此, 根据已有的浮游植物细胞个体体积与碳含量转换关系(Mullin et al, 1966; Strathmann, 1967; Eppley et al, 1970; Verity et al, 1992), 可以从各类群生物量变动的基础上探讨浮游植物群落时空变动的内在原因, 深入了解能量的内在流动(Sun et al, 2000)。
本文利用2011—2012年5个月份的调查资料, 从碳含量的角度分析了南黄海网采浮游植物的类群组成、空间分布及季节变化, 并进一步结合理化因子探讨浮游植物季节变化的内在原因, 为该海域生态系统状况的研究提供基础资料。
1 材料与方法 1.1 研究海域与站位布设本文研究的海域位于32°—37°N、120°—124°E之间的南黄海西侧海域, 浮游植物样品分别来源于4月(2011年)、6月(2012年)、8月(2012年)、10月(2012年)和11月(2011年)的航次调查。采样站位的布设如图 1所示, 各个航次的站位经纬度保持大体一致, 实际采样站位根据各航次的实际情况有略微调整, 但误差均维持在0.25°的范围以内。
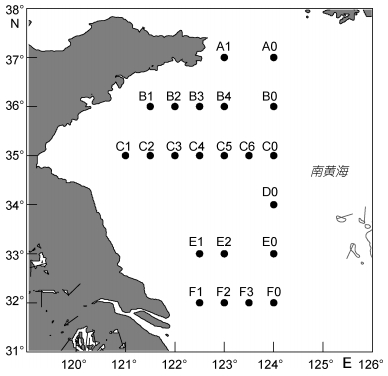 |
| 图 1 调查海域采样站位分布图 Fig. 1 Location of sampling stations in the South Yellow Sea |
浮游植物样品的采集与保存遵照《海洋调查规范第6部分:海洋生物调查》(GB/T12763.6-2007)的要求进行。采样工具为小型浮游生物采集网(孔径0.076mm, 网口面积0.1m2, 网长2.8m), 采样方式为自底至表垂直拖网, 网速约为0.5—0.8m/s。样品采集后, 立即于采样瓶中加入终浓度为5%的福尔马林溶液进行固定。在采集浮游植物样品的同时, 由船载SBE911 CTD (Sea-Bird Electronics Inc., 美国)获得各站位的温度、盐度和深度信息。在各站位, 遵照《海洋调查规范第4部分:海水化学要素调查》(GB/T12763.4-2007)的要求测定不同水层的营养盐(硅酸盐、磷酸盐、铵盐、硝酸盐和亚硝酸盐)。
1.3 浮游植物丰度与碳含量的获得用流式影像术(Flow cytometry and microscopy, FlowCAM) (Fluid Imaging Technologies Inc., 美国)对网采浮游植物样品进行分析( lvarez et al, 2011; Poulton, 2016)。将FlowCAM与BX-51显微镜(Olympus, 美国)的计数和测量结果分别进行比较, 表明FlowCAM的分析结果与传统显微镜法无显著差异(Yang et al, 2016)。在自动模式下, FlowCAM的拍照系统可以自动捕捉流经流通池的颗粒, 经FlowCAM内置软件Visual Spreadsheet分析, 获得扫描样品的细胞浓度及各个细胞图像的尺寸信息。各细胞的碳含量根据下列公式进行换算(Eppley et al, 1970; Sun et al, 2000):
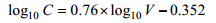 (1)
(1)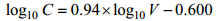 (2)
(2)公式(1)适用于硅藻细胞碳含量的转换, 公式(2)适用于其它藻细胞碳含量的转换。其中, C为细胞的转换碳含量值, 单位为pg; V为细胞体积, 由FlowCAM自动计算获得的等效球直径换算得出, 单位为μm3。由于夜光藻属(Noctiluca)的碳含量转换不适用于上述公式, 本文中浮游植物的丰度及碳含量数据均未涉及夜光藻属。
1.4 数据的统计分析各月份网采浮游植物各类群的碳含量优势度Yc的计算公式为:
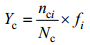
公式中, nci为第i属的总碳含量, Nc为浮游植物总碳含量, fi为第i属出现的频率。
温度、盐度和营养盐等环境因子与浮游植物碳含量的Pearson相关性分析利用SAS 9.1.3(SAS Institute Inc., 美国)软件进行。其中, 浮游植物碳含量数据经过对数(log10)正态性转换、百分比数据经过平方根反正弦转换以满足相关分析的前提条件。
2 结果与讨论 2.1 南黄海浮游植物碳含量的空间分布南黄海各个季节网采浮游植物碳含量的分布如图 2所示。春季(4月份), 各站位浮游植物碳含量值在43.77—1.53×104μgC/m3之间, 碳含量的高值区域出现在调查海域东北部的个别站位及中部近岸站位。南黄海中部区域碳含量较低, 浮游植物基本呈现由近岸到外海逐渐减少的趋势。
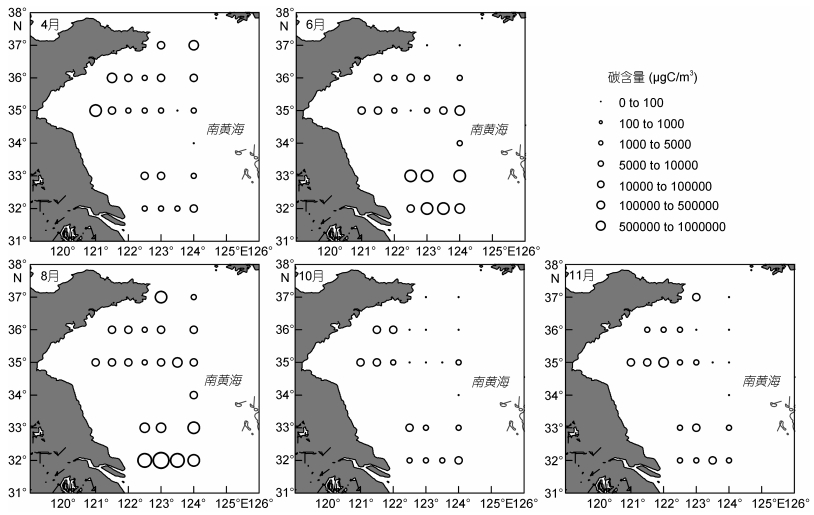 |
| 图 2 南黄海各月份网采浮游植物的碳含量分布图 Fig. 2 The distribution pattern of net phytoplankton carbon biomass (μgC/m3) in each sampling month in the South Yellow Sea |
夏季(6、8月份), 各站位碳含量值在30.37— 5.05×105μgC/m3之间。夏季浮游植物碳含量的分布表现出与春季分布的明显差异。此时, 调查海域的不同区域之间分布差异明显, 最大值出现在海域南部, E、F断面碳含量明显高于其它断面, 其中8月份K2站位出现碳含量的最高值。6月份A断面出现碳含量最低值, 中部B、C、D断面所在区域碳含量值较低, 近岸站位与外海站位的差异不大。
秋季(10、11月份), 各站位浮游植物碳含量值在0—6754.82μgC/m3之间。浮游植物碳含量在分布上没有明显的纬度间差异, 而呈现出由近岸到外海显著减少的趋势。外海大部分站位的碳含量值在500μgC/m3以下。
南黄海区域的浮游植物分布在不同季节各有特点, 春季时期分布较为均匀; 夏季时期区域差异明显, 在海域南部大量分布; 秋季时期浮游植物含量最低, 区域差异不大, 而呈现明显的由近岸到外海降低的特点。中部海域浮游植物在春季最多, 夏季次之, 秋季最少。南部区域在夏季达到最大值。
2.2 南黄海浮游植物碳含量的季节变化调查海域的浮游植物各月份平均碳含量如图 3所示。不同季节浮游植物的平均碳含量差异明显, 由春季到夏季再到秋季呈现先增高再下降的趋势, 最低值出现在秋季, 10月和11月的碳含量值均维持在1000μgC/m3以下。最高值出现在夏季, 其中8月份碳含量的平均值最高, 达到(4.62±11.79)×104μgC/m3。碳含量的季节变化趋势与传统丰度表征的变化趋势大体一致(图 4), 春季和秋季的丰度也均处于较低水平, 各站位平均丰度值在4月、10月和11月份均在100× 104cell/m3及以下; 夏季的丰度值远远高于其它季节, 其中8月份平均丰度达到最高值, 为(20 433.3±69 466.1)×104cell/m3。
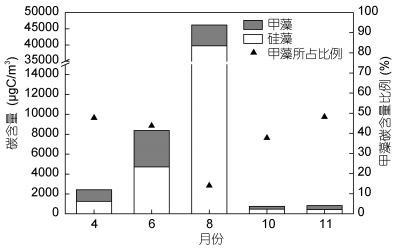 |
| 图 3 南黄海各月份浮游植物碳含量及甲藻所占比例 Fig. 3 The carbon biomass of phytoplankton and the proportion of dinoflagellates during different months in the South Yellow Sea |
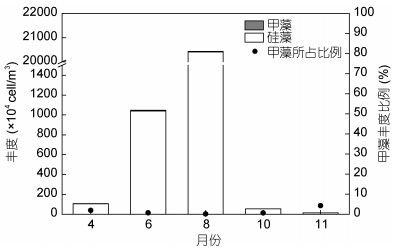 |
| 图 4 南黄海各月份浮游植物丰度及甲藻所占比例 Fig. 4 The abundance of phytoplankton and the proportion of dinoflagellates in different months in the South Yellow Sea |
硅藻与甲藻碳含量的季节变化均与总碳含量的变化趋势一致, 呈现夏季 > 春季 > 秋季的特点。硅、甲藻碳含量的最大值出现在夏季8月份, 平均值分别为(3.97±10.60)×104μgC/m3和(0.65±1.40)×104μgC/m3。相应地, 硅藻与甲藻在8月份的平均丰度值均为最大。
碳含量和丰度所反映出的浮游植物现存量在季节的变化趋势上是大体一致的, 但两种方法所反映的硅、甲藻在各月份的贡献率却存在明显差异。从甲藻在群体中的组成比例上可以看出, 甲藻碳含量对总碳含量具有明显的贡献(图 3), 调查中获得的甲藻碳含量的比例最大值出现在春季4月份和秋季11月份, 约为48%, 与硅藻的碳含量相当; 8月份甲藻碳含量的比例最低, 为14.05%。然而, 在丰度方面, 甲藻对整体的贡献作用不明显(图 4), 甲藻所占比例在各个月份均低于5%。在浮游植物大量存在的8月份, 甲藻丰度在总丰度中的比例仅为0.10%。以碳含量和以丰度衡量甲藻在群落中的比重具有明显的差异, 这一方面是由于硅藻细胞具有较大的液泡, 其碳密度被认为低于同体积的其它浮游植物类群(Strathmann, 1967), 同体积的硅藻体内各组分(叶绿素a、蛋白质、糖类及脂肪)均小于甲藻(Hitchcock, 1982); 另一方面, 网采样品中的小型链状及以群体形态存在的小型硅藻往往在该海域占优势, 其对丰度的贡献明显大于对碳含量的贡献, 而网采样品中小个体甲藻缺失, 个体相对较大的角藻属(Ceratium, 依据Gómez(2013), 也作Tripos)对甲藻的生物量具有明显贡献。以4月份的数据为例, 骨条藻属和角毛藻属在群落中所占的丰度比例分别为12.63%、6.29%, 其碳含量比例均低于1%;角藻属在群落中所占的丰度比例约为1.86%, 而其碳含量比例超过45%。由此表明, 以碳含量和以丰度表征的甲藻生物量在浮游植物总生物量中的地位是不同的, 以往从丰度角度研究浮游植物群落结构可能较大地低估了甲藻生物量在总生物量中的比重。
2.3 硅甲藻的相对含量的时空变化整体上看, 甲藻在浮游植物中所占比例的季节变化特点为夏季8月最低, 初春和秋末较高(图 3, 4)。本文选取了各采样断面的1号站位(近岸站位)与0号站位(外海站位)比较分析南黄海甲藻的相对含量在空间和时间的分布特点(图 5)。由时间看, 春季甲藻在南黄海中部B、C断面的近岸站位比例最高, 碳含量贡献达到97.67%。外海站位由硅藻占绝对优势, 甲藻在外海站位及南部海域站位贡献极低。夏季, 6月份甲藻在中部断面的贡献较大, 8月份在北部的贡献最大, 由北向南比例下降, F断面由于硅藻的大量存在, 甲藻贡献不明显。此外, 近岸站位与外海站位的差别不明显。秋季, 近岸站位的甲藻碳含量比例均呈由北向南逐渐降低的趋势。
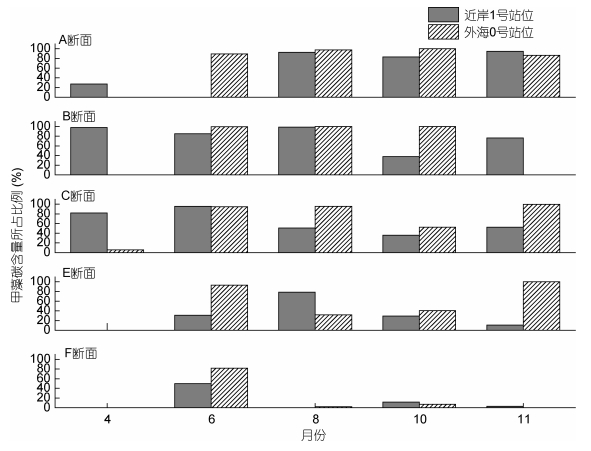 |
| 图 5 各断面不同月份近岸1号站位与外海0号站位甲藻碳含量所占比例 Fig. 5 The carbon biomass proportion of dinoflagellates of Stations 1 and 0 in each section in different months 注: 11月份B0站位未检出浮游植物 |
甲藻在南黄海海域对碳含量具有明显的贡献。各个断面均出现甲藻贡献高于硅藻的月份。相比之下, 纬度较低的E、F断面甲藻的比重明显较低, 在F断面, 仅在夏初6月份甲藻比例超过50%, 其它月份均维持在15%以下。这是由于6月份该区域大量存在的小个体的伪菱形藻属(Pseudonitzschia)、骨条藻属(Skeletonema)和角毛藻属(Chaetoceros)弱化了硅藻碳含量的比重, 使得甲藻中的原多甲藻属(Protoperidinium)和角藻属在碳含量上的贡献突显出来。
2.4 优势种属的组成及季节变化南黄海浮游植物各月份的优势种属及其优势度如表 1所示。圆筛藻属(Coscinodiscus)和角藻属在各个调查月份均处于优势地位。根管藻属(Rhizosolenia)和双尾藻属(Ditylum)在春季和秋季占优势, 伪菱形藻属、骨条藻属和扁甲藻属(Pyrophacus)为夏季优势种属, 角毛藻属是夏、秋季的优势种属。几内亚藻属(Guinardia)仅在秋季为优势种属。
| 月份 | 优势种属 | 拉丁名 | 频率(%) | 平均碳含量(μgC/m3) | 碳优势度Yc |
| 4月 | 角藻属 | Ceratium1 | 63.64 | 1154.85±2882.76 | 0.309 |
| 圆筛藻属 | Coscinodiscus | 68.18 | 432.05±706.54 | 0.124 | |
| 双尾藻属 | Ditylum | 72.73 | 383.65±1253.91 | 0.117 | |
| 根管藻属 | Rhizosolenia | 72.73 | 223.44±559.48 | 0.068 | |
| 6月 | 角藻属 | Ceratium | 86.36 | 2956.37±5748.5 | 0.305 |
| 圆筛藻属 | Coscinodiscus | 90.91 | 1397.76±3927.18 | 0.152 | |
| 伪菱形藻属 | Pseudonitzschia | 40.91 | 1857.72±6914.73 | 0.091 | |
| 扁甲藻属 | Pyrophacus | 45.45 | 665.79±1615.71 | 0.036 | |
| 8月 | 角藻属 | Ceratium | 100 | 5502.93±14092.16 | 0.119 |
| 圆筛藻属 | Coscinodiscus | 59.09 | 3659±9493.72 | 0.047 | |
| 角毛藻属 | Chaetoceros | 90.91 | 1648.91±4512.53 | 0.032 | |
| 骨条藻属 | Skeletonema | 68.18 | 33154.49±98988.65 | 0.489 | |
| 10月 | 角藻属 | Ceratium | 90.91 | 265.28±506.26 | 0.318 |
| 圆筛藻属 | Coscinodiscus | 77.27 | 210.85±346.71 | 0.215 | |
| 双尾藻属 | Ditylum | 40.91 | 37.08±123.62 | 0.020 | |
| 角毛藻属 | Chaetoceros | 59.09 | 29.24±90.73 | 0.023 | |
| 几内亚藻属 | Guinardia | 27.27 | 78.5±271.49 | 0.028 | |
| 根管藻 | Rhizosolenia | 40.91 | 47.06±117.37 | 0.025 | |
| 11月 | 角藻属 | Ceratium | 81.82 | 339.82±634.74 | 0.335 |
| 圆筛藻属 | Coscinodiscus | 77.27 | 224.06±359.6 | 0.209 | |
| 角毛藻属 | Chaetoceros | 45.45 | 184.66±855.5 | 0.101 | |
| 注: 1依据Gómez(2013), 也作Tripos | |||||
夏季圆筛藻属的含碳量明显大于春季与秋季, 其中8月份含碳量平均值最高, 为(3.66±9.49)× 103μgC/m3, 春季略高于秋季, 各个月份圆筛藻属在站位间的出现频率均在60%以上。圆筛藻属与海水平均温度呈显著正相关(P < 0.01), 营养盐方面, 与硅酸盐和亚硝酸盐呈显著正相关(P < 0.05)。
角藻属在各个月份均有出现, 含碳量呈现夏季 > 春季 > 秋季的特点, 8月份平均碳含量为(5.50±14.09)× 103μgC/m3, 最大值区域出现在南部E、F断面, F2站位最高为6.61×104μgC/m3。角藻属在各站位的出现频率较高, 夏季达到100%, 春季最低, 为63.6%。角藻属以梭角藻(Ceratium fusus)、三角角藻(Ceratium tripos)及叉角藻(Ceratium furca)为主。与环境因子的相关性分析表明, 角藻属碳含量与海水的表层温度呈显著正相关(P < 0.05), 与海水表层盐度呈显著负相关(P < 0.01), 而与水柱平均温度、盐度的相关性不明显(P > 0.05), 表明梭角藻和叉角藻丰度高值区出现在海水的表层和次表层(Baek et al, 2008a)。与营养盐的相关性分析表明, 角藻属碳含量与硝酸盐、亚硝酸盐呈显著正相关(P < 0.05), 与磷酸盐呈显著负相关(P < 0.01)。梭角藻在春夏季的数目增长迅速, 与其适应于该时期相对高温低盐的海洋环境有关, 梭角藻对低营养环境, 尤其是对低磷环境具有较强的适应能力(Baek et al, 2007, 2008b)。
根管藻属和双尾藻属的碳含量均在春季较高, 在夏季的浮游植物群落中所占比重极低。其中, 根管藻属与磷酸盐呈显著的负相关关系(P < 0.01)。
伪菱形藻属和骨条藻属是南黄海夏季的优势种属, 其高值区分布在海域南部的E、F断面, 8月份F断面骨条藻属的平均碳含量和丰度分别为(1.82±1.80)× 105μgC/m3、(1.08±1.44)×109cell/m3, 而南黄海北部及中部鲜有出现。这两种藻为群体形态, 单个细胞个体较小, 当以丰度计数时, 其在群落中的优势度大大增加。伪菱形藻属与海水平均温度呈显著正相关(P < 0.01), 营养盐方面, 与亚硝酸盐呈显著正相关(P < 0.05)。骨条藻属与环境因子的相关性不明显。南黄海的伪菱形藻属以尖刺伪菱形藻(Pseudonitzschia pungens)为主, 在各种环境因子中, 温度是影响尖刺伪菱形藻丰度的重要因素(Lewis et al, 1993; Huang et al, 2009)。
与上述两种藻相反, 同样在夏季占优势的扁甲藻属, 在E、F断面未检出, 而在南黄海北部及中部有相对较高的生物量。扁甲藻属与环境因子的相关性不显著。
角毛藻属在各个月份均有出现, 碳含量呈现夏季 > 秋季 > 春季的特点, 夏季高值区为海域南部E、F断面, 秋季在各断面近岸站位的碳含量值较高。角毛藻属与温度呈显著正相关(P < 0.01), 营养盐方面与硝酸盐和亚硝酸盐呈显著正相关(P < 0.05)。
2.5 浮游植物与环境因子的关系对研究海域的浮游植物数据与温度、盐度因子进行Pearson相关性分析(表 2)。温度、盐度值均为各站位的水柱平均值。由分析结果可以看出, 在南黄海海域各调查月份, 温度和盐度均为影响浮游植物生物量的重要环境因素。春季, 根据4月份的相关性分析结果, 浮游植物总生物量与温度的相关关系不显著, 甲藻的碳含量与温度呈显著负相关; 夏季, 浮游植物与温度呈显著正相关, 硅藻、甲藻均受到温度的显著影响; 6月份, 浮游植物与盐度呈显著负相关。秋季, 浮游植物与温度呈显著正相关, 受到温度影响的类群主要为硅藻; 甲藻生物量与盐度呈显著负相关。由此, 温度是南黄海海域浮游植物生物量的重要影响因素, 且除了4月份不显著之外, 各个时期的甲藻比例均与温度呈显著负相关, 表明硅藻对该海域温度的升高具有更高的适应能力。
| 季节 | 参数 | 总碳含量 | 硅藻碳含量 | 甲藻碳含量 | 甲藻碳含量比例 | 总丰度 | 硅藻丰度 | 甲藻丰度 | 甲藻丰度比例 |
| 4月 | 温度 | –0.381 | –0.172 | –0.551* | –0.397 | –0.293 | –0.248 | –0.505 | –0.361 |
| 盐度 | –0.69** | –0.334 | –0.783** | –0.491 | –0.324 | –0.274 | –0.789** | –0.452 | |
| 6月 | 温度 | 0.737** | 0.792** | 0.569** | –0.845** | 0.875** | 0.831** | 0.621** | –0.607** |
| 盐度 | –0.536* | –0.620** | –0.540* | 0.587** | –0.470* | –0.445* | –0.609** | 0.201 | |
| 8月 | 温度 | 0.812** | 0.804** | 0.301 | –0.780** | 0.790** | 0.765** | 0.411 | –0.529* |
| 盐度 | –0.426* | –0.424* | –0.171 | 0.333 | –0.298 | –0.246 | –0.225 | –0.003 | |
| 10月 | 温度 | 0.741** | 0.846** | 0.414 | –0.688** | 0.783** | 0.813** | 0.556* | –0.830** |
| 盐度 | –0.384 | –0.346 | –0.577** | –0.022 | –0.396 | –0.426* | –0.458* | 0.27 | |
| 11月 | 温度 | 0.693** | 0.801** | 0.19 | –0.735** | 0.670** | 0.727** | 0.312 | –0.664** |
| 盐度 | –0.419 | –0.237 | –0.677** | –0.281 | –0.281 | –0.169 | –0.588** | –0.251 | |
| 注: **显著性水平为0.01, *显著性水平为0.05;温度、盐度值均为各站位的水柱平均值 | |||||||||
对研究海域的浮游植物数据与五项营养盐数据进行Pearson相关性分析(表 3), 结果表明不同季节浮游植物受营养盐的影响存在明显差异。春季, 甲藻的含碳量及丰度均与磷酸盐呈显著的负相关, 除此以外, 浮游植物与其它营养盐的相关性均不显著。夏季, 硅藻生物量与亚硝酸盐及硝酸盐的含量呈显著正相关关系, 甲藻生物量与铵盐、硝酸盐的含量呈显著正相关关系, 由此表明硅藻和甲藻对于溶解无机氮的利用具有一定的选择偏向性。硅藻生物量与硅酸盐的含量呈显著的正相关关系, 存在一定的硅限制; 相应地, 甲藻在群落中所占的比例与硅酸盐含量呈显著负相关, 表明环境中硅含量对夏季南黄海硅甲藻相对比例的大小具有重要影响。夏季生物因子与磷酸盐含量的相关性不显著, 表明该时期不存在明显的磷限制。夏季硅藻在浮游植物群落中占绝对优势, 因而浮游植物总生物量同环境因子的关系与硅藻一致。秋季, 硅藻、甲藻的生物量均与磷酸盐含量呈显著正相关关系, 海域存在磷限制。黄海海域的磷限制和硅限制是影响该海域浮游植物群落结构的重要原因(Lin et al, 2005)。
| 季节 | 环境参数 | 总碳含量 | 硅藻碳含量 | 甲藻碳含量 | 甲藻碳含量比例 | 总丰度 | 硅藻丰度 | 甲藻丰度 | 甲藻丰度比例 |
| 春季(4月) | 硅酸盐 | –0.294 | –0.249 | –0.287 | –0.106 | –0.235 | –0.223 | –0.313 | 0.009 |
| 磷酸盐 | –0.24 | 0.095 | –0.725** | –0.725 | –0.035 | 0.002 | –0.748** | –0.641* | |
| 亚硝酸盐 | –0.269 | –0.092 | –0.312 | –0.201 | –0.241 | –0.206 | –0.329 | –0.127 | |
| 铵盐 | 0.05 | 0.14 | 0.05 | 0.02 | –0.041 | –0.037 | 0.067 | –0.077 | |
| 硝酸盐 | –0.278 | –0.116 | –0.477 | –0.496 | –0.207 | –0.166 | –0.501 | –0.377 | |
| 夏季(8月) | 硅酸盐 | 0.518* | 0.479* | –0.229 | –0.483* | 0.575** | 0.594** | –0.108 | –0.545** |
| 磷酸盐 | 0.182 | 0.073 | –0.219 | –0.055 | 0.209 | 0.222 | –0.154 | –0.199 | |
| 亚硝酸盐 | 0.683** | 0.712** | 0.077 | –0.758** | 0.697** | 0.686** | 0.211 | –0.542** | |
| 铵盐 | 0.256 | 0.264 | 0.528* | –0.147 | 0.259 | 0.264 | 0.567** | –0.191 | |
| 硝酸盐 | 0.663** | 0.537* | 0.462* | –0.511* | 0.595** | 0.554** | 0.566** | –0.27 | |
| 秋季(10月) | 硅酸盐 | 0.078 | 0.175 | –0.209 | –0.427* | 0.173 | 0.155 | –0.26 | –0.137 |
| 磷酸盐 | 0.445* | 0.449* | 0.491* | –0.142 | 0.43* | 0.447* | 0.504* | –0.229 | |
| 亚硝酸盐 | –0.133 | –0.185 | 0.05 | 0.051 | –0.113 | –0.034 | 0.059 | 0.059 | |
| 铵盐 | 0.161 | –0.288 | –0.414 | –0.414 | 0.103 | 0.124 | –0.351 | –0.137 | |
| 硝酸盐 | –0.131 | –0.476* | –0.297 | –0.297 | –0.112 | –0.078 | –0.415 | 0.098 | |
| 注: **显著性水平为0.01, *显著性水平为0.05;各营养盐参数值均为各站位的水柱平均值 | |||||||||
由上, 浮游植物的多寡及分布受到温度、盐度及营养盐共同作用的影响。春季和秋季, 温度、盐度及磷酸盐的影响明显; 夏季, 浮游植物的含量最高, 这一时期受到温度、盐度及营养盐综合因素的影响。
3 结论南黄海浮游植物碳含量存在明显的季节变化特征, 春季和秋季浮游植物的空间分布纬度差异较小, 呈现由近岸到外海降低的特点; 夏季海域南部浮游植物大量分布, 显著高于南黄海北部及中部区域。浮游植物总碳含量在各季节差异较大, 最高值出现在夏季, 其中8月份碳含量的平均值为各月份最高, 最低值出现在秋季。
硅藻与甲藻碳含量的季节变化均与总碳含量的变化趋势一致。甲藻在浮游植物中所占比例在夏季最低, 在初春和秋末较高。甲藻碳含量的比重明显高于其丰度比重。空间分布上, 海域南部E、F断面甲藻的比重明显较低, 主要由硅藻占优势。
以碳含量为基础获得的浮游植物优势种属结果表明, 圆筛藻属和角藻属在各调查月份均为优势种属; 根管藻属和双尾藻属在春季和秋季均占优势地位; 伪菱形藻属、骨条藻属和扁甲藻属为夏季优势种属, 且扁甲藻属与前两者分布于不同海区; 角毛藻属是夏秋季的优势种属, 几内亚藻属仅在秋季为优势种属。
温度和盐度是南黄海海域浮游植物生物量的重要影响因素, 甲藻的比例与温度呈显著负相关, 表明硅藻对该海域温度的升高具有更高的适应能力。浮游植物与海水中营养盐的关系呈现不同的季节特点, 春季甲藻与磷酸盐的含量呈负相关关系; 夏季, 环境中硅含量对夏季南黄海硅甲藻相对比例具有重要影响, 且硅藻和甲藻对于溶解无机氮的利用具有一定的选择偏向性。秋季, 南黄海海域存在一定的磷限制。
致谢 本文中的营养盐数据由中国海洋大学于志刚教授提供, CTD数据由天津大学魏皓教授以及2011年中国科学院海洋研究所中国近海海洋科学考察开放共享航次提供, 谨致谢忱。同时感谢中国科学院海洋研究所浮游动物研究组的老师们以及黄海水产研究所“北斗”号考察船的工作人员在样品采集过程中的大力协助。| 马威, 2012.南海北部浮游植物群落的生态学研究.青岛:中国海洋大学硕士学位论文, 1-85 |
| 王俊, 2003. 黄海秋、冬季浮游植物的调查研究. 海洋水产研究, 24 (1) : 15–23 |
| 朱根海, 宁修仁, 蔡昱明, 等, 2003. 南海浮游植物种类组成和丰度分布的研究. 海洋学报, 25 (S2) : 8–23 |
| 刘述锡, 樊景凤, 王真良, 2013. 北黄海浮游植物群落季节变化. 生态环境学报, 22 (7) : 1173–1181 |
| 刘海娇, 傅文诚, 孙军, 2015. 2009-2011年东海陆架海域网采浮游植物群落的季节变化. 海洋学报, 37 (10) : 106–122 |
| 孙军, 刘东艳, 钱树本, 2000. 浮游植物生物量研究Ⅱ. 胶州湾网采浮游植物细胞体积转换生物量. 海洋学报, 22 (1) : 102–109 |
| 赵其彪, 孙军, 李丹, 等, 2015. 东海低氧区及邻近水域浮游植物的季节变化. 生态学报, 35 (7) : 2366–2379 |
| ÁlvarezE, López-UrrutiaÁ, NogueiraE, 等, 2011. How to effectively sample the plankton size spectrum? A case study using FlowCAM. Journal of Plankton Research, 33 (7) : 1119–1133 |
| Baek S H, Shimode S, Han M S, et al, 2008a. Growth of dinoflagellates, Ceratium furca and Ceratium fusus in Sagami Bay, Japan: the role of nutrients. Harmful algae, 7 (6) : 729–739 DOI:10.1016/j.hal.2008.02.007 |
| Baek S H, Shimode S, Han M S, et al, 2008b. Population development of the dinoflagellates Ceratium furca and Ceratium fusus during spring and early summer in Iwa harbor, Sagami Bay, Japan. Ocean Science Journal, 43 (1) : 49–59 DOI:10.1007/BF03022431 |
| Baek S H, Shimode S, Kikuchi T, 2007. Reproductive ecology of the dominant dinoflagellate, Ceratium fusus, in coastal area of Sagami Bay, Japan. Journal of Oceanography, 63 (1) : 35–45 DOI:10.1007/s10872-007-0004-y |
| Eppley R W, Reid F M H, Strickland J D H, 1970. Estimates of phytoplankton crop size, growth rate, and primary production. In: Strickland J D H ed. The Ecology of the Plankton off La Jolla, California, in the Period April through September, 1967. California: Scripps Institution of Oceanography, 33-42 |
| Gao Y, Jiang Z B, Liu J J, et al, 2013. Seasonal variations of net-phytoplankton community structure in the Southern Yellow Sea. Journal of Ocean University of China, 12 (4) : 557–567 DOI:10.1007/s11802-013-2258-x |
| Gómez F, 2013. Reinstatement of the dinoflagellate genus Tripos to replace Neoceratium, marine species of Ceratium(Dinophyceae, Alveolata). CICIMAR Oceánides, 28 (1) : 1–22 |
| Hitchcock G L, 1982. A comparative study of the size-dependent organic composition of marine diatoms and dinoflagellates. Journal of Plankton Research, 4 (2) : 363–377 DOI:10.1093/plankt/4.2.363 |
| Huang C J, Lin X P, Lin J D, et al, 2009. Population dynamics of Pseudo-nitzschia pungens in Zhelin Bay, China. Journal of the Marine Biological Association of the United Kingdom, 89 (4) : 663–668 DOI:10.1017/S0025315408002919 |
| Irwin A J, Finkel Z V, Schofield O M E, et al, 2006. Scaling-up from nutrient physiology to the size-structure of phytoplankton communities. Journal of Plankton Research, 28 (5) : 459–471 DOI:10.1093/plankt/fbi148 |
| Lewis N I, Bates S S, McLachlan J L et al, 1993. Temperature effects on growth, domoic acid production, and morphology of the diatom Nitzschia pungens f. multiseries. In: Smayda T J, Shimizu Y eds. Toxic Phytoplankton Blooms in the Sea. Chicago: The University of Chicago Press, 601-606 |
| Lin C, Ning X, Su J, et al, 2005. Environmental changes and the responses of the ecosystems of the Yellow Sea during 1976-2000. Journal of Marine Systems, 55 (3-4) : 223–234 DOI:10.1016/j.jmarsys.2004.08.001 |
| Mullin M M, Sloan P R, Eppley R W, 1966. Relationship between carbon content, cell volume, and area in phytoplankton. Limnology and Oceanography, 11 (2) : 307–311 DOI:10.4319/lo.1966.11.2.0307 |
| Nuccio C, Melillo C, Massi L, et al, 2003. Phytoplankton abundance, community structure and diversity in the eutrophicated Orbetello lagoon (Tuscany) from 1995 to 2001. Oceanologica Acta, 26 (1) : 15–25 DOI:10.1016/S0399-1784(02)00007-5 |
| Poulton N J, 2016. FlowCam: quantification and classification of phytoplankton by imaging flow cytometry. In: Barteneva N S, Vorobjev I A eds. Imaging Flow Cytometry: Methods and Protocols. New York: Springer, 237-247 |
| Strathmann R R, 1967. Estimating the organic carbon content of phytoplankton from cell volume or plasma volume. Limnology and Oceanography, 12 (3) : 411–418 DOI:10.4319/lo.1967.12.3.0411 |
| Sun J, Liu D Y, Qian S B, 2000. Estimating biomass of phytoplankton in the Jiaozhou Bay I. Phytoplankton biomass estimated from cell volume and plasma volume. Acta Oceanologica Sinica, 19 (2) : 97–110 |
| Verity P G, Robertson C Y, Tronzo C R, et al, 1992. Relationships between cell volume and the carbon and nitrogen content of marine photosynthetic nanoplankton. Limnology and Oceanography, 37 (7) : 1434–1446 DOI:10.4319/lo.1992.37.7.1434 |
| Yang Y, Sun X X, Zhu M L et al, 2016. Estimating the carbon biomass of marine net phytoplankton from abundance based on samples from China seas. Marine and Freshwater Research, http://dx.doi.org/10.1071/MF15928 |
 2016, Vol. 47
2016, Vol. 47


