中国海洋湖沼学会主办。
文章信息
- 柳飞, 李健, 李吉涛, 葛倩倩, 连春盎, 常志强. 2016.
- LIU Fei, LI Jian, LI Ji-Tao, GE Qian-Qian, LIAN Chun-Ang, CHANG Zhi-Qiang. 2016.
- 脊尾白虾(Exopalaemon carinicauda)维甲酸X受体基因克隆及其在温盐胁迫和蜕皮周期中的表达分析
- CLONING AND EXPRESSION OF RETIONID X RECEPTOR UNDER TEMPERATURE AND SALINITY STRESSES AND MOLTING CYCLES IN EXOPALAEMON CARINICAUDA
- 海洋与湖沼, 47(4): 828-837
- Oceanologia et Limnologia Sinica, 47(4): 828-837.
- http://dx.doi.org/10.11693/hyhz20160300065
-
文章历史
- 收稿日期:2016-03-22
- 改回日期:2016-05-19
2. 上海海洋大学水产与生命学院 上海 201306;
3. 青岛海洋科学与技术国家实验室 海洋渔业科学与食物产出过程功能实验室 青岛 266235
2. College of Fisheries and Life Sciences, Shanghai Ocean University, Shanghai 201306, China;
3. Function Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266235, China
脊尾白虾(Exopalaemon carinicauda)又名白虾、迎春虾等,属于十足目(Decapoda),长臂虾科(Palaemon),白虾属(Exopalaemon),系热温带海水底栖虾类(刘瑞玉,1955),在我国沿海均有分布,尤以黄、渤海产量最高(李新正等,2003)。近年来,随着中国对虾(Fenneropenaeus chinensis)、日本囊对虾(Marsupenaeus japonicus)等传统虾类养殖难度的日益加大,以及沿海滩涂养殖的不断扩大,脊尾白虾以其生长速度快、繁殖能力强等特点,已成为重要的海水经济养殖品种(张振华等,2002; 王兴强等,2005)。蜕皮贯穿着水生甲壳类的整个生活史,与其生长、发育、繁殖和附肢再生等密切相关,水生甲壳类蜕皮发生影响关键因素及其调控机制一直是人们研究的重点(李旭光等,2014)。影响甲壳动物蜕皮发生的因素有很多,一方面受内源因子(蜕皮激素、蜕皮激素受体与维甲类X受体等)调控,另一方面受外源因子(温度、盐度、钙离子等)影响(Buchholz et al,2010)。
维甲酸X受体(retinoid X receptor,RXR)属于核受体超家族成员,是一种重要的调控因子,对甲壳动物生长、发育和繁殖具有十分重要的作用(卜文等,1994)。RXR基因发挥作用一般是与蜕皮激素核受体(ecdysone receptor,ECR)形成RXR-ECR二聚体,共同调控下游基因(E74,E75)的转录,从而对生长和蜕皮过程进行调节(Riddiford et al,2003; Kim et al,2005; Techa et al,2013)。RXR在结构上一般可分为A—F六个区,形成四个独立的功能区。其中以C区和E区最为保守。A/B区为转录激活结构域,该结构域保守性较低; C区为DNA结合区(DBD),含两个锌指结构; E/F区则含配体结合区(LBD); D区作为铰链连接DBD和LBD(Durica et al,2002; Devarakonda et al,2003)。Asazuma等(2007)在对日本囊对虾的研究中发现,蜕皮激素受体EcR在Y器官中的表达量显著高于其它组织,而RXR是通过与EcR形成二聚体共同调节甲壳动物的生长和蜕皮过程,所以说明RXR基因参与了蜕皮的调控过程。在罗氏沼虾的研究中发现,RXR基因的DNA结合区与昆虫的RXR基因的DNA结合区相似度极高,表明了RXR基因较高的保守性(Asazuma et al,2007)。王伟等(2014)在对三疣梭子蟹(Portunus trituberculatus)RXR基因研究中表明,RXR基因在各组织中均有所表达,在Y器官和眼柄中表达量较高; 在不同的蜕皮阶段各组织的表达规律有所差异,表明了RXR对蜕皮发生具有一定的调控作用。
近年来,随着脊尾白虾养殖规模的不断发展,脊尾白虾的养殖和繁殖技术日渐成熟。梁俊平等(2012)对脊尾白虾全人工繁育技术进行了相关研究,明确了幼体孵化、培育的适宜温度和盐度范围。栗治国(2013)对脊尾白虾繁殖生物学、胚胎发育、幼体发育及主要环境因子对其早期发育的影响进行了研究,并在此基础上开展了脊尾白虾工厂化育苗技术研究。但对于脊尾白虾蜕皮机理的研究较少,脊尾白虾RXR基因在其蜕皮过程中的作用尚不清楚。本文通过RACE技术克隆脊尾白虾RXR基因cDNA全长,利用实时定量PCR分析该基因在脊尾白虾各组织中的表达分布及在蜕皮周期中的表达规律,研究其在温度和盐度胁迫后鳃和肝胰腺组织中的表达模式,研究结果将为脊尾白虾RXR基因的功能及蜕皮调控机制提供基础信息。
1 材料与方法 1.1 实验材料实验脊尾白虾由日照海辰水产有限公司提供,挑选活力较好,个体较一致的脊尾白虾作为试验用虾。平均体长为(3.5 ± 0.3)cm。
试验在200L的白色PVC水族箱内进行,试验水体为100L,每天投喂基础饲料早晚各一次,沙滤自然海水,水温(16 ± 0.5)°C,每天保持充气,盐度为29,pH 8.1。每天吸污并换水,暂养7天后开始正式实验。
1.2 实验方法 1.2.1 温度、盐度梯度的设置每个梯度设3个重复组,每个重复放置36尾虾并设置对照组,连续充气增氧,实验期间不投饵。温度胁迫实验的海水盐度为29并以16°C为对照组; 盐度胁迫实验水温设为16°C并以29的盐度作为对照组(实验梯度设置如表 1所示)。
| 分组 | 温度胁迫组 | 盐度胁迫组 |
| 1 | 11°C | 11 |
| 2 | 16°C | 20 |
| 3 | 21°C | 29 |
| 4 | 26°C | 38 |
在温度、盐度胁迫后0、3、6、12、24、48、72h分别从每个实验组取4尾虾。血淋巴的采集: 0.5mL预冷的抗凝剂(4°C)与0.5mL血淋巴,配置成抗凝血,(4°C,3000r/min)10min,离心后去掉上清液,向离心管中加入1mL Trizol(使用方法按照Invitrogen说明书操作)置于-80 °C超低温冰箱保存。鳃、肝胰腺、胃、肠、肌肉、眼柄6种组织分别用液氮研磨,天平称取0.05g样品后加入含有1mL Trizol的1.5mL离心管中,震荡混匀后放入-80°C冰箱中保存用于后续总RNA的提取。
1.2.3 引物设计脊尾白虾RXR基因cDNA片段的克隆参照GenBank上公布的RXR基因序列: 中国对虾(F. chinensis)(FJ194479)、日本沼虾(Macrobrachium nipponense)(KC460323)、日本囊对虾(M. japonicas)(AB295493)、美洲龙虾(Homarus americanus)(KC409355)、招潮蟹(Celuca pugilator)(AF032983),用DNAMAN软件进行序列对比,在保守度较高的区域设计兼并引物RXR-F、RXR-R(如表 2所示),实验所用引物均由生工生物工程(上海)股份有限公司负责合成。
| 引物类型 | 引物名称 | 引物序列(5'—3') |
| 兼并引物 | RXR-F | TATGGMGTSTACAGYTGTG |
| 兼并引物 | RXR-R | TGTCTGTCDGCWGCYTGGCA |
| 5′特异引物 | RXR 5′race | GTTCCTCCTCTATTCCCCCTACCTG |
| 3′特异引物 | RXR 3′race | ATAGAGGAGGAACGCCAACGAACGA |
| 荧光定量引物 | RTRXR-F | GGAACGCCAACGAACGAAAG |
| 荧光定量引物 | RTRXR-R | CCTTTCGTTCGTTGGCGTTC |
| 荧光定量内参引物 | 18S-F | TATACGCTAGTGGAGCTGGAA |
| 荧光定量内参引物 | 18S-R | GGGGAGGTAGTGACGAAAAAT |
| 通用引物 | M13-F | CGCCAGGGTTTTCCCAGTCACGAC |
| 通用引物 | M13-R | AGCGGATAACAATTTCACACAGG |
取出超低温冰箱中保存的样品,并按照Trizol试剂说明书提取总RNA,用核酸定量仪(Thermo Scientific)检测RNA的产量与纯度,使用1.5%琼脂糖凝胶检测RNA的完整性。按照M-MLV Promega说明书进行RNA反转录,合成cDNA第一链。中间片段扩增反应体系如下(10mL): 无菌水6.85mL,cDNA 0.5mL(肝胰腺),10×PCR buffer 1mL,dNTP Mixture 0.8mL,proPOF 0.4mL,proPOR 0.4mL,Taq DNA聚合酶0.05mL。PCR反应程序参照本实验室通用程序进行 (王芸等,2011; 李洋等,2014),引物退火温度经过预实验优化为50°C。琼脂糖凝胶电泳验证扩增结果以及片段大小,使用DNA胶回收试剂盒(上海生工)进行胶回收与纯化,纯化产物与pMD18-T载体进行连接,重组质粒转化至Top10感受态细胞,经过夜培养后挑选阳性克隆,经PCR验证后由南京金斯瑞生物科技有限公司进行测序。
1.2.5 EcRXR基因的3'RACE和5'RACE扩增按照Clontech公司的SMAR-TTM-RACE cDNA试剂盒的使用说明,合成用于3'、5' RACE扩增的cDNA; 以测序所得EcRXR基因中间片段为模板设计3'和5' RACE所需引物(见表 1),以鳃和肝胰腺的混合RNA为模板,按照SMARTTMRACE试剂盒说明的反应条件与体系进行3'和5'RACE扩增。扩增产物测序等按中间片段步骤进行。
1.2.6 序列分析采用DNAStar对测序结果进行载体序列的去除和目的序列的拼接; 采用Blast程序分析EcRXR基因与其它物种RXR基因的同源性和一致性; 利用DNAMAN进行开放阅读框的预测和蛋白质的翻译,利用SMART和Interpro Scan软件进行蛋白质功能域及结构域的预测与分析,分别用DNAMAN和MEGA进行多重序列比对和系统进化树构建。
1.2.7 蜕皮周期实验实验用脊尾白虾暂养一周后,挑选肢体健全、活力较好的个体用,用解剖剪剪取尾节末端,腹面向上置于加有清水的干净载玻片上,用Nikon(ECLIPSE Ti-U)倒置显微镜进行观察。根据脊尾白虾尾节刚毛基质、刚毛腔、刚毛圆锥、上皮细胞的变化将蜕皮过程进行分期(都威等,1997; 王战芳,2014)。分别在蜕皮前期(D期,各亚期持续时间较短以典型特征的D2亚期)、蜕皮后期(AB期)、蜕皮间期(C期)进行取样,将取好的鳃、肝胰腺、胃、肠、表皮、眼柄放入液氮保存待用。
1.2.8 实时荧光定量PCR(qRT-PCR)首先将cDNA模板梯度稀释进行标准曲线扩增,确定最佳反应体系及反应条件。按照SYBR® Premix Ex TaqTM Ⅱ(TaKaRa)试剂盒说明书进行操作,反应体系如表 3所示。以各实验组脊尾白虾组织总RNA为模板,合成cDNA。将样品在混匀后加入96孔PCR(Axygen)板中,瞬时离心后放入荧光定量PCR仪(ABI 7500)中进行PCR扩增,反应程序为: 95°C预变性30s; 循环条件为95°C 5s,60°C 34s,共40个循环; 熔解曲线条件为95°C 15s,60°C 1min,95°C 15s,60°C 15s。内参基因采用脊尾白虾18S rRNA,引物序列如表 2所示(段亚飞等,2013),每个样品及内参基因进行三个重复,反应完成后,采用Real-time PCR(SYBR Green)2−DDCt相对定量方法进行计算。
| 试剂 | EcRXR | 18S rRNA |
| SYBR® Premix Ex TaqTM II(2×) | 10 | 10 |
| Rox reference Dye II(50×) | 0.4 | 0.4 |
| 正向引物(10mmol/L) | 0.8 | 0.8 |
| 反向引物(10mmol/L) | 0.8 | 0.8 |
| cDNA | 1 | 1 |
| ddH2O | 7 | 7 |
| 总体积 | 20 | 20 |
实验数据均为3个重复的平均值±标准差以(x ± SD)表示,采用SPSS17.0进行单因子方差分析,并进行Duncan氏多重比较,当P<0.05时表示差异显著。
2 结果与分析 2.1 EcRXR cDNA全长克隆及序列分析以脊尾白虾鳃、肝胰腺组织的总RNA混合物为模板,反转录得到3'RACE和5'RACE的cDNA第一链,RACE克隆后得到710bp和626bp的两段cDNA序列。将两个序列与中间片段进行拼接,得到脊尾白虾RXR基因cDNA全长序列,命名为EcRXR,GenBank登录号: KU647675。该基因cDNA序列全长为1323bp,其中,开放阅读框(ORF)855bp,5'端非编码区(5'-UTR)37bp,3'非编码区(3'-UTR)433bp。对EcRXR基因分析可知,其编码一个由284个氨基酸组成的蛋白质,分子量为30.918kDa,理论等电点为pI为6.79。通过软件进一步分析表明,该蛋白不存在信号肽序列和跨膜结构区,说明该基因编码的蛋白不属于分泌蛋白。经BLASTn、BLASTx以及多序列比对表明,此氨基酸序列与日本沼虾(M. nipponense)、褐虾(Crangon crangon)与美洲鳌龙虾(H. americanus)等的氨基酸序列具有很高的同源性,可进一步确定此序列为脊尾白虾RXR序列。EcRXR基因从N端到C端具有4个典型的结构功能域: A/B域(转录激活域)、C域(DNA结合域,DBD)、D域(铰链域)、E/F域(配体结合域,LBD),与三疣梭子蟹(王伟等,2014)和中华绒螯蟹(王瑶等,2013)RXR基因具有相同的结构域。C域中存在P-box和D-box,D域中存在T-box(如图 1所示)。通过与氨基酸序列比对发现,维甲酸X受体基因的特定结构域在几个物种中都存在,脊尾白虾E/F域较其它物种有部分序列缺失(图 2)。
 |
| 图 1 EcRXR基因cDNA全长及预测的氨基酸序列 Fig. 1 Full cDNA sequence and its deduced amino acid sequence of EcRXR |
 |
| 图 2 脊尾白虾与其它甲壳动物的RXR氨基酸序列比对 Fig. 2 Comparison of amino acid sequences of RXR between E. carinicauda and other crustacean species |
脊尾白虾RXR氨基酸序列与日本沼虾(M. nipponense)、褐虾(C. crangon)与美洲鳌龙虾(H. americanus)一致性分别为90%、89%、83%,与凡纳滨对虾(Litopenaeus vannamei)、中国对虾(F. chinensis)和招潮蟹(C. pugilator)一致性分别为76%、75%和71%。利用MEGA 5.0软件进行系统进化分析表明,与甲壳动物的RXR聚为一支,其中脊尾白虾与日本沼虾单独聚为一支,表明其亲缘性最高(图 3)。
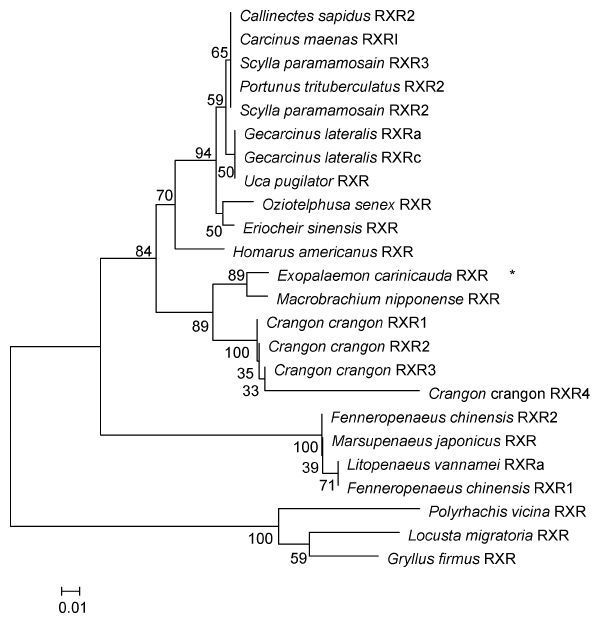 |
| 图 3 RXR氨基酸序列的NJ进化树 Fig. 3 The neighbor-joining phylogenetic tree for RXRs |
对脊尾白虾EcRXR基因在不同组织中的表达进行荧光定量PCR分析,可以得出: EcRXR基因在血淋巴、鳃、肝胰腺、胃、肠、肌肉、表皮、眼柄中均有表达。在眼柄中EcRXR基因的表达量最高,鳃、胃、肠、表皮的表达量次之,而在肝胰腺、肌肉、血淋巴表达量很低(如图 4所示)。
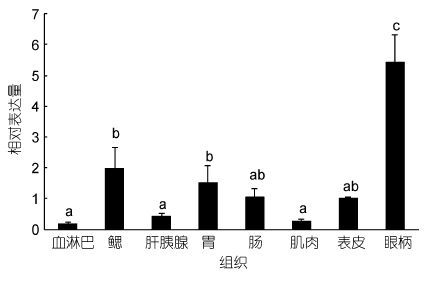 |
| 图 4 脊尾白虾RXR在各组织中的表达情况 Fig. 4 Relative expression of E. carinicauda RXR gene in different tissues |
根据EcRXR基因在各组织中的表达分布情况,选择鳃、肝胰腺、胃、肠、表皮和眼柄6个组织,研究EcRXR基因在不同蜕皮周期中的表达情况如图 5所示。研究结果表明,在不同的蜕皮阶段EcRXR基因在6种组织中的表达量差异显著(P<0.05)。在鳃中,间期的表达量最高,前期EcRXR基因的表达量出现显著下降,后期EcRXR基因的表达量出现显著上升(P<0.05)。在肝胰腺、胃、肠、眼柄中EcRXR基因的表达具有相似的变化规律,间期表达量最低,在前期表达量显著上升(P<0.05),后期表达量继续显著上升(P<0.05)。而在表皮中与上述三种组织中的表达情况正好相反,间期表达量最高,前期后期均显著下降(P<0.05)。
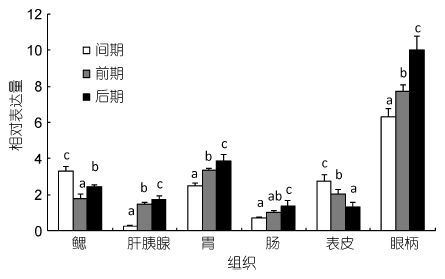 |
| 图 5 RXR在不同蜕皮时期脊尾白虾6个组织中的表达情况 Fig. 5 Relative expression of RXR in six tissues from E. carinicauda of different molting stages |
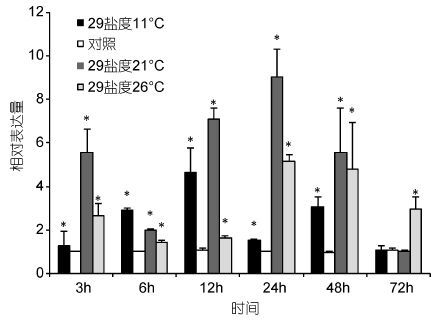
脊尾白虾温度胁迫后,鳃中EcRXR基因的相对表达量如图 6所示。与对照实验组相比较,在低温胁迫后,EcRXR基因表达量在3h时轻微上调,6h时有所下调,12h时达到最大值,相对表达量为对照组的2.32倍,24h时表达量显著降低达到最低值,72h逐渐恢复到对照组水平。21°C胁迫组,在3h时表达量显著降低,6—24h逐渐升高,到24h达到最大值,48h时显著降低,72h恢复至对照组水平。26°C高温胁迫组,在6h时表达量显著降低,12h显著升高达到最大值,24h降低到最低值48—72h相对表达量升高后又有所下降。
 |
| 图 6 温度胁迫下脊尾白虾鳃中RXR基因的表达情况 Fig. 6 Expression of RXR gene in E. carinicauda gill tissue under temperature stress |
温度胁迫后,脊尾白虾肝胰腺中EcRXR基因的相对表达量如图 7所示。与对照实验组相比较,在低温胁迫后,EcRXR基因表达量在3—12h时逐渐上升,12h时达到最大值,24h时表达量显著降低,48h显著上升,72h逐渐恢复到对照组水平。21°C胁迫组,在3h时显著升高,6h有所降低,到12—24h时显著升高,24h达到最高值,72h恢复至对照组水平。26°C高温胁迫组,在3h时表达量升高,6—12h表达量较低,24h达到最大值,48h后相对表达量逐渐降低,在72h时显著高于对照组。
 |
| 图 7 温度胁迫下脊尾白虾肝胰腺中RXR基因的表达情况 Fig. 7 Expression of RXR gene in E. carinicauda hepatopancreas tissue under temperature stress |
温度胁迫后,脊尾白虾鳃中EcRXR基因的相对表达量如图 8所示。与对照实验组相比较,11的低盐胁迫后,3—12h相对表达量逐渐升高,12h达到最大值,24—72h逐渐降低,72h时显著低于对照组。20的中低盐度胁迫后,3h时表达量上升,6—24h逐渐降低且保持在较低范围,48h显著升高,72h有所降低并显著高于对照组。38的高盐胁迫后,3h表达量升高,6—12h表达量上升,24—72h逐渐降低并显著低于对照组。
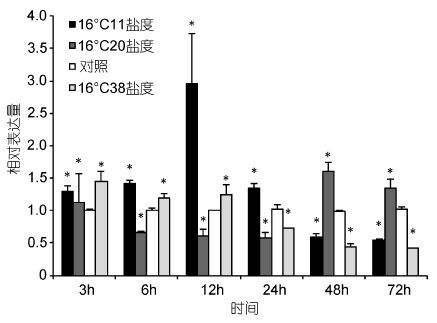 |
| 图 8 盐度胁迫下脊尾白虾鳃中RXR基因的表达情况 Fig. 8 Expression of RXR gene in E. carinicauda gill tissue under salinity stress |
温度胁迫后,脊尾白虾肝胰腺中的EcRXR基因相对表达量如图 9所示。与对照实验组相比较,11的盐度胁迫后,3h相对表达量升高,后逐渐降低,48h达到最低值,72h时恢复对照组水平。20的中低盐度胁迫后,3h时表达量上升,6h达到最高值,12—24h逐渐降低,24h达到最低值,48h显著升高,到72h恢复对照组水平。38的高盐胁迫后,3—12h表达量上升,12h达到最高值,24h降低到最低水平,48h上高后趋于稳定。
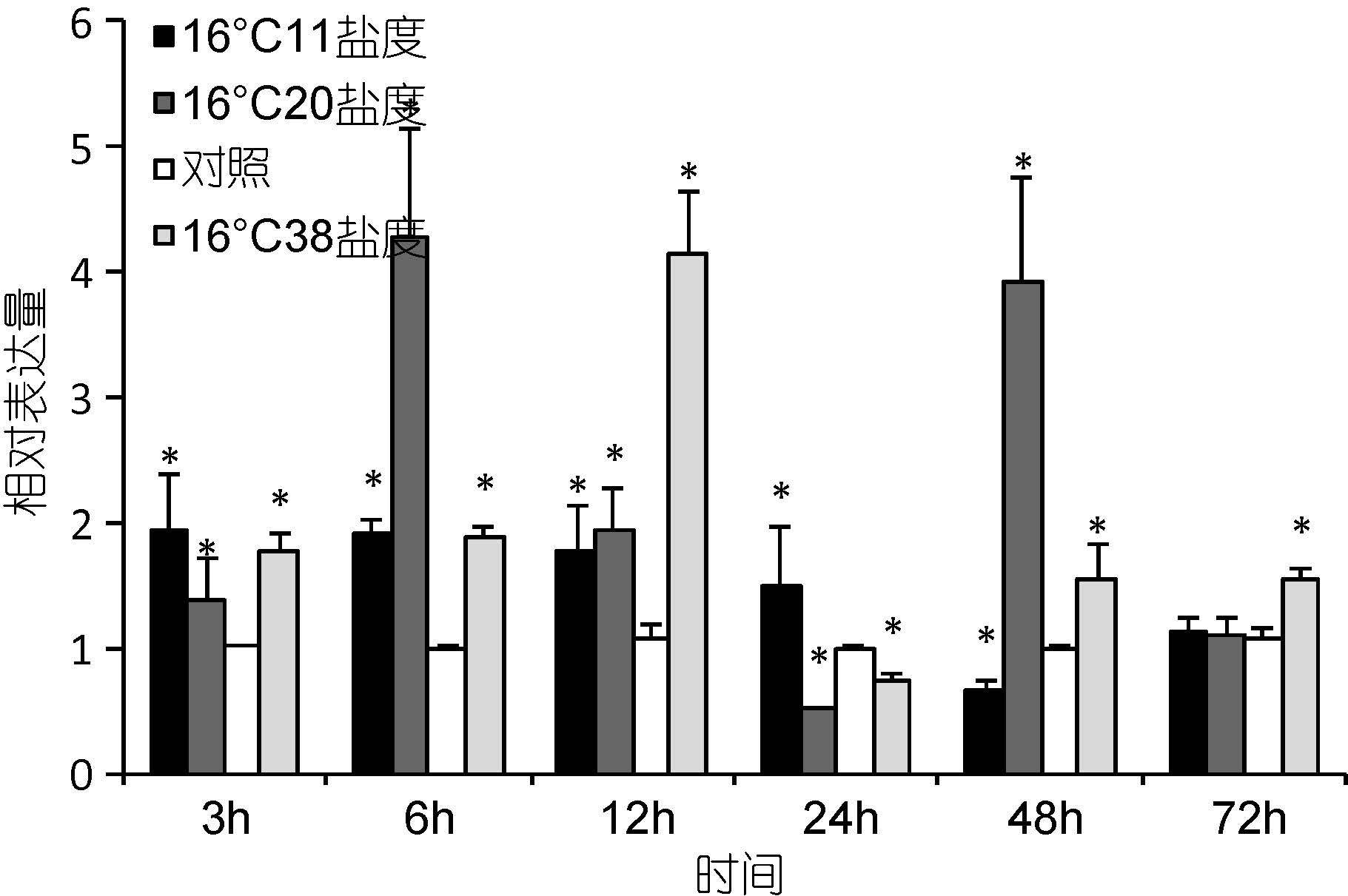 |
| 图 9 盐度胁迫下脊尾白虾肝胰腺中RXR基因的表达情况 Fig. 9 Expression of RXR gene in E. carinicauda hepatopancreas tissue under salinity stress |
维甲酸X受体是核受体家族中重要的一员,可与多种其它核受体如维甲酸受体(RAR)、甲状腺激素受体(TR)和维生素D受体(VDR)等形成二聚体作为转录因子,参与动物个体发育、代谢、细胞分化、细胞增殖以及细胞凋亡等众多生理学过程(卜文等,1994; 李维等,2013)。本研究克隆得到全长为1323bp的维甲酸X受体基因EcRXR。氨基酸序列比对结果表明EcRXR存在RXR基因的典型的结构域,可以确定为RXR基因。进化树分析表明其与甲壳动物聚为一支,日本沼虾单独聚为一支,表明本研究克隆得到的RXR基因确定为脊尾白虾RXR基因。
甲壳动物的蜕皮发生贯穿整个生命周期,与其生长、发育及繁殖息息相关,甲壳动物的蜕皮是由神经和内分泌间协调作用,以及外源因子的干扰作用等共同决定蜕皮周期的长短,影响生长发育。维甲酸X受体属于核受体超家族成员,是一种重要的内源调控因子,对甲壳动物的生长、繁殖起重要作用(Ahujaa et al,2003; Mark et al,2009)。甲壳类蜕皮激素的作用靶标是核受体家族成员蜕皮激素受体(ECR)和维甲酸X受体(RXR)组成,蜕皮激素受体与维甲酸X受体(ECR/RXR)位于甲壳类蜕皮周期过程中信号通路调控的上游端,是参与调控蜕皮过程的关键基因(Riddiford et al,2003; 李旭光等,2014)。目前为止,已对日本沼虾(M. nipponensis)(Asazuma et al,2007)、凡纳滨对虾(L. vannamei)(蒋丹,2010)、中华绒螯蟹(E. sinensis)(王瑶等,2013)、蓝蟹(C. sapidus)(Techa et al,2013)、三疣梭子蟹(P. trituberculatus)(王伟等,2014)等物种的维甲酸X受体基因已经有所研究,RXR基因在不同甲壳动物组织中的表达量有所差异,在各蜕皮周期中表达也有所差异。在对日本沼虾、日本囊对虾、陆地蟹等物种的研究中发现,RXR基因在性腺中具有较高的表达量,由此推测RXR基因不仅与蜕皮相关,还与性腺发育与繁殖相关(Durica et al,1996)。
实验组织荧光定量表达结果显示,EcRXR基因在血淋巴、鳃、肝胰腺、胃、肠、表皮、眼柄中均有表达,在眼柄中表达量最高,说明眼柄是该基因的主要调控器官。实验结果表明,眼柄中的EcRXR在后期表达量最高,间期表达量最低,表明眼柄中的内分泌细胞的增殖分化主要在后期(Chang et al,2011); 肝胰腺、胃、肠中,与间期相比,前期后期表达量逐渐上升,后期表达量最高,表明肝胰腺、胃、肠中细胞的增殖分化主要发生在蜕皮后期,肝胰腺间期表达量最低,也表明肝胰腺中的脂类营养代谢过程不是由EcRXR调控的。
温度是影响甲壳类蜕皮过程重要的环境因子。在适当的温度范围内,较高的温度能够提高体内酶的活性,加速代谢过程,促进蜕皮发生频率,促进生长发育。鳃和肝胰腺是虾蟹类的主要呼吸和代谢器官,温度能影响呼吸代谢相关的酶活性进而影响其生命活动(李旭光等,2014)。本实验通过设置不同的温度梯度,研究其对EcRXR基因在鳃和肝胰腺的表达的规律。研究结果表明,温度胁迫后鳃中EcRXR基因表达总体上呈现先降低后升高,再降低后升高至正常水平; 肝胰腺中EcRXR表达呈现先升高后降低,再升高后降低的变化趋势。鳃和肝胰腺在温度胁迫下EcRXR基因表达发生显著的调控过程,这说明EcRXR不仅参与了蜕皮过程也参与了脊尾白虾体内酶活性的调控作用,印证了维甲酸信号通路中关于酶活性的调控作用(Evans et al,1999)。
盐度是影响水生甲壳类的蜕皮发生的另一个关键影响因子,在一定范围内的盐度变化能够加速蜕皮过程的进行,盐度过低或过高,都会影响甲壳类的蜕皮周期时间与蜕皮频率(李旭光等,2014)。水生甲壳动物为了适应水中渗透压的变化,通过内分泌调控系统第二信使环状腺苷酸(cAMP)、蛋白激酶A(PKA)、钙调节蛋白(CaM)等激活Na+/K+泵和Cl-离子通道,对体内渗透压进行调控(Zanotto et al,2002)。鳃是水生甲壳动物呼吸的重要器官,能够对体内渗透压和离子平衡进行有效调节(韩晓琳等,2014),肝胰腺也参与了部分离子转运过程。本研究在不同盐度胁迫后发现,EcRXR基因表达呈现规律性变化。鳃中EcRXR总体呈现先升高在降低的变化趋势; 肝胰腺中EcRXR呈现先升高在降低后升高在降低到对照组水平。实验结果表明,EcRXR基因除了对脊尾白虾蜕皮过程起调控作用外,还参与了脊尾白虾体内渗透压的调控作用。
4 结论本实验通过设计引物,克隆了脊尾白虾EcRXR基因cDNA序列全长,分析了EcRXR基因在脊尾白虾组织和蜕皮周期的表达规律,并探究了在温度、盐度胁迫过程的中的表达模式。研究结果表明EcRXR基因在脊尾白虾蜕皮、酶活性调控、渗透压调节中都发挥了重要的作用,进一步推测EcRXR可能是温度、盐度影响脊尾白虾蜕皮的重要调控因子之一,为深入研究RXR在脊尾白虾和其它甲壳动物蜕皮机制中的功能提供了重要信息。
| 卜文, 欧阳仁荣. 1994. 维甲类X受体研究现状. 国外医学输血及血液学分册, 17 (1) : 11–13 |
| 王伟, 吴旭干, 楼宝, 等. 2014. 三疣梭子蟹(Portunus trituberculatus)RXR基因克隆及其在蜕皮过程中的表达分析. 海洋与湖沼, 45 (5) : 1105–1114 |
| 王芸, 李健, 李吉涛, 等. 2011. pH胁迫对中国明对虾抗氧化系统酶活力及基因表达的影响. 中国水产科学, 18 (3) : 556–564 |
| 王瑶, 杨志刚, 郭子好, 等. 2013. 中华绒螯蟹RXR基因全长cDNA克隆及表达分析. 水产学报, 37 (12) : 1761–1769 |
| 王兴强, 阎斌伦, 马甡, 等. 2005. 脊尾白虾生物学及养殖生态学研究进展. 齐鲁渔业, 22 (8) : 21–23 |
| 王战芳, 2014. 中华锯齿米虾繁殖及蜕皮特征的研究. 保定: 河北大学硕士学位论文 http://cdmd.cnki.com.cn/Article/CDMD-10075-1014039850.htm |
| 刘瑞玉. 1955. 中国北部的经济虾类. 北京: 科学出版社, |
| 李洋, 刘萍, 李健, 等. 2014. 脊尾白虾酚氧化酶原基因克隆及表达分析. 海洋与湖沼, 45 (2) : 299–306 |
| 李维, 王淑红, 王艺磊, 等. 2013. 软体动物维甲酸X受体研究进展. 动物学杂志, 48 (4) : 655–664 |
| 李旭光, 周刚, 谷孝鸿. 2014. 水生甲壳类蜕皮发生过程及其影响因素的研究与进展. 动物学杂志, 49 (2) : 294–302 |
| 李新正, 刘瑞玉, 梁象秋. 2003. 中国长臂虾总科的动物地理学特点. 生物多样性, 11 (5) : 393–406 |
| 张振华, 李国峰, 严少华. 2002. 沿海咸淡水滩塘脊尾白虾的养殖技术. 江苏农业科学, (1) : 62–65 |
| 段亚飞, 刘萍, 李吉涛, 等. 2013. 脊尾白虾(Exopalaemon carinicauda)组织蛋白酶D基因的克隆及其表达分析. 海洋与湖沼, 44 (3) : 599–605 |
| 都威, 姜秀凤. 1997. 中国对虾蜕皮与附肢刚毛发生关系的研究. 中国水产科学, 4 (3) : 30–32 |
| 栗治国, 2013. 脊尾白虾繁殖生物学及人工苗种繁育技术的研究. 青岛: 中国科学院研究生院硕士学位论文 http://cdmd.cnki.com.cn/article/cdmd-80068-1013299926.htm |
| 梁俊平, 李健, 刘萍, 等. 2012. 脊尾白虾生物学特性与人工繁育的研究进展. 中国农学通报, 28 (17) : 109–116 |
| 蒋 丹, 2010. 凡纳滨对虾EcR和RXR基因的克隆及功能分析. 广州: 华南师范大学硕士学位论文 http://www.docin.com/p-1049097769.html |
| 韩晓琳, 高保全, 王好锋, 等. 2014. 低盐胁迫对三疣梭子蟹鳃和肝胰腺显微结构及家系存活的影响. 渔业科学进展, 35 (1) : 104–110 |
| Ahujaa H S, Szanto A, Nagy L, et al. 2003. The retinoid X receptor and its ligands: versatile regulators of metabolic function, cell differentiation and cell death. Journal of Biological Regulators and Homeostatic Agents, 17 (1) : 29–45 |
| Asazuma H, Nagata S, Kono M, et al. 2007. Molecular cloning and expression analysis of ecdysone receptor and retinoid X receptor from the kuruma prawn, Marsupenaeus japonicus. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 148 (2) : 139–150 DOI:10.1016/j.cbpb.2007.05.002 |
| Buchholz F, Buchholz C, 2010. Growth and moulting in northern krill (Meganyctiphanes norvegica Sars). In: Tarling G A ed. Advances in Marine Biology-Biology of Northern Krill-57. Amsterdam: Elsevier, 173—197 |
| Chang E S, Mykles D L. 2011. Regulation of crustacean molting: a review and our perspectives. General and Comparative Endocrinology, 172 (3) : 323–330 DOI:10.1016/j.ygcen.2011.04.003 |
| Devarakonda S, Harp J M, Kim Y, et al. 2003. Structure of the heterodimeric ecdysone receptor DNA-binding complex. The EMBO Journal, 22 (21) : 5827–5840 DOI:10.1093/emboj/cdg569 |
| Durica D S, Hopkins P M. 1996. Expression of the genes encoding the ecdysteroid and retinoid receptors in regenerating limb tissues from the fiddler crab, Uca pugilator. Gene, 171 (2) : 237–241 DOI:10.1016/0378-1119(96)00047-9 |
| Durica D S, Wu X H, Anilkumar G, et al. 2002. Characterization of crab EcR and RXR homologs and expression during limb regeneration and oocyte maturation. Molecular and Cellular Endocrinology, 189 (1-2) : 59–76 DOI:10.1016/S0303-7207(01)00740-7 |
| Evans T R J, Kaye S B. 1999. Retinoids: present role and future potential. British Journal of Cancer, 80 (1-2) : 1–8 DOI:10.1038/sj.bjc.6690312 |
| Kim H W, Lee S G, Mykle D L. 2005. Ecdysteroid-responsive genes, RXR and E75, in the tropical land crab, Gecarcinus lateralis: differential tissue expression of multiple RXR isoforms generated at three alternative splicing sites in the hinge and ligand-binding domains. Molecular and Cellular Endocrinology, 242 (1-2) : 80–95 DOI:10.1016/j.mce.2005.08.001 |
| Mark M, Ghyselinck N B, Chambon P. 2009. Function of retinoic acid receptors during embryonic development. Nuclear Receptor Signaling, 7 : e002 |
| Riddiford L M, Hiruma K, Zhou X F, et al. 2003. Insights into the molecular basis of the hormonal control of molting and metamorphosis from Manduca sexta and Drosophila melanogaster. Insect Biochemistry and Molecular Biology, 33 (12) : 1327–1338 DOI:10.1016/j.ibmb.2003.06.001 |
| Techa S, Chung J S. 2013. Ecdysone and retinoid-X receptors of the blue crab, Callinectes sapidus: cloning and their expression patterns in eyestalks and Y-organs during the molt cycle. Gene, 527 (1) : 139–153 DOI:10.1016/j.gene.2013.05.035 |
| Zanotto F P, Wheatly M G. 2002. Calcium balance in crustaceans: nutritional aspects of physiological regulation. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 133 (3) : 645–660 |
 2016, Vol. 47
2016, Vol. 47


