中国海洋湖沼学会主办。
文章信息
- 渠佩佩, 杨晶晶, 徐轶肖, 高寒, 佟蒙蒙. 2016.
- QU Pei-Pei, YANG Jing-Jing, XU Yi-Xiao, GAO Han, TONG Meng-Meng. 2016.
- 固相吸附毒素跟踪技术(SPATT)在浙江南麂海域的应用
- APPLICATION OF SPATT FOR TOXIN DETECTION IN THE MUSSELS ALONG COAST OF NANJI ISLAND, EAST CHINA SEA
- 海洋与湖沼, 47(4): 795-803
- Oceanologia et Limnologia Sinica, 47(4): 795-803.
- http://dx.doi.org/10.11693/hyhz20160100007
-
文章历史
- 收稿日期:2016-01-11
- 改回日期:2016-03-21
2. 广西师范学院北部湾环境演变与资源利用教育部重点实验室 南宁 530001
2. Key Laboratory of Environment Change and Resources Use in Beibu Gulf, Guangxi Teachers Education University, Nanning 530001, China
浙江南麂海域地处台湾暖流与江浙沿岸流交汇区,生物种类繁多,是我国深海网箱养殖和近岸贝类重点养殖区,也是我国首批五个国家级海洋类自然保护区之一,1999年被联合国教科文组织列为世界生物圈保护区,素有“贝藻王国”和“蓝色牧场”的美誉。近年来,受鳌江等河流径流和江浙沿岸流的影响,该海域水体富营养化日益严重,成为赤潮及贝类中毒事件高发区(姚炜民等,2005),对消费者生命健康安全、水产养殖业、旅游业以及贝类产品出口等构成严重威胁(陈舜等,2009; 郑重莺等,2012)。2011年5月25日至31日,在福建宁德和浙江宁波两地发生了因误食染毒紫贻贝(Mytilus galloprovincialis)引起的中毒事件,中毒人数多达200人(Li et al,2012)。贝类毒素中毒事件的持续暴发,把贝类产品食用安全及毒素暴发的预警预报这一重大问题提上研究日程。因此,探寻快速有效的贝类毒素监测方法,建立贝类毒素事件的预警预报机制,刻不容缓。
“固相吸附毒素跟踪” 技术(solid phase adsorption toxin tracking,SPATT)是利用聚合吸附树脂来被动吸附海水中生物毒素的原位监测技术。这项技术由新西兰的研究团队(MacKenzie et al,2004)首先应用到海水中的脂溶性贝类毒素(lipophilic shellfish toxins,LSTs)监测中,取得了较好的成果。因此,本研究在对南麂岛海域LSTs毒素种类和含量的调查基础上,结合固相吸附毒素跟踪技术(SPATT),选用树脂DIAION® HP20为SPATT内填充物,对LSTs在该海域的分布特征进行了分析,以期为该海域贝类养殖区建立快速方便的脂溶性贝类毒素采集、监测以及行之有效的预警预报方案提供理论依据。
1 材料与方法 1.1 采样点部署及样品采集本研究在浙江南麂列岛海域贝类养殖区附近,设置两个采样点 N1和N2(图 1),分别布放/采集SPATT树脂盘(图 2)和采集厚壳贻贝。根据全年浮游生物生物量的变化及南麂岛海域贝类养殖和收割周期的特点,将全年采样分为三个阶段: 2014年4月至10月采样周期为10天,2014年11月至12月采样周期为30天,2015年1月至4月采样周期为15天。将SPATT树脂盘固定在贻贝养殖链距水面约两米的位置,采集SPATT树脂盘及其相同位置的贻贝,同时将新的SPATT树脂盘放入原采样点位置待下一次采集,采集到的贝肉及SPATT树脂盘放置于-20°C冷冻保存待后续处理。
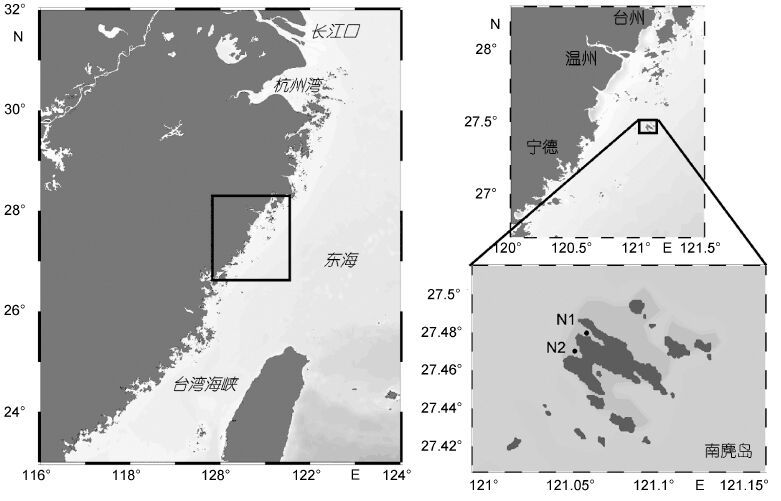 |
| 图 1 采样点(N1,N2)及SPATT树脂盘的布设 Fig. 1 Sampling sites(N1 and N2)for detection by SPATT discs |
贝肉中LSTs毒素的提取步骤参见GB17378.7-2007海洋监测规范第7部分: 近海污染生态调查和生物监测。本文稍作修改: 贝肉解冻后,称取100g匀浆,取2g加入9mL100%甲醇,振荡搅拌1min,离心(4000×g,5min),取上清液,重复该步骤。将两次的上清液转入30mL的全玻璃针筒中,经0.22μm一次性微孔过滤器过滤后,样品收集至25mL血清瓶中,氮吹浓缩,用100%甲醇定容至5mL,取1mL于色谱进样瓶中,于-80ºC冷冻,待LC-MS/MS分析。
1.2.2 贝肉样品的水解另取1mL上述萃取液,加入0.125mL 2.5mol/L的NaOH溶液,置于76ºC条件下恒温加热40min。然后取出,待该溶液温度降至室温后,再加入0.125mL 2.5mol/L的HCl溶液,经0.22μm一次性微孔过滤器过滤后,于-80ºC冷冻,待LC-MS/MS分析。
1.3 SPATT的吸附监测方法 1.3.1 SPATT树脂盘的制作与预处理SPATT树脂盘的制作方法参见Fux等(2008): 将筛绢裁剪成约23cmx12cm大小,将DIAION®HP20树脂(干重9.00g±0.05g)放入其中,再用绣花绷子(直径9cm)固定即可(图 2)。使用前树脂需活化处理: 将制作好的SPATT树脂盘放入100%甲醇中浸泡48h,然后经过MilliQ水冲洗、树脂盘置于MilliQ水中超声10min、MilliQ水冲洗等步骤将树脂中的甲醇去除,最后将活化后的树脂盘保存在4—6ºC的MilliQ水中备用。
 |
| 图 2 SPATT树脂盘 Fig. 2 The SPATT discs |
将SPATT树脂盘用500mL MilliQ水浸泡2次,每次5min,除去盐分及其它杂质,轻甩,尽可能除去SPATT上多余的水分。然后将树脂从SPATT树脂盘里取出,填充在30mL的全玻璃针筒中,并放置于安装有0.22μm的一次性微孔过滤器的固相萃取装置上。加入约30mL甲醇,搅拌1min,控制流速为1mL/min,收集萃取液于25mL样品瓶中。氮吹浓缩,用100%甲醇定容至5mL,取1mL萃取液于色谱进样瓶中,于-80°C保存,待LC-MS/MS分析。
1.4 LC-MS/MS分析检测Dionex UltiMate 3000/API 4000液质联用仪(LC/MS/MS)用于对各LSTs毒素进行检测分析。
1.4.1 色谱条件负离子(ESI-)扫描模式下条件: Waters XBridgeTMC18柱(3.0mm×150mm,3.5μm); 柱温: 40°C; 进样量: 10μL; 流速: 0.4mL/min流动相分为A、B两部分,其中A为水(含体积比为0.05%氨水),B为90%的乙腈(含体积比为0.05%氨水),采用梯度洗脱方式(0—1min,10%的流动相B; 1—9min,10%—90%的流动相B; 9—12min,90%的流动相B; 12—14min,90%—10%的流动相B; 14—18min,10%的流动相B)。用于分析大田软海绵酸(okadaic acid,OA)、鳍藻毒素-1,-2,-3(dinophysistoxin-1,-2,-3,DTX-1,-2,-3)、虾夷扇贝毒素(yessotoxin,YTX)及其衍生物(homoYTX、45-OH-homoYTX、45-OH-YTX和Carboxy-YTX)。
正离子(ESI+)扫描模式下条件: Waters XBridgeTMC18柱(2.1mm×50mm,2.5μm); 柱温: 25°C; 进样量: 10μL; 流速: 0.3mL/min; 流动相分为C、D两部分,其中C为水(含2mmol/L甲酸铵和50mmol/L甲酸),D为95%的乙腈(含2mmol/L甲酸铵和50mmol/L甲酸),采用梯度洗脱方式(0—1min,10%的流动相D; 1—3min,10%—80%的流动相B; 3—5min,80%的流动相D; 5—7min,80%—10%的流动相D; 7—9min,10%的流动相D)。用于分析扇贝毒素-1,-2,-6(pectenotoxin-1,-2,-6,PTX-1,-2,-6)及其衍生物(7-epi-PTX2sa)、螺环内酯毒素-1(spirolide-1,SPX-1)、环亚胺毒素(gymnodimine,GYM)、原多甲藻酸贝类毒素-1,-2,-3(azaspiracid-1,-2,-3,AZA-1,-2,-3)和短裸甲藻毒素-2,-3(brevetoxin-2,-3,PbTX-2,-3)。
1.4.2 质谱条件负离子(ESI-)扫描: 离子源: 电喷雾离子源(ESI); 气帘气: 13psi; 碰撞气: 5psi; 喷雾电压: -4.5kV; 离子源温度: 600°C; 离子源气1: 60psi; 子源气2: 50psi; 模式: 多反应监测(Multiple Reaction Monitor,MRM),[M-H]-(母离子>子离子): OA 803.5>255.1; DTX1 817.5>255.2; DTX2 803.5>255.2; DTX3 1055.7>255.2; YTX 1141.5>1061.5; homoYTX 1155.5>1075.5; 45-OH-homoYTX 1171.5>1091.5; 45-OH-YTX 1157.5>1077.5; Carboxy-YTX 1173.5>1094.4。
正离子(ESI+)扫描: 离子源: 电喷雾离子源(ESI); 气帘气: 16psi; 碰撞气: 5psi; 喷雾电压: 4.5kV; 离子源温度: 650°C; 离子源气1: 60psi; 子源气2: 45psi; 模式: 多反应监测(Multiple Reaction Monitor,MRM),[MH或MNH4]+(母离子>子离子): PTX1 892.5>839.5; PTX2 876.5>823.5; PTX6 906.5>853.5; 7-epi-PTX2sa 894.5>823.5; SPX1692.4>164.1; GYM 508.4>490.3; AZA1 842.6>824.6; AZA2 856.5>838.5; AZA3 828.5> 810.5; PbTX2 895.5>877.5; PbTX3 897.5>725.2。
1.5 数据分析本文对于树脂中毒素含量的计算,基于两个假设:(1)LSTs毒素被树脂被动吸附的过程在时间上呈均匀分布,即每天的吸附量相同;(2)LSTs毒素在树脂中的吸附未到达饱和状态。基于以上两个假设,树脂中吸附毒素的含量,将统一以10天为一个计算单位[ng/(g/10d)]。样品收集周期为15和30天的,也计算转换为以10天为单位的毒素含量。
OA的国际限量标准是45ng OA e.q./g 贝肉(Alexander et al,2008),中国绿色食品标准是200ng OA e.q./g贝肉,PTX2的国际限量标准是120ng e.q./g 贝肉(Alexander et al,2009),homoYTX的国际限量标准是3750ng YTX e.q./g 贝肉(Alexander et al,2009)。
2 结果本研究自2014年4月11日起至2015年4月10日对中国浙江南麂海域附近进行LSTs毒素的监测,监测的脂溶性贝类毒素LSTs包括: 大田软海绵酸(okadaic acid,OA)、鳍藻毒素-1,-2,-3(dinophysistoxin- 1-2-3,DTX-1,-2,-3)、虾夷扇贝毒素(yessotoxin,YTX)及其衍生物45-OH-YTX、Carboxy-YTX、homoYTX、扇贝毒素-1,-2,-6(pectenotoxin-1,-2,-6,PTX-1,-2,-6)及其衍生物7-epi-PTX2sa、螺环内酯毒素-1(spirolide-1,SPX1)、环亚胺毒素(gymnodimine,GYM)、原多甲藻酸贝类毒素-1,-2,-3(azaspiracid-1,-2,-3,AZA-1,-2,-3)和短裸甲藻毒素-2,-3(brevetoxin-2,-3,PbTX-2,-3),其中OA、DTX1、homoYTX、PTX2、7-epi-PTX2sa和GYM在贝肉中和SPATT(DIAION® HP20)中均检出,YTX仅在树脂中检出,AZA3和45-OH-homoYTX仅在贝肉中检出(见表 1)。对于毒素YTX、45-OH- homoYTX、7-epi-PTX2sa和AZA3的定性分析,因缺少其毒素标准品,本研究通过比对各毒素母离子及子离子的质荷比来确定。OA、DTX1、PTX2、homoYTX和GYM将进行定量分析。
| 毒素名称 | 毒素含量 | |
| SPATT树脂[ng/(g∙10d)] | 贝肉(ng/g) | |
| 大田软海绵酸(okadaicacid,OA) | 2.88—69.19 | N/A—77.19 |
| 鳍藻毒素-1(dinophysistoxin-1,DTX-1) | 0.18—21.39 | N/A—22.61 |
| 鳍藻毒素-2(dinophysistoxin-2,DTX-2) | — | — |
| 鳍藻毒素-3(dinophysistoxin-3,DTX-3) | — | — |
| 虾夷扇贝毒素(yessotoxin,YTX) | 未定量 | — |
| 虾夷扇贝毒素衍生物(45-OH-YTX) | — | — |
| 虾夷扇贝毒素衍生物(Carboxy-YTX) | — | — |
| 虾夷扇贝毒素衍生物(homoYTX) | N/A—92.93 | N/A—47.00 |
| 虾夷扇贝毒素衍生物(45-OH-homoYTX) | — | 未定量 |
| 扇贝毒素-1(pectenotoxin-1,PTX-1) | — | — |
| 扇贝毒素-2(pectenotoxin-2,PTX-2) | N/A—253.03 | N/A—3.15 |
| 扇贝毒素-6(pectenotoxin-6,PTX-6) | — | — |
| 短裸甲藻毒素-2(brevetoxin-2,PbTX-2) | — | — |
| 短裸甲藻毒素-3(brevetoxin-3,PbTX-3) | — | — |
| 扇贝毒素衍生物(7-epi-PTX2sa) | 未定量 | 未定量 |
| 螺环内酯毒素-1(spirolide-1,SPX1) | — | — |
| 环亚胺毒素(gymnodimine,GYM) | 0.20—3.19 | 0.48—16.28 |
| 原多甲藻酸贝类毒素-1(azaspiracids-1,AZA-1) | — | — |
| 原多甲藻酸贝类毒素-2(azaspiracids-2,AZA-2) | — | — |
| 原多甲藻酸贝类毒素-3(azaspiracids-3,AZA-3) | — | 未定量 |
| 注: N/A和“—”表示未检出或者低于检出限 | ||
本研究以南麂附近海域人工养殖的厚壳贻贝作为研究对象,在2014—2015年间进行29次样品采集,共获得57份样品,除PTX2检出率较低(10.47%)外,OA、DTX1、homoYTX和GYM的检出率均较高,分别为: 71.92%、40.27%、52.90%和100%,其中仅OA毒素含量超过国际限量标准(45ng OA e.q./g贝肉)(Alexander et al,2008),超标率达3.51%,OA毒素浓度最高达到77.19ng/g; GYM在贝肉中的含量较低,但检出率却达到100%,为贻贝的食用安全带来隐患。
2014年春季共采集贝类样品12份,OA、DTX1及GYM的检出率均达到100%,PTX2检出率16.67%,无homoYTX检出,所有样品中毒素含量均未超标。2014年夏季共采集贝类样品17份,其中OA检出率和超标率分别为88.24%和11.76%,DTX1、homoYTX、PTX2和GYM检出率分别为58.82%、82.35%、3.53%和100%。2014年秋季共采集贝类样品12份,无样品毒素超标,其中DTX1和PTX2未检出,OA、homoYTX、GYM检出率分别为91.67%、50%和100%。2014年冬季共采集贝类样品8份,DTX1、homoYTX和PTX2未检出,OA及GYM检出率分别为12.5%和100%。2015年春季共采集贝类样品8份,homoYTX和PTX2未检出,OA、DTX1、GYM检出率分别为25%、25%和100%(图 3)。
 |
| 图 3 2014—2015年不同季节厚壳贻贝贝肉中OA、DTX1、PTX2、homoYTX和GYM的检出情况 Fig. 3 Result of detection to OA,DTX1,PTX2,homoYTX and GYM in mussels during 2014—2015 |
OA和DTX1为腹泻性贝类毒素(Diarrhetic Shellfish Poisoning,DSP)中产生腹泻症状的主要毒素成分,就其检出率而言,2014年春季>2014年秋季>2014年夏季>2015年春季>2014年冬季(图 3,4),就其超标率而言,仅2014年夏季超标。OA+DTX1的总毒素含量,超标率为17.65%,主要是夏季。
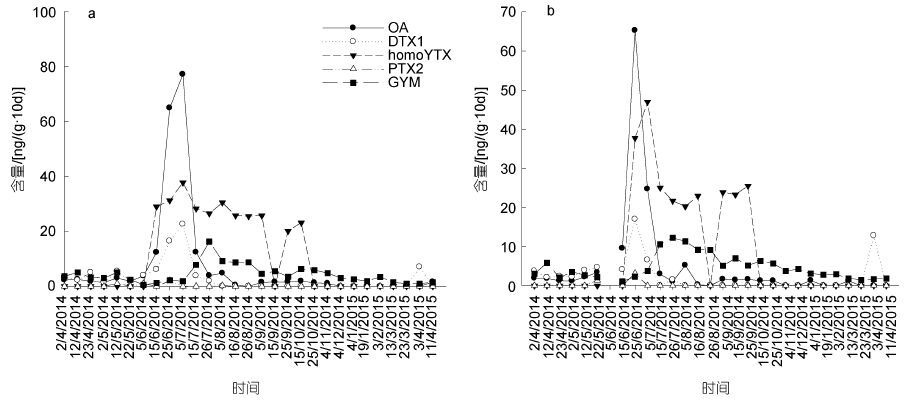 |
| 图 4 厚壳贻贝贝肉中OA、DTX1、PTX2、homoYTX和GYM含量的年分布特征(a: N1; b: N2) Fig. 4 Temporal distribution of OA,DTX1,PTX2,homoYTX and GYM in mussels(a: Site N1; b: Site N2) |
采用SPATT技术,选用大孔吸附树脂DIAION® HP20对浙江南麂海域脂溶性贝类毒素的污染状况进行监测,SPATT技术的优势在于可避免生物转化的影响,提高检测的准确性和灵敏度。在为期一年的采样中,本研究共实施29次样品采集,获得56份SPATT样品,OA、DTX1和GYM的检出率均高达100%,PTX2和homoYTX检出率分别为98%和59%,且SPATT树脂中OA、DTX1和PTX2含量均远远高于贝肉的检出结果(表 1,图 4、6、7)。
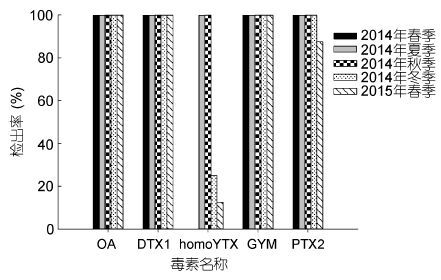 |
| 图 5 2014—2015年不同季节SPATT(DIAION®HP20)中OA、DTX1、PTX2、homoYTX和GYM的检出情况 Fig. 5 Result of detection to OA,DTX1,PTX2,homoYTX,and GYM by SPATT(DIAION®HP20)during 2014—2015 |
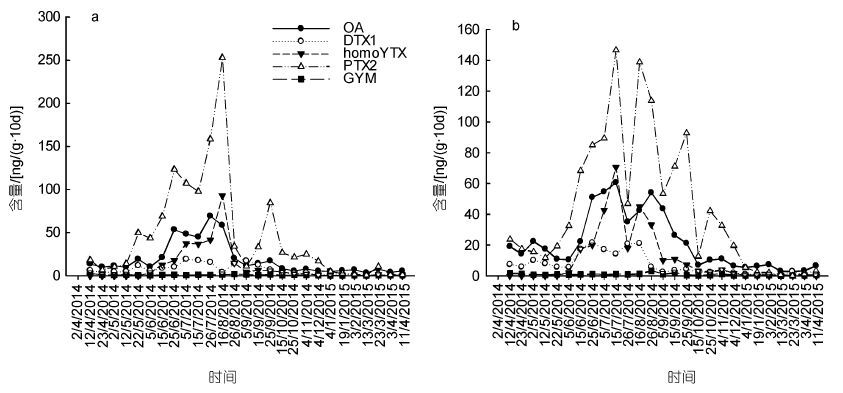 |
| 图 6 SPATT(DIAION®HP20)中OA、DTX1、PTX2、homoYTX和GYM的分布特征(a: N1; b: N2) Fig. 6 Temporal distribution of OA,DTX1,PTX2,homoYTX and GYM by SPATT(DIAION®HP20,a: Site N1; b: Site N2) |
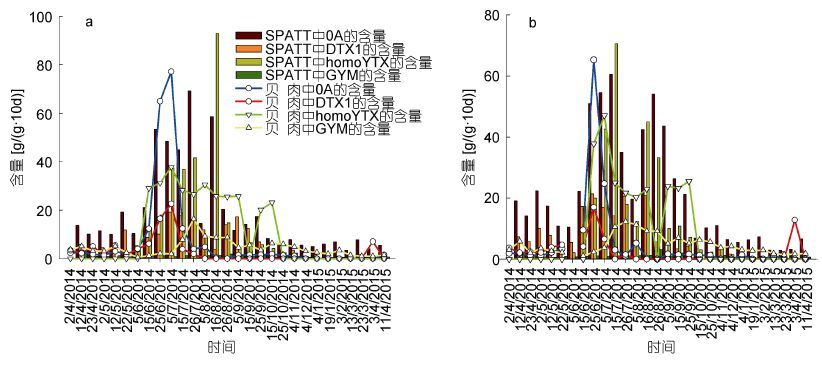 |
| 图 7 OA、DTX1、homoYTX和GYM在SPATT树脂和贝肉中的分布特征(a: N1; b: N2) Fig. 7 Quantitative relationships between the adsorption of OA,DTX1,homoYTX,and GYM by SPATT discs and the accumulation of toxins in mussel tissues along coast of Nanji Island(a: Site N1; b; Site N2) |
2014年春季共采集SPATT样品10份,OA、DTX1、PTX2及GYM的检出率均达到100%,无homoYTX检出。2014年夏季共采集SPATT样品18份,OA、DTX1、homoYTX、PTX2和GYM检出率均为100%。2014年秋季共采集SPATT样品12份,但检出率均为100%。2014年冬季共采集SPATT样品8份,除homoYTX检出率分别为25%外,其它毒素检出率均为100%。2015年春季共采集SPATT样品8份,homoYTX和PTX2检出率分别为12.5%和87.5%,OA、DTX1和GYM检出率均为100%。由检测结果可见(图 5),全年监测过程中,OA、DTX1、PTX2及GYM的检出率均为100%,homoYTX的检出率在夏季和秋季也达到100%。
和贝类样品中毒素的监测结果类似,夏季SPATT树脂中吸附的毒素含量高于其它季节,其中2014年夏季PTX2的最高含量高达253.03ng/(g∙10d),OA的最高含量为69.19ng/(g∙10d)。
3 讨论 3.1 贝肉中LSTs毒素吴锋等(2010)对南麂海域贝类污染状况的调查表明,夏季为该海域DSP毒素检出率和超标率最高的季节(分别为78.9%和68.4%),冬季最低(检出率与超标率均为28.6%),春秋两季差异不大。张树刚等(2011)对浙南海域的监测结果也表明OA的季节分布为夏季>春季>秋季。本研究也发现,2014年夏季南麂岛的DSP毒素检出率最高。由此可见,夏季是浙江南麂岛海域脂溶性贝类毒素尤其是DSP毒素污染的高发期,其次为春秋季节。夏季是加强食品安全监测的重要季节,应采取相应的措施保证贝类等水产品的食用安全。
虽然GYM毒素含量不高,但全年均有检出,GYM的年分布变化不大,可能是由于GYM在贝类体内降解代谢缓慢所致。MacKenzie等(2002)的研究表明GYM在绿壳扇贝(Perna canaliculus)体内可以以持续稳定的浓度存在5个月以上,且GYM不仅累积在消化腺还存在于肌肉组织中。虽然目前GYM被认为是低风险毒素,但其能够加强肿瘤的形成,而且接触过GYM的Neuro2a细胞对OA的反应更加敏感,表明GYM和OA的混合毒素具有更大的危害(Dragunow et al,2005)。因此,加强浙江南麂海域GYM毒素的研究与监测,也迫在眉睫。
3.2 SPATT中LSTs毒素SPATT(DIAION®HP20)中检测到大量PTX2毒素(高达253.03ng/(g∙10d),图 6),但厚壳贻贝中PTX2的含量却非常低(全年检出率仅为10.34%,最高值仅为3.15ng/g,图 4),这很有可能与PTX2的不稳定性有关,由PTX2在贝类体内产生了生物转化所引起。Suzuki等(2001)对扇贝(Pecten novaezeladiae)体内PTXs组分展开了研究,结果表明PTX2在扇贝体内能够快速转化为PTX-2sa及7-epi-PTX2sa,且PTX-2sa占主导地位,7-epi-PTX2sa含量相对较少。在本研究中浙江南麂海域厚壳贻贝中检测出7-epi-PTX2sa的存在,可能是PTX2毒素的生物转化的结果。此外,Miles等(2004)的研究表明紫贻贝(Mytilus edulis)和新西兰绿壳贻贝(Perna canaliculus)能够将PTX2快速水解为PTX-2sa,虽然相较于PTX2的毒性(LD50=219ng/g),PTX-2sa毒性非常小(5000ng/g的剂量对小鼠没有显著影响),但PTX-2sa和7-epi-PTX-2sa共同作用对胃肠损害较大(Burgess et al,2001)。因而,为进一步确保贝类水产品的食用安全,对水体中PTX2的检测也不可少。
3.3 SPATT树脂的预警预报效果LSTs毒素在贝肉和SPATT树脂中的含量呈现较好的相关性(图 7)。从时间分布来看,贝肉中脂溶性贝类毒素的含量均在夏季达到峰值,秋季次之,冬春季最低(图 4、7),SPATT树脂中脂溶性贝类毒素的含量亦呈此规律(图 6、7)。从毒素成分及含量来看,贝肉和SPATT树脂中检测到的毒素成分一致,分别为OA、DTX1、PTX2、homoYTX和GYM。而且同一采样时间点,贝肉和SPATT树脂中毒素含量的变化趋势基本相同。Fux等(2009)在爱尔兰西海岸同时对SPATT树脂(HP20)和贻贝中贝类毒素进行监测,均检测到OA、DTX2、AZA1、PTX2和YTX,且其在SPATT树脂和贝肉中的含量具有良好的相关性。
在本研究中,除2014年6月底和7月初等个别采样时间点外,OA、DTX1和PTX2毒素在SPATT树脂(HP20)中的含量均高于其在贝肉中的含量。从全年检出率来看,贝肉中各毒素检出率由高到低依次为: GYM(100%)、OA(71.92%)、homoYTX(52.90%)、DTX1(40.27%)和PTX2(10.47%); SPATT树脂中各毒素检出率依次为: GYM(100%)、OA(100%)、DTX1(100%)、PTX2(98%)和homoYTX(59%)。在冬季贝肉中无OA、DTX1、PTX2和homoYTX毒素检出的情况下,SPATT树脂中仍检测到较高含量的相应毒素,且OA、DTX1和PTX2在SPATT树脂中的检出率仍高达100%。由此可见,相对于厚壳贻贝,SPATT树脂(HP20)对水体中脂溶性贝类毒素OA、DTX1和PTX2更加敏感。Fux等(2009)发现当SPATT树脂(HP20)中OA和DTX2在2005年8月下旬达到峰值(分别为2640ng/g和617ng/g)时,几乎在同一时间贝肉中OA和DTX2的含量也达到峰值(分别为365ng/g和141ng/g),贝肉中OA和DTX2的含量远低于SPATT树脂中相应毒素的含量。Rundberget等(2009)的研究也表明DTXs在SPATT树脂(HP20)和贝肉中的含量的变化趋势一致,具有良好的相关性,且同一时刻,SPATT树脂中毒素含量明显高于贝肉中毒素的含量。同时,Lane等(2010)的研究还指出HP20树脂的特性(相对较低的吸附速率、较高的解吸速率等)较适宜用来模仿贝类吸附贝类毒素。
SPATT技术自2004年问世(MacKenzie et al,2004)以来以其独特的优势,如: 可有效避免生物转化; 较高的灵敏度; 可应用于无贝类存在的海域; 简单便捷等(Rundberget et al,2009; MacKenzie,2010),得到广泛的研究和应用(Fux et al,2008; Pizarro et al,2013; McCarthy et al,2014;Zendong et al,2014, Zhang et al,2015)。本文研究也表明,SPATT树脂(HP20)和贝肉中监测到的毒素种类及含量具有良好的相关性,相对于厚壳贻贝,SPATT树脂对水体中脂溶性贝类毒素OA、DTX1和PTX2等更加敏感,有望作为水中贝类毒素的监测材料,进行预警。
4 结论(1) 南麂岛附近海域贝肉和SPATT树脂(HP20)中检测到的毒素种类一致,分别为OA、DTX1、PTX2、homoYTX和GYM; 各毒素成分在贝肉和SPATT树脂(HP20)中的含量具有良好的相关性; 相对于厚壳贻贝,SPATT树脂对水体中脂溶性贝类毒素OA、DTX1和PTX2等更加敏感,有望作为水中贝类毒素的监测材料,进行预警。
(2) 在南麂岛附近海域监测的LSTs毒素中,OA、DTX1、PTX2、homoYTX和GYM的检出率存在季节差异,呈现夏季最高,春秋季节较低,冬季最低的趋势。
| 吴锋, 江天久, 张帆, 等. 2010. 浙江南麂海域双壳贝类的腹泻性贝毒分析. 海洋环境科学, 29 (4) : 492–495 |
| 张树刚, 邹清, 陈雷, 等. 2011. 浙南海域腹泻性贝毒分析. 海洋科学, 35 (1) : 44–47 |
| 陈舜, 佟蒙蒙, 江天久, 等. 2009. 赤潮灾害对水产养殖业损失的分级评估. 水产学报, 33 (4) : 610–616 |
| 郑重莺, 张海琪, 宋琍琍, 等. 2012. 浙江省市售主要食用贝类中麻痹性贝类毒素和腹泻性贝类毒素污染状况分析. 浙江农业科学, (2) : 236–239 |
| 姚炜民, 卢益炳. 2005. 浙江中、南海域的赤潮和赤潮生物. 温州师范学院学报(自然科学版), 26 (5) : 59–62 |
| Alexander J, Auðunsson G A, Benford D, et al. 2008. Marine biotoxins in shellfish-okadaic acid and analogues1-scientific opinion of the panel on contaminants in the food chain. The EFSA Journal, 589 : 1–62 |
| Alexander J, Benford D, Boobis A, et al. 2009. Marine biotoxins in shellfish-Summary on regulated marine biotoxins1- scientific opinion of the panel on contaminants in the food chain. The EFSA Journal, 1306 : 6–23 |
| Burgess V, Shaw G. 2001. Pectenotoxins-an issue for public health: a review of their comparative toxicology and metabolism. Environment International, 27 (4) : 275–283 DOI:10.1016/S0160-4120(01)00058-7 |
| Dragunow M, Trzoss M, Brimble M A, et al. 2005. Investigations into the cellular actions of the shellfish toxin gymnodimine and analogues. Environmental Toxicology and Pharmacology, 20 (2) : 305–312 DOI:10.1016/j.etap.2005.02.008 |
| Fux E, Marcaillou C, Mondeguer F, et al. 2008. Field and mesocosm trials on passive sampling for the study of adsorption and desorption behaviour of lipophilic toxins with a focus on OA and DTX1. Harmful Algae, 7 (5) : 574–583 DOI:10.1016/j.hal.2007.12.008 |
| Fux E, Bire R, Hess P. 2009. Comparative accumulation and composition of lipophilic marine biotoxins in passive samplers and in mussels (M. edulis) on the West Coast of Ireland. Harmful Algae, 8 (3) : 523–537 |
| Lane J Q, Roddam C M, Langlois G W, et al. 2010. Application of solid phase adsorption toxin tracking (SPATT) for field detection of the hydrophilic phycotoxins domoic acid and saxitoxin in coastal California. Limnology and Oceanography: Methods, 8 (11) : 645–660 DOI:10.4319/lom.2010.8.0645 |
| Li A F, Ma J G, Cao J J, et al. 2012. Toxins in mussels (Mytilus galloprovincialis) associated with diarrhetic shellfish poisoning episodes in China. Toxicon, 60 (3) : 420–425 DOI:10.1016/j.toxicon.2012.04.339 |
| MacKenzie L, Holland P, McNabb P, et al. 2002. Complex toxin profiles in phytoplankton and Greenshell mussels (Perna canaliculus), revealed by LC-MS/MS analysis. Toxicon, 40 (9) : 1321–1330 DOI:10.1016/S0041-0101(02)00143-5 |
| MacKenzie L, Beuzenberg V, Holland P, et al. 2004. Solid phase adsorption toxin tracking (SPATT): a new monitoring tool that simulates the biotoxin contamination of filter feeding bivalves. Toxicon, 44 (8) : 901–918 DOI:10.1016/j.toxicon.2004.08.020 |
| MacKenzie L A. 2010. In situ passive solid-phase adsorption of micro-algal biotoxins as a monitoring tool. Current Opinion Biotechnology, 21 (3) : 326–331 DOI:10.1016/j.copbio.2010.01.013 |
| McCarthy M, van Pelt F N A M, Bane V, et al. 2014. Application of passive (SPATT) and active sampling methods in the profiling and monitoring of marine biotoxins.. Toxicon, 88 : 77–86 DOI:10.1016/j.toxicon.2014.06.011 |
| Miles C O, Wilkins A L, Munday R, et al. 2004. Isolation of pectenotoxin-2 from Dinophysis acuta and its conversion to pectenotoxin-2 seco acid, and preliminary assessment of their acute toxicities. Toxicon, 43 (1) : 1–9 DOI:10.1016/j.toxicon.2003.10.003 |
| Pizarro G, Moroño Á, Paz B, et al. 2013. Evaluation of passive samplers as a monitoring tool for early warning of Dinophysis toxins in shellfish. Marine Drugs, 11 (10) : 3823–3845 DOI:10.3390/md11103823 |
| Rundberget T, Gustad E, Samdal I A, et al. 2009. A convenient and cost-effective method for monitoring marine algal toxins with passive samplers. Toxicon, 53 (5) : 543–550 DOI:10.1016/j.toxicon.2009.01.010 |
| Suzuki T, Mackenzie L, Stirling D, et al. 2001. Conversion of pectenotoxin-2 to pectenotoxi-2 seco acid in the New Zealand scallop, Pecten novaezelandiae. Fisheries Science, 67 (3) : 506–510 DOI:10.1046/j.1444-2906.2001.00265.x |
| Zendong Z, Herrenknecht C, Abadie E, et al. 2014. Extended evaluation of polymeric and lipophilic sorbents for passive sampling of marine toxins. Toxicon, 91 : 57–68 DOI:10.1016/j.toxicon.2014.03.010 |
| ZendongZ, KadiriM, HerrenknechtC, 等. 2016. Algal toxin profiles in Nigerian coastal waters (Gulf of Guinea) using passive sampling and liquid chromatography coupled to mass spectrometry. Toxicon, 114 : 16–27 |
| Zhang C L, Zhang J Y. 2015. Current techniques for detecting and monitoring algal toxins and causative harmful algal blooms. Environmental Analytical Chemistry, 2 (1) : 123 |
 2016, Vol. 47
2016, Vol. 47


