中国海洋湖沼学会主办。
文章信息
- 李洁, 徐奎栋. 2016.
- LI Jie, XU Kui-Dong. 2016.
- 南黄海夏秋季纤毛虫等微小型浮游动物丰度和生物量变动及其与沙海蜇旺发的关系
- ABUNDANCE AND BIOMASS OF NANO- AND MICROZOOPLANKTON IN PARTICULAR CILIATES IN RELATION TO THE MASS OCCURRENCE OF NEMOPILEMA NOMURAI IN THE SOUTHERN YELLOW SEA IN SUMMER AND AUTUMN
- 海洋与湖沼, 47(3): 612-625
- Oceanologia et Limnologia Sinica, 47(3): 612-625.
- http://dx.doi.org/10.11693/hyhz20160200037
-
文章历史
- 收稿日期:2016-02-22
- 改回日期:2016-04-24
2. 中国科学院大学 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
大型水母尤其是沙海蜇的旺发,已成为黄、东海海域愈加频繁的一种生态现象(Xian et al,2005; Dong et al,2010; Uye,2011; Sun et al,2015)。水母作为顶端浮游生物捕食者引起海洋生态系统中浮游生物群落结构的变化(Larson,1987; Stibor et al,2003; Compte et al,2010)。微小型浮游动物包括粒径处在2―20μm之间微型浮游动物(主要为自养和异养的鞭毛虫)和粒径处在20―200μm之间的小型浮游动物(主要包括纤毛虫和小型鞭毛虫)。纤毛虫和鞭毛虫作为海洋微型和小型浮游动物的主要类群,是微食物环的主要组成部分。纤毛虫主要摄食微型鞭毛虫、硅藻和细菌及微微型浮游植物,从而控制浮游植物的生长并调节初级生产力的分布; 同时作为大中型浮游动物的饵料。由此在海洋生态系统的物质传递和能量流动中发挥重要的作用(Fenchel,2008)。
小型水母摄食鞭毛虫和纤毛虫曾经被报道过。海月水母成体和水螅体可以直接捕食纤毛虫(Malej et al,2007; Turk et al,2008; Kamiyama,2011),其蝶状体可以鞭毛虫为食(Båmstedt U et al,2001)。其它一些小型水母与纤毛虫和鞭毛虫的级联效应也有报道(Compte et al,2010;Granéli et al,2002; West et al,2009)。纤毛虫和鞭毛通过传递初级生产力至更高的营养层级,在小型水母主导的生态系统中起到重要的作用。水母的发生可使食物网的能流结构向微食物网倾斜,由此放大了纤毛虫在微食物网中的生态作用(Condon et al,2011)。
作为大型浮游动物,沙海蜇以往被认为主要摄食大中型浮游动物。然而新近的研究表明,仅仅大中型浮游动物作为食物基础并不足以支撑沙海蜇旺发(张芳,2008)。丁军军等(2012)的研究发现,黄海夏季沙海蜇大量出现的断面,纤毛虫数量较春季显著降低,而未见水母的断面则数量较春季升高了约一个数量级,并由此推测夏季纤毛虫丰度明显降低系水母捕食所致。然而,迄今并无沙海蜇直接摄食纤毛虫等小型浮游动物的报道。与此相对,Wang等(2013)则发现在沙海蜇6月和8月大量出现的黄海33°N断面纤毛虫持续增加的现象,推测纤毛虫的高生物量和高生产力为大型水母的发生提供了食物支撑。尽管近年来水母旺发现象在黄、东海频繁地出现,沙海蜇与微小型浮游动物尤其是纤毛虫在水母暴发过程中的作用也不明确。
2013年,沙海蜇在南黄海出现了旺发现象。5月3日至6月8日水母浮游幼体幼体(碟状幼体、水母幼体等)在(122.00°—122.75°E,30.55°—33.00°N)区域被检获,在6月底沙海蜇的丰度和生物量在33°N(I断面)至34°N(G断面)断面开始增加,到8月底沙海蜇丰度和生物量剧增在包括35°N(E断面)的几乎整个黄海都有分布; 9月份沙海蜇分布范围与8月一致,丰度和生物量相较于8月份还略有增加(Sun et al,2015)。本研究基于2013年6、8、9月份对黄海进行的微型和小型浮游动物调查,拟通过研究南黄海水母旺发前后纤毛虫和鞭毛虫等微小型浮游动物的群落结构、数量分布及变化,探寻纤毛虫与水母旺发的相互作用关系。
1 材料与方法 1.1 调查海域与样品采集于2013年6月15—26日、8月26—28日和9月19—22日三个时段,在南黄海海域沙海蜇大量出现的E(35°N)、G(34°N)和I(33°N)三个断面(120°30′— 124°00′E)进行了微型和小型浮游动物的水样采集(图 1)。研究站位的海水温度、盐度和水深系由CTD获得。在每个站位,使用Rosette采水器采集水样。取1L水样使用终浓度为2%的酸性Lugol’s液进行固定(Sherr et al,1986),避光保存,至实验室分析。
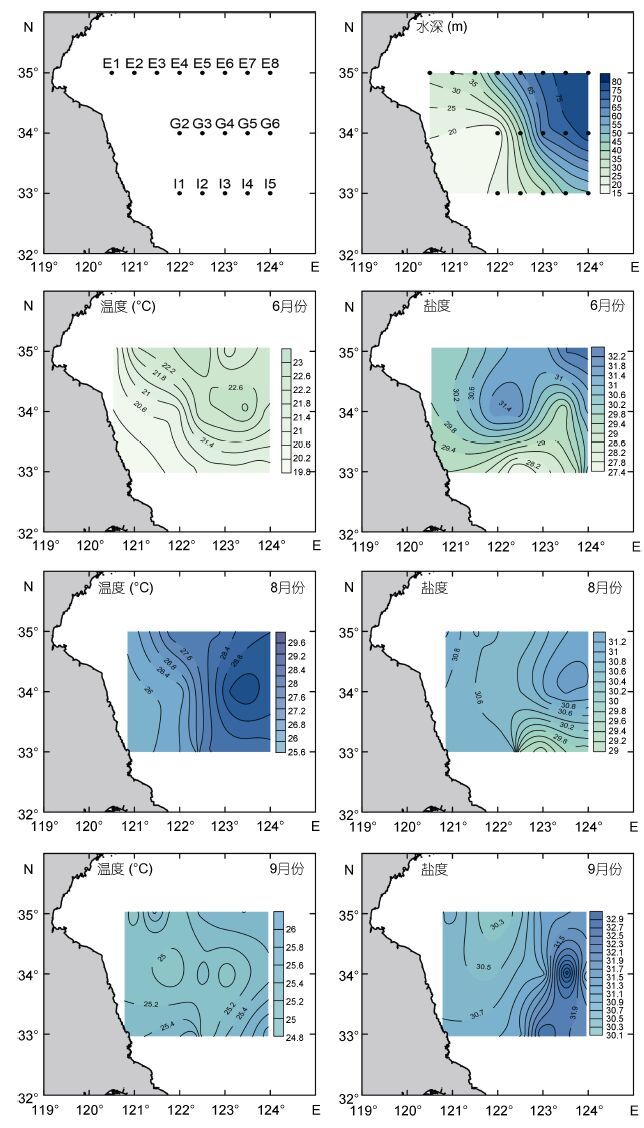 |
| 图 1 黄海采样站位图及表层水环境因子 Fig. 1 Deployment of the sampling stations and the distribution of environmental factors at surface water |
水样带回实验室转移至量筒中自然沉降48h,虹吸出上层清液,将剩余的100mL移至小容积样品瓶中。取10—20mL浓缩水样至Utermöhl浮游生物计数框,沉降3h以上,置于200×倒置显微镜下,进行浮游纤毛虫的分类计数以及桡足类无节幼体和夜光虫的计数。纤毛虫的分类鉴定依据相关的参考文献(Kofoid et al,1929,1939; 宋微波等,2009)。每个种至少测量20个个体的长和宽以取平均值,少于20个个体的种测量全部个体的长和宽。生物体积按照最接近的几何体来估算(Hillebrand et al,1999)。使用转换系数0.19pg·C/ μm3完成纤毛虫生物体积到生物量的转换(Putt et al,1989)。砂壳纤毛虫的细胞体积约为生物体积(壳室)的30%(Gilron et al,1989)。桡足类无节幼体使用转换系数0.07pg·C/μm3进行生物体积到生物量的转换。夜光虫的生物量按公式: C(pg·C/ind.)= 0.216×CV(μm3)0.939(Menden-Deuer et al,2000)(CV 代表细胞体积)。
纤毛虫、桡足类无节幼体和夜光虫的生产力(P,μgC/(L·d))用生物量乘以生长率(g,d-1)获得。纤毛虫生长率的计算使用公式: lng=1.52lnt-0.27lnCV-1.44(CV代表细胞体积; t表示水温; Müller et al,1993)。桡足类无节幼体生产力的计算使用公式: g=0.057e0.069t(t表示水温)(Uye et al,1996)。夜光虫生长率取0.2/d(Nakamura,1998)。
鞭毛虫采用DAPI荧光染色技术进行计数(Pomroy,1984)。具体为: 取3—5mL浓缩样品用DAPI(f.c.15μg/mL)和复染剂Evans Blue(f.c.10-6 g/mL),低温避光染色10min。将样品过滤到0.22μm的黑聚碳酸酯膜上,封片后置于Zeiss Axioskop 2 plus HBO 100荧光显微镜油镜下计数。每片随机计数50个视野,然后转换为每毫升样品中鞭毛虫的个数(ind./mL)即其丰度,根据转换系数220fgC/μm3(Børsheim et al,1987),将鞭毛虫丰度转换为以碳为单位的生物量。
1.3 数据统计分析使用Surfer 11绘制站位图及相关丰度、生物量的分布图,使用Excel绘制柱状图,使用SPSS软件分析各研究站位对纤毛虫、鞭毛虫丰度、生物量、环境因子进行相关分析; 使用PRIMER 5中的CLUSTER对纤毛虫物种-丰度聚类分析,使用DIVERSE计算纤毛虫物种数、Margalef丰富度指数(Margalef index,d=(S-1)/lnN)、香农-威纳指数(Shannon-Weaver index,H’= -Σ(Ni/N)ln(Ni/N))和辛普森指数(Simpson index,1-l=1-SUM(Ni*(Ni-1)/(N*(N-1)))(S表示物种数,N表示总丰度,Ni表示第i种的丰度)。
2 结果 2.1 环境因子所调查的三个断面的平均水深为(48±20)m,最深处为南黄海东侧的G6站达79m,最浅处为江苏近岸的G2站仅16m。6月、8月和9月份表层水温分别为(21.74±0.96)℃、(27.83±0.99)℃和(25.35±0.39)℃,表层盐度分别为(30.25±1.54)、(30.43±0.67)和(31.12± 0.75)。6月、8月和9月份表层水温均呈现近岸低远岸高的趋势,盐度则呈现出南低北高,近岸低远岸高的趋势(图 1)。
2.2 纤毛虫群落构成、分布及生产力本次调查共鉴定纤毛虫31属64种,其中无壳类纤毛虫16属42种; 砂壳类纤毛虫15属22种。无壳种类纤毛虫以急游虫属(Strombidium)种类数最多,砂壳类纤毛虫以拟铃虫属(Tintinnopsis)种类最多(表 1)。6月、8月和9月份调查纤毛虫的种类组成差别不大。6月份共检获纤毛虫22属50种,其中无壳类37种,砂壳类13种; 站位的物种数平均值为17,最高物种数27出现在I4站,最低物种数10出现于G2站。8月份共检获纤毛虫25属48种,其中无壳类33种,砂壳类15种; 物种数平均值为12,最高物种数30出现在G2站,最低物种数5出现在E4、G4和G6站。9月份共检获纤毛虫25属51种,其中无壳类35种,砂壳类16种; 物种数平均值为15,最高物种数31出现在I2站,最低物种数7出现在E7站。
| 种名 | 6月 | 8月 | 9月 | |||
| A | B | A | B | A | B | |
| 德鲁彭体虫Chlamydonella derouxi | 1 | <1.0 | 0 | <1.0 | 0 | <1.0 |
| 管游虫属Crytostrombidium sp. | 3 | <1.0 | 1 | <1.0 | 4 | <1.0 |
| 双栉毛虫Didinium sp. | 3 | <1.0 | 1 | <1.0 | 0 | <1.0 |
| 中华前口虫Frontonia sinica | 5 | <1.0 | 2 | 1.3 | 0 | <1.0 |
| 大弹跳虫Halteria grandinella | 2 | <1.0 | 2 | <1.0 | 7 | <1.0 |
| 细小曼哈特虫Hartmannula angustipilosa | 7 | <1.0 | 9 | 2.6 | 7 | 1.4 |
| 旋转螺体虫Laboea strobila | 18 | 10.4 | 10 | 3.7 | 12 | 6 |
| 红色中缢虫Mesodinium rubrum | 16 | 19.6 | 7 | 17.7 | 11 | 36.8 |
| 卡尔欧米虫Omegastrombidium kahli | 4 | <1.0 | 1 | <1.0 | 4 | <1.0 |
| 帆口虫属Pleuronema sp. | 0 | <1.0 | 0 | <1.0 | 1 | <1.0 |
| 海洋拟阿脑虫Paranophrys marina | 0 | <1.0 | 3 | <1.0 | 0 | <1.0 |
| 伪康纤虫Pseudocohnilembus sp. | 16 | 4.5 | 9 | 5.5 | 13 | 5.8 |
| 惊扰伪颈毛虫Pseudotrachelocerca trepida | 5 | <1.0 | 1 | <1.0 | 4 | <1.0 |
| 旋曳尾虫Spirotontonia agatha | 14 | 7.7 | 9 | 6.6 | 13 | 2.4 |
| 切斯里拟盗虫Strombidinopsis cheshin | 6 | <1.0 | 1 | 1.4% | 5 | <1.0 |
| 拟盗虫属Strombidinopsis sp.1 | 8 | <1.0 | 2 | <1.0 | 3 | <1.0 |
| 拟盗虫属Strombidinopsis sp.2 | 4 | <1.0 | 11 | 7.9 | 13 | 2.4 |
| 拟盗虫属Strombidinopsis sp.3 | 7 | <1.0 | 1 | <1.0 | 5 | <1.0 |
| 具头急游虫Strombidium capitatum | 0 | <1.0 | 0 | <1.0 | 3 | <1.0 |
| 急游虫属Strombidium constrictum | 0 | <1.0 | 1 | <1.0 | 0 | <1.0 |
| 球形急游虫Strombidium globosaneum | 8 | 2.4 | 10 | 4.4 | 15 | 10.6 |
| 曼塔急游虫Strombidium montagnesi | 10 | 9.1 | 0 | <1.0 | 5 | 1.8 |
| 拟卡金斯急游虫Strombidium paracalkinsi | 9 | <1.0 | 1 | <1.0 | 2 | <1.0 |
| 楔尾急游虫Strombidium stylifer | 9 | 1.4 | 1 | <1.0 | 4 | <1.0 |
| 模式急游虫Strombidium typicum | 2 | <1.0 | 8 | 6.7 | 6 | 1.1 |
| 急游虫属Strombidium sp.1 | 14 | 9.6 | 11 | 16 | 8 | 2.7 |
| 急游虫属Strombidium sp.2 | 8 | <1.0 | 9 | 4 | 7 | <1.0 |
| 急游虫属Strombidium sp.3 | 5 | <1.0 | 6 | 3 | 15 | 3 |
| 急游虫属Strombidium sp.4 | 1 | <1.0 | 0 | <1.0 | 0 | <1.0 |
| 急游虫属Strombidium sp.5 | 6 | 3.2 | 0 | <1.0 | 1 | <1.0 |
| 急游虫属Strombidium sp.6 | 8 | 2.2 | 9 | 5.5 | 14 | 13 |
| 急游虫属Strombidium sp.7 | 18 | 11.8 | 7 | 1.4 | 15 | 5.7 |
| 急游虫属Strombidium sp.8 | 2 | <1.0 | 0 | <1.0 | 3 | <1.0 |
| 急游虫属Strombidium sp.9 | 1 | <1.0 | 5 | <1.0 | 6 | <1.0 |
| 急游虫属Strombidium sp.10 | 13 | 1.5 | 1 | <1.0 | 8 | <1.0 |
| 急游虫属Strombidium sp.11 | 11 | 2 | 3 | <1.0 | 5 | <1.0 |
| 急游虫属Strombidium sp.12 | 5 | <1.0 | 7 | 4.1 | 1 | <1.0 |
| 急游虫属Strombidium sp.13 | 15 | 4.5 | 6 | 2.3 | 0 | <1.0 |
| 急游虫属Strombidium sp.14 | 16 | 3 | 1 | <1.0 | 1 | <1.0 |
| 急游虫属Strombidium sp.15 | 5 | <1.0 | 1 | <1.0 | 1 | <1.0 |
| 急游虫属Strombidium sp.16 | 2 | <1.0 | 6 | 1.5 | 6 | <1.0 |
| 急游虫属Strombidium sp.17 | 0 | <1.0 | 0 | <1.0 | 1 | <1.0 |
| 小棘口虫Acanthostomella minuiticssima | 0 | <1.0 | 4 | 5.8 | 1 | <1.0 |
| 尖底类瓮虫Amphorellopsis acuta | 0 | <1.0 | 4 | <1.0 | 3 | <1.0 |
| 钝囊坎虫Ascampbelliella retusa | 1 | <1.0 | 0 | <1.0 | 2 | <1.0 |
| 斑纹砂囊虫Bursaopsis punctostriata | 2 | <1.0 | 0 | <1.0 | 0 | <1.0 |
| 酒瓶类铃虫Codonellopsis morchella | 1 | <1.0 | 0 | <1.0 | 2 | <1.0 |
| 漂流波缘杯虫Cymatocylis canvallaria | 0 | <1.0 | 1 | <1.0 | 2 | <1.0 |
| 酒杯类管虫Dadayiella ganymedes | 1 | <1.0 | 0 | <1.0 | 0 | <1.0 |
| 多边网袋虫Dictyocysta polygonata | 2 | <1.0 | 1 | <1.0 | 0 | <1.0 |
| 细瘦真铃虫Eutintinnus macilentus | 0 | <1.0 | 0 | <1.0 | 1 | <1.0 |
| 前进真铃虫Eutintinnus procurrerens | 0 | <1.0 | 1 | <1.0 | 2 | <1.0 |
| 长形旋口虫Helicostomella longa | 1 | <1.0 | 1 | <1.0 | 1 | <1.0 |
| 波特薄铃虫Leprotintinus bottnicus | 0 | <1.0 | 1 | <1.0 | 0 | <1.0 |
| 缩短原纹虫Protorhabdonella curta | 0 | <1.0 | 1 | <1.0 | 2 | <1.0 |
| 白领细壳虫Stenosemella nivalis | 1 | <1.0 | 1 | 0.1 | 1 | <1.0 |
| 原始筒壳虫Tintinnidium primitivum | 4 | <1.0 | 2 | <1.0 | 4 | 3 |
| 诺氏薄铃虫Leprotintinus nordqvisti | 0 | <1.0 | 1 | <1.0 | 2 | <1.0 |
| 短颈拟铃虫Tintinnopsis brevicollis | 1 | <1.0 | 1 | <1.0 | 0 | <1.0 |
| 纤弱拟铃虫Tintinnopsis gracilis | 1 | <1.0 | 0 | <1.0 | 2 | <1.0 |
| 弯叶拟铃虫Tintinnopsis lobiancoi | 1 | <1.0 | 0 | <1.0 | 0 | <1.0 |
| 钵体拟铃虫Tintinnopsis subpistillutn | 0 | <1.0 | 0 | <1.0 | 1 | <1.0 |
| 根状拟铃虫Tintinnopsis radix | 0 | <1.0 | 2 | <1.0 | 3 | <1.0 |
| 管状拟铃虫Tintinnopsis tubulosa | 7 | <1.0 | 2 | <1.0 | 3 | <1.0 |
纤毛虫生物多样性6月份Margalef丰富度指数平均值为2.16,香农-威纳指数平均值为2.0; 辛普森多样性指数平均值0.79。8月份Margalef丰富度指数平均值为1.68; 香农-威纳指数平均值为1.72; 辛普森多样性指数平均值0.70。9月份Margalef丰富度指数平均值为1.90; 香农-威纳指数平均值为1.70; 辛普森多样性指数平均值0.68。
纤毛虫在6月份的丰度为(2282±1477)ind./L(图 2,表 2),其中E、G和I断面的丰度分别为(2291±1710)、(1841±1336)和(2709±1377)ind./L; 最低值出现于G2站,为185 ind./L,最高值出现于E3站,达5786ind./L。8月份纤毛虫丰度明显降低,仅为(933±727)ind./L,其中E、G和I断面丰度分别为(962± 730)、(662±724)和(1176±792)ind./L; 最低值出现于G4站,仅90ind./L,最高值出现于I2站,为2160ind./L。9月份丰度最高,为(2319±1724)ind./L,其中E、G和I断面丰度分别为(1594±1182)、(1770±1378)和(3884±1880)ind./L; 最低值出现于G3站(360ind./L),最高值出现于I4站(5850ind./L)。单种丰度超过1000ind./L的纤毛虫包括6月E2、E3和G3站的红色中缢虫(Mesodinium rubrum)(粒径22μm)和I4站的急游虫(Strombidium sp.7)(粒径44μm),8月I5站的红色中缢虫、9月G2、I3、I4和I5站的红色中缢虫与E1和E4站的急游虫(Strombidium sp.6)(粒径50μm)以及G6站的Laboea strobila(粒径92μm),其中红色中缢虫在9月I3和I4站的丰度分别达4640 ind./L和4720ind./L。
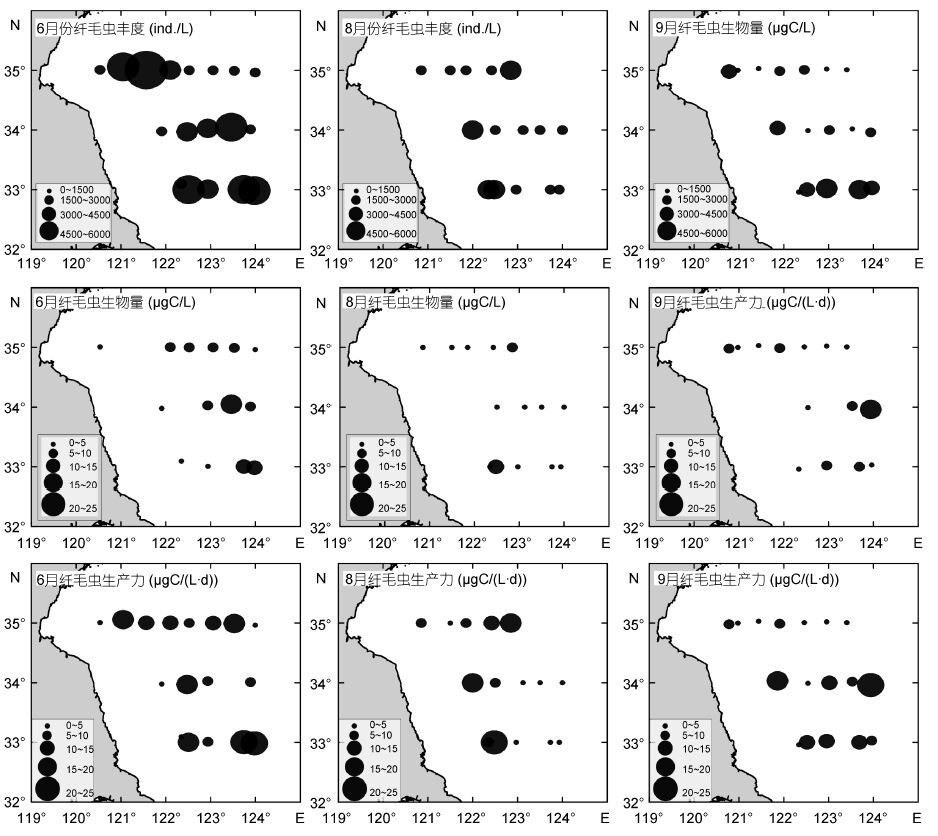 |
| 图 2 表层纤毛虫在6月、8月和9月E,G和I断面的丰度、生物量与生产力 Fig. 2 Abundance,biomass,and productivity of ciliates in surface water at the transects E,G,and I in June,August,and September |
| 类群 | 6月 | 8月 | 9月 | |
| 丰度(ind./mL) | 自养微型鞭毛虫 | 99±53 | 73±32 | 64±52 |
| 异养微型鞭毛虫 | 257±125 | 72±42 | 96±58 | |
| 丰度(ind./L) | 纤毛虫 | 2282±1477 | 933±727 | 2319±1724 |
| 桡足类无节幼体 | 10.59±9.10 | 8±10.14 | — | |
| 生物量(µgC/L) | 自养微型鞭毛虫 | 1.19±1.20 | 1.42±1.03 | 1.34±0.76 |
| 异养微型鞭毛虫 | 2.70±1.62 | 2.04±1.07 | 1.18±1.50 | |
| 纤毛虫 | 8.93±6.23 | 3.92±4.72 | 6.55±5.24 | |
| 桡足类无节幼体 | 0.11±0.09 | 0.08±0.10 | — | |
| 生产力(μgC/(L·d)) | 纤毛虫 | 12.74±7.86 | 7.39±7.24 | 7.79±5.92 |
| 桡足类无节幼体 | 0.028±0.024 | 0.032±0.041 | — |
纤毛虫6月份的生物量为(8.93±6.23)µgC/L(图 2,表 2),其中E、G和I断面生物量分别为(7.34± 4.12)、(9.96±8.88)和(10.46±6.86)µgC/L; 最低值出现于G2站(0.71µgC/L),最高值出现于G5站(24.18µgC/L)。8月份生物量急剧降低,仅为(3.92± 4.72)µgC/L,其中E、G和I断面生物量分别为(4.05± 1.43)、(3.36±1.49)和(4.34±7.26)µgC/L; 最低值出现于I3站(0.50µgC/L),最高值出现于I2站(17.22µgC/L)。9月份尽管丰度达到最高,但生物量仅升至(6.55± 5.24)µgC/L,其中E、G和I断面生物量分别为(3.67± 2.50)、(10.88±7.29)和(6.26±3.03)µgC/L; 最低值出现于G3站(0.94µgC/L),最高值出现于G6站(20.76µgC/L)。
纤毛虫6月份的生产力为(12.74±7.86)μgC/(L·d)(图 2,表 2),其中E、G和I断面生产力分别为(11.15±5.30)、(12.74±10.93)和(15.30±8.99)μgC/(L·d); 最低值出现于E1站2.92μgC/(L·d),最高值出现于G5站30.11μgC/(L·d)。8月份生产力降为(7.39± 7.24)μgC/(L·d),其中 E、G和I断面生产力分别为(8.51±5.60)、(6.37±7.62)和(7.28±9.54)μgC/(L·d); 最低值出现于I4站1.37μgC/(L·d),最高值出现于I2站,达23.74μgC/(L·d)。9月份的生产力为(7.79±5.92)μgC/(L·d),其中E、G和I断面生产力分别为(3.63±2.59)、(11.54± 7.70)和(9.88±4.18)μgC/(L·d); 最低值出现于G3站0.95μgC/(L·d),最高值出现于G6站21.14μgC/(L·d)。
总体上,6月、8月和9月份三次调查中,E、G和I断面的纤毛虫丰度与生物量呈先减少后增加的趋势(图 2,图 3,表 2)。无壳类纤毛虫丰度在6月份略高于9月,但明显较8月高; 生物量在6月明显高于9月,但最高生物量出现在9月份的G断面,8月同样最低。砂壳类纤毛虫丰度自6月到9月呈增加趋势,从北部的E断面到南部的I断面呈增加趋势,I断面在三个月份均为最高; 在生物量上,G断面8月份和9月份丰度一致,在I断面8月份和9月份均升高。砂壳类8月份在E、G断面明显高于其它月份,而在I断面则明显降低,9月份I断面的生物量仍然最高。
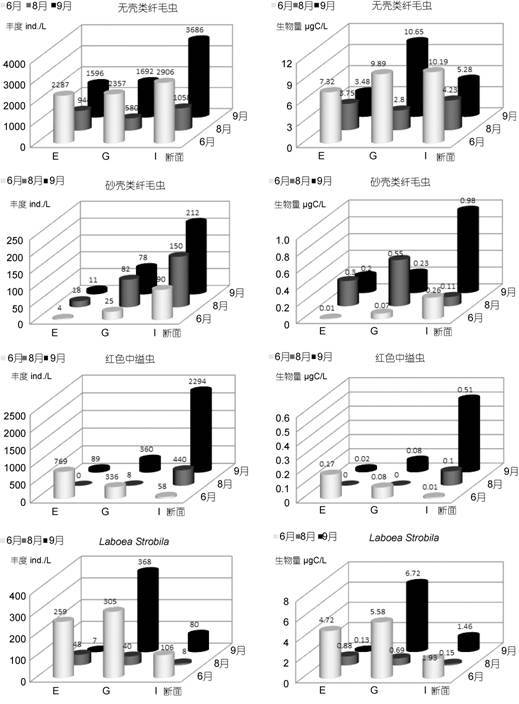 |
| 图 3 6月、8月和9月不同类群的纤毛虫在E、G和I断面的丰度和生物量 Fig. 3 Abundance and biomass of different ciliate assemblages at transects E,G,and I in June,August,and September |
6月微型鞭毛虫总丰度(357±171)ind./mL,总生物量(3.92±2.44)µgC/L。微型自养鞭毛虫(PNF,phototrophicnanoflagellates)丰度(99±53)ind./mL,生物量(1.19± 1.20)µgC/L。微型异养鞭毛虫(HNF,heterotrophic nanoflagellates)丰度(257±125)ind./mL,生物量(2.70± 1.62)µgC/L(图 4,图 5,表 2)。
 |
| 图 4 6月、8月和9月E,G和I断面全部微型鞭毛虫的丰度和生物量分布 Fig. 4 Abundance and biomass of total nanoflagellates at transects E,G,and I in June,August,and September |
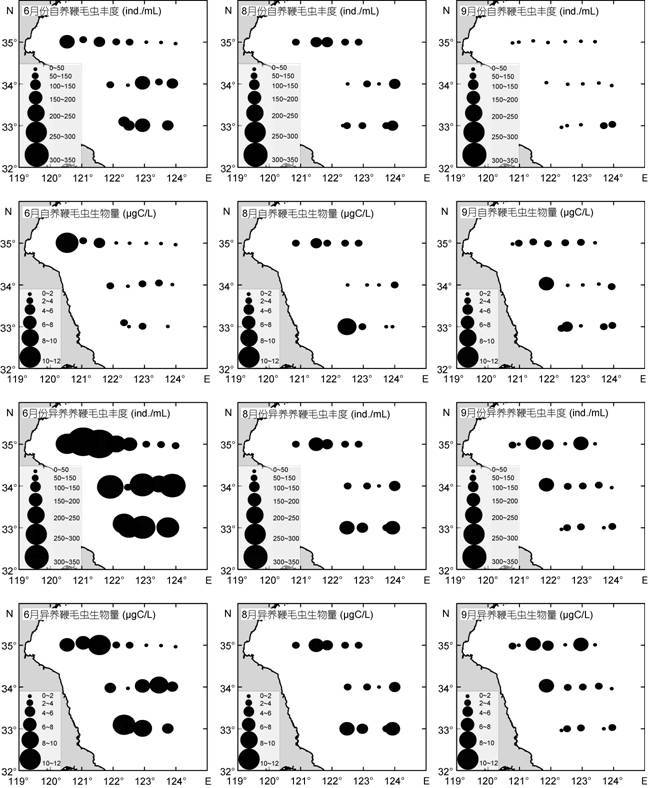 |
| 图 5 6月、8月和9月E,G和I断面自养和异样微型鞭毛虫的丰度和生物量分布 Fig. 5 Abundance and biomass of PNF and HNF at transects E,G,and I in June,August,and September |
8月微型鞭毛虫总丰度(145±70)ind./mL,总生物量(2.55±1.35)µgC/L。PNF丰度(73±32)ind./mL,生物量(1.42±1.03)µgC/L。HNF丰度(72±42)ind./mL,生物量(2.04±1.07)µgC/L(图 4,图 5,表 2)。
9月微型鞭毛虫总丰度(160±91)ind./mL,总生物量(2.84±1.57)µgC/L。PNF丰度(64±52)ind./mL,生物量(1.34±0.76)µgC/L。HNF丰度(96±58)ind./mL,生物量(1.18±1.50)µgC/L(图 4,图 5,表 2)。
2.4 桡足类无节幼体丰度、生物量和生产力桡足类无节幼体仅见于6月和8月,9月份未检出。6月份的平均丰度为(10.59±9.10)ind./L,平均生物量(0.11±0.09)µgC/L; 丰度(26ind./L)和生物量(0.27µgC/L)的最高值均出现在E2站(图 6,表 2)。
 |
| 图 6 6月和8月份E,G和I断面桡足类无节幼体和夜光虫的丰度和生物量分布 Fig. 6 Abundance and biomass of copepod nauplii and Noctiluca scintillans at transects E,G,and I in June and August |
8月份的平均丰度为(8±10.14)ind./L,平均生物量(0.08±0.10)µgC/L,I断面未检出桡足类无节幼体; 丰度(30ind./L)和生物量(0.31µgC/L)最高值均出现在G5站。
桡足类无节幼体6月份的平均生产力为(0.028± 0.024)μgC/(L·d),8月份略增至(0.032±0.041)μgC/(L·d),其中8月份在I断面未检出桡足类无节幼体(表 2)。
2.5 夜光虫丰度和生物量夜光虫在6月份在五个站位检出,最高值2079ind./L出现在G5站; 8月份在I1,I2和I5站检出的夜光虫丰度低于100ind./L,9月份在E6,I3站检出夜光虫丰度低于100ind./L(图 6)。
2.6 统计分析对纤毛虫丰度和生物量、微型鞭毛虫丰度和生物量与表层水温、盐度和水深进行的Spearman相关性分析结果表明,6月微型鞭毛虫的丰度、生物量与盐度分别呈极显著负相关(P=0.004,P=0.002),鞭毛虫生物量与水深显著负相关(P=0.030); 8月份纤毛虫的生物量与温度及微型鞭毛虫的丰度呈显著负相关(P= 0.024,P=0.017); 9月份各因素之间无显著相关性。
对6月、8月和9月份调查站位表层纤毛虫的物种-丰度数据进行聚类分析,纤毛虫的群落分为三组: 6月份为一组,8月份G断面自成一组,8月其它站位和9月各站位一组(图 7)。
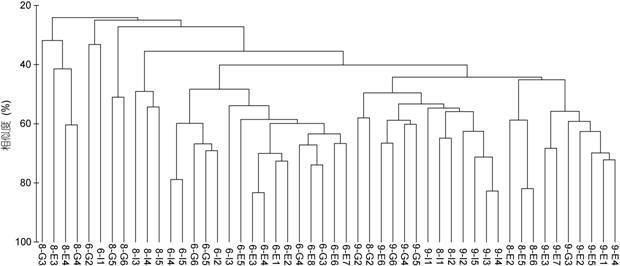 |
| 图 7 6月、8月和9月E,G和I断面的纤毛虫物种-丰度聚类分析结果 Fig. 7 Cluster analysis based on ciliate species-abundance at transects E,G,and I in June,August,and September |
本研究在南黄海E、G和I三个断面所获微型鞭毛虫的丰度和生物量在三次调查中均呈现近岸高远岸低的分布特点,这一结果与丁军军等(2012)在同一海域的研究结果一致。相比丁军军等(2012)8月份在同一海域的调查结果,本调查的自养和异养微型鞭毛虫的丰度和生物量明显较低。本调查8月份所获的微型异养鞭毛虫丰度明显较6月份少,但生物量变化不大,这说明8月份个体较大的异养微型鞭毛虫较多; 9月份较8月份的丰度变化不大,但生物量仅约为8月份的一半,表明9月份小个体的微型鞭毛虫更占优势。统计分析表明,6月份微型鞭毛虫的丰度和生物量均与盐度呈极显著的负相关关系,近岸和南部的站位可能受到降水及长江冲淡水的影响,盐度较离岸海域低,低盐水可能带来了丰富的营养物质,因此促进了微型鞭毛虫尤其是异养微型鞭毛虫的生长和繁殖。
纤毛虫的丰度和生物量也呈现与鞭毛虫类似的结果: 与王璐(2013)对2012年和丁军军等(2012)对2011年同一海域的纤毛虫分析结果相比,2013年6月表层纤毛虫的丰度仅是2012年6月份的1/3,生物量约为2012年6月的1/2; 2013年8月份纤毛虫生物量仅是2012年8月的不足1/3,不足2011年的1/2(表 3)。桡足类无节幼体的丰度与生物量则未见大的变化,与Zhang等(2002)在同一海域及Yang等(2008)在北黄海的研究结果一致,生产力与Wang等(2013)在同一海域研究结果一致。夜光虫在6月部分站位丰度较8月和9月丰度高,可能系温度升高至25℃以上时,不适于夜光虫生长(齐雨藻等,1991; Huang et al,1997)。
| 时间 | 丰度(ind./L) | 生物量(µgC/L) | 生产力(μgC/(L·d)) | 参考文献 |
| 2013年6月 | 2282±1477 | 8.93±6.23 | 12.74±7.86 | 本研究 |
| 2013年8月 | 933±727 | 3.92±4.72 | 7.39±7.24 | 本研究 |
| 2013年9月 | 2319±1724 | 6.55±5.24 | 7.79±5.92 | 本研究 |
| 2011年4月 | 3160±2502 | 14.49±15.14 | — | 丁军军等(2012) |
| 2011年8月 | 1570±1050 | 8.68±11.68 | — | 丁军军等(2012) |
| 2012年6月 | 6178±6302 | 18.66±20.10 | 28.05±26.34 | 王璐(2013) |
| 2012年8月 | 6265±9100 | 12.09±22.47 | 54.01±30.53 | 王璐(2013) |
8月份纤毛虫的生物量和微型鞭毛虫的丰度呈现负相关关系,显示纤毛虫可能对微型鞭毛虫具有一定的摄食控制。丁军军等(2012)于2011年8月份在同一海域的研究发现,纤毛虫的丰度和温度呈极显著的正相关关系,而本研究8月份的纤毛虫生物量与温度呈现了负相关关系。从表层水温上看,本研究8月份同一海域的水温较2011年8月的水温高了4℃[(27.83±0.99)℃ vs.(23.7±1.6)℃]。我们目前尚无法解释是何种因素造成这种差异,以及水温是否是因素之一。
2013年6月份首先在黄海的G和I断面发现有数量较多的沙海蜇出现,E断面仅E3站位有极少量的沙海蜇。8月份沙海蜇在所研究的三个断面均大量出现,9月份沙海蜇的生物量在E断面的个别站位较8月翻倍,其它站位仅略有增加(Sun et al,2015)。在这三个月份中,E、G、I断面的纤毛虫丰度与生物量呈现先骤减后增加的特点(表 1)。但9月份I断面纤毛虫丰度的剧升主要是由于自养的红色中缢虫丰度急剧增加所致,如果排除红色中缢虫,则其它无壳类纤毛虫的丰度9月份仅有平缓的上升。此外,9月份G断面纤毛虫生物量的剧升主要是由于个体较大的旋转螺体虫(Laboea strobila,粒径约92μm)剧增所致,其在G6站的单种丰度超过1000ind./L,9月该断面该种纤毛虫的生物量占了全部纤毛虫生物量的近2/3。隶属寡毛类的Laboea strobila属混合营养(mixotrophy)的纤毛虫,其大量出现一方面可能系因环境适宜其增长,另一方面可能在于,尽管9月份沙海蜇仍然维持了较高的生物量,但已进入生长衰退期,而且沙海蜇的生物量也较E和I断面的小(Sun et al,2015),对纤毛虫的摄食压力减小。Laboea strobila在6月各断面也曾大量出现,分别贡献了E、G和I断面全部纤毛虫生物量的64%、56%和18%。Lee等(2008)通过解剖沙海蜇的摄食器官及通道提出,沙海蜇只能以粒径<1mm的浮游动物为食,我们的前期研究发现(作者未发表),沙海蜇对粒径较小(<20μm)的微型浮游动物并未见明显的摄食控制。因此,Laboea strobila这一相对大型的浮游纤毛虫的高生物量及高生产力可能为沙海蜇的早期发生提供了一定的食物支撑。
相对于8月份E、G和I断面无壳类纤毛虫丰度的剧减,该海域三个断面的砂壳类纤毛虫丰度均逆势增加,生物量在E和G断面也急剧增加; 8月份I断面的砂壳类丰度增加但生物量减少的原因是个体较小(65x20μm)的原始筒壳虫数量较多所致。至9月E和G断面的砂壳类丰度未见明显变化,在I断面甚至还有较大的增加。已有研究表明,水母对砂壳类纤毛虫的摄食强度相对较小(Pitt et al,2007),这可能是由于其具有的外壳的保护作用有关,外壳的保护也使其免遭水母摄食之外的毒杀作用。因此,8月和9月水母旺发期砂壳类纤毛虫数量增加的主要原因应归于沙海蜇对砂壳类的捕食压力或毒杀效应较小所致。另一方面,8月和9月无壳类纤毛虫数量的剧降,使砂壳类纤毛虫面临的种间竞争变小,而沙海蜇的旺发又在一定程度上清除了其捕食者,从而获得数量上的优势。砂壳类纤毛虫的丰度和生物量在9月份水母数量依然较多的I断面达到顶峰,这进一步说明沙海蜇对其摄食强度较低,另外砂壳类纤毛虫多喜食藻类,该断面数量丰富(数量达到峰值)光合自养的红色中缢虫(Mesodinium rubrum,粒径约22μm)为其提供了良好的食物基础。
与纤毛虫丰度和生物量的急剧变化不同,纤毛虫在6月、8月和9月的物种数相差不显著。尽管如此,在水母发生最为旺盛的8月份纤毛虫物种数和Margalef多样性指数仍是最低的,而香农威纳指数和辛普森多样性指数则随时间呈下降趋势,且6月份的指数值明显高于8月和9月。纤毛虫群落结构的聚类分析结果也显示,6月的纤毛虫群落结构与8月和9月的群落结构明显分为两组。这些结果表明,夏季大型水母的旺发对纤毛虫的群落结构产生了影响,纤毛虫生物多样性降低。沙海蜇旺发产生的另一效应是个体较小的光合自养的红色中缢虫的大量出现,其在9月的I3和I4站位丰度超过4000ind./L。其大量发生一方面可能是沙海蜇旺发产生的级联效应所致,另一方面可能系因水母释放的营养物质促进了生长。
从生产力上看,纤毛虫由于其个体微小,繁殖和周转快,因此具有明显的数量优势。在沙海蜇生物量快速增加的6月份,纤毛虫无论在生物量还是生产力上均远高于桡足类无节幼体。在沙海蜇旺发的8月份,桡足类无节幼体的丰度和生物量下降的幅度明显小于纤毛虫,其生产力还略增至0.032μgC/(L·d); 而纤毛虫的生产力由6月的12.74μgC/(L·d)降至8月的7.39μgC/(L·d)(表 1)。从这一结果可以看出,纤毛虫的数量优势可使其较个体数量明显较少的桡足类无节幼体更易为沙海蜇等大型水母所摄食利用,其高生产力可为水母的旺发提供了一定的食物基础。此外,相对于2012年6月(28.05μgC/(L·d))和8月(54.01μgC/(L·d))同一海域纤毛虫的高生产力,2013年6月和8月纤毛虫的生产力无疑是很低的(表 3)。这一点与2013年相同月份沙海蜇的丰度和生物量低于2012年(Sun et al,2015)的结果一致。由此,纤毛虫的生物量到底在多大程度上支撑(甚至决定)了沙海蜇的生物量,将是一个有待解决的问题。
 2016, Vol. 47
2016, Vol. 47


