中国海洋湖沼学会主办。
文章信息
- 郭春阳, 林少珍, 巩建华, 邱成功, 赵淳, 徐善良. 2016.
- GUO Chung-Yang, LIN Shao-Zhen, GONG Jian-Hua, QIU Cheng-Gong, ZHAO Chun, XU Shan-Liang. 2016.
- 褐菖鲉(Sebastiscus marmoratus)受精卵以及仔鱼期氨基酸与脂肪酸变化研究
- COMPOSITION AND VARIATION OF AMINO ACID AND FATTY ACID IN FERTILIZED EGGS AND LARVAE OF SEBASTISCUS MARMORATUS IN DIFFERENT DEVELOPMENTAL STAGES
- 海洋与湖沼, 47(1): 173-181
- Oceanologia et Limnologia Sinica, 47(1): 173-181.
- http://dx.doi.org/10.11693/hyhz20151000273
-
文章历史
- 收稿日期: 2015-10-28
- 收修改稿日期: 2015-12-29
2. 浙江省海洋水产养殖研究所 温州 325000
2. Zhejiang Mariculture Research Institute, Wenzhou 325000, China
鱼类胚胎和仔鱼的质量与卵子的生化组成密切相关,在鱼类胚胎发育和仔鱼发育早期阶段,营养来源于鱼类卵黄所储存的内源性物质(常青,2006)。早期仔鱼从内源性营养转变为外源性营养后,造成早期仔鱼大量死亡主要因为所摄取饵料营养不能满足仔鱼发育需求; 另有研究表明,海水鱼类仔鱼发育中的代谢强度与仔鱼开口时营养需要量密切相关(冯隆峰,2012)。因此,对鱼类胚胎期及仔鱼开口摄食前后营养物质的供给模型研究,有助于了解开口仔鱼的营养需要量(王金燕,2011)。
褐菖鲉(Sebastiscus marmoratus)又称石狗公,在我国产于南海、东海、黄海、渤海,分布于北太平洋西部沿岸。为卵胎生,因其肉质细嫩、放流回捕率高,是海洋牧场、垂钓渔业的最佳品种之一(吴莹莹等,2006)。目前国内外对褐菖鲉已开展了较为广泛的研究(Nakanishi,1986; 石戈等,2007; Konishi et al,2009; 邱成功等,2014),但对褐菖鲉受精卵、前仔鱼、后仔鱼各个阶段的氨基酸和脂肪酸变化尚未见研究报道。本文分析胚胎发育期以及仔鱼期褐菖鲉的氨基酸、脂肪酸组成变化和含量变化,旨在明确褐菖鲉在母体内胚胎发育及开口仔鱼、后仔鱼期对氨基酸和脂肪酸营养的需求模式,为今后褐菖鲉人工培苗中提高育成率提供理论参考。
1 材料与方法 1.1 实验材料实验所用材料取自浙江省海洋水产养殖研究所洞头基地。按受精卵、初产仔鱼、前仔鱼和后仔鱼4个不同发育阶段分别采样。受精卵样品采用解剖已受精的褐菖鲉雌鱼而获得; 初产仔鱼为刚产出6h内的仔鱼; 产出后24h仔鱼开口摄食,前期仔鱼取开口后72h的仔鱼; 5d后进入后仔鱼期,取开口后10d的仔鱼作为后仔鱼期样品。各期样品分别取10—20g,前仔鱼与后仔鱼取样前需饥饿12h,所有样品取样后立即用蒸馏水冲洗,滤纸吸去水分,放入液氮中冷冻,-80℃下保存。
1.2 实验方法 1.2.1 总氨基酸的测定样品用6 mol/L盐酸110℃封管水解24h,然后用超纯水定容,取2mL减压蒸干并在干燥之后加0.02 mol/L的盐酸溶液2mL,将全部氨基酸溶解,用日立835-50型氨基酸自动分析仪进行测试。
1.2.2 游离氨基酸的测定准确称取样品1.0g,加入5%三氯乙酸15mL,定容至25mL,在振荡器上充分混合,沉淀结合态蛋白质,然后10000 r/min 离心10min,用日立835-50型氨基酸自动分析仪测定样品中游离氨基酸。
1.2.3 脂肪酸的测定称取经冷冻干燥后的样品0.1—0.2g,根据Bligh-Dyer法(Bligh et al,1959),将样品经过超声提取2min后并进行漩涡振荡5min,在3000r/min下离心6—8min,最后进行旋转蒸发,直至恒重。用Metcalfe的BF3催化法制取脂肪酸甲脂(Metcalfe et al,1996),首先将以上所得脂质用KOH-甲醇于60℃皂化2h,之后加正己烷1min,用QP2010气相色谱-质谱仪测定分析上清液。脂肪酸的百分含量用面积归一法求出(汪正范,2000)。
1.3 统计分析方法所测数据采用“SPSS version 19.0”软件进行单因素方差分析(one-way ANOVA); 统计间若有显著差异,再用Duncan法进行多重比较,P<0.05表示差异显著。试验数据以平均值±标准差表示。
2 结果与分析 2.1 氨基酸组成及变化 2.1.1 总氨基酸组成测得受精卵、初产仔鱼和前、后期仔鱼的氨基酸含量列于表 1,包括必需氨基酸和非必需氨基酸各9种。从总必需氨基酸含量看,以受精卵最高为302.82mg/g,至初产仔鱼呈显著下降(P<0.05),前期仔鱼又显著上升(P<0.05),至后期仔鱼时再次呈显著下降(P<0.05); 其中甲硫氨酸、异亮氨酸、苯丙氨酸和亮氨酸含量的变化趋势与总必需氨基酸变化趋势完全一致; 而赖氨酸则以初产仔鱼阶段最高,比受精卵显著增加了3倍(P<0.05),至前、后期仔鱼呈显著下跌(P<0.05); 缬氨酸、苏氨酸和精氨酸的含量,受精卵显著高于各期仔鱼,但仔鱼期含量基本保持稳定。
| 氨基酸 | 受精卵 | 初产仔鱼 | 前期仔鱼 | 后期仔鱼 |
| 必需氨基酸Essential | ||||
| 甲硫氨酸Met | 32.23±1.07a | 19.07±0.93c | 21.43±1.29b | 18.20±0.56c |
| 赖氨酸Lys | 4.07±0.70c | 14.20±1.42a | 0 | 7.73±1.19b |
| 缬氨酸Val | 40.01±3.06a | 24.83±1.99b | 25.53±1.42b | 23.00±0.10b |
| 异亮氨酸Ile | 35.17±1.05a | 18.93±1.29c | 21.13±0.93b | 19.80±1.05bc |
| 苯丙氨酸Phe | 37.33±6.30a | 23.47±2.79c | 32.07±1.06ab | 26.03±1.02bc |
| 亮氨酸Leu | 57.70±8.71b | 31.73±1.04c | 84.73±2.42a | 30.43±1.17c |
| 苏氨酸Thr | 37.87±4.54a | 27.40±2.10b | 28.60±1.37b | 25.63±0.95b |
| 精氨酸Arg | 42.50±0.69a | 36.23±1.74b | 35.20±3.10b | 44.60±0.62a |
| 组氨酸His | 15.07±1.24 | 15.17±0.96 | 15.57±1.42 | 13.70±0.17 |
| 色氨酸Trp | 0.41±0.05d | 6.59±0.35b | 4.62±0.34c | 7.98±0.25a |
| 必需氨基酸总和Sumessential | 302.82±15.76a | 224.22±9.40c | 273.50±0.88b | 224.97±4.42c |
| 非必需氨基酸Non-essential | ||||
| 羟基脯氨酸Hyp | 0 | 0.80±0.17b | 1.13±0.29ab | 1.27±0.31a |
| 丙氨酸Ala | 22.80±1.47a | 11.40±1.04b | 11.07±1.59b | 11.03±1.86b |
| 脯氨酸Pro | 16.70±3.40a | 11.53±1.19b | 15.27±0.83a | 15.40±0.78a |
| 丝氨酸Ser | 32.80±1.54a | 26.27±2.18b | 34.47±1.82a | 25.63±0.95b |
| 谷氨酸Glu | 21.03±1.37a | 24.53±1.74a | 21.93±1.40a | 23.50±2.82a |
| 酪氨酸Tyr | 13.38±0.99a | 7.97±1.21b | 8.50±1.08b | 7.20±0.46b |
| 天门冬氨酸Asp | 14.60±0.52b | 22.00±1.95a | 21.10±1.05a | 20.87±0.67a |
| 甘氨酸Gly | 13.30±1.05c | 19.07±1.65b | 22.07±1.00a | 18.63±0.95b |
| 半胱氨酸Cys | 0.37±0.12b | 1.20±0.52a | 1.20±0.44a | 0.70±0.17ab |
| 非必需氨基酸总和Sumnon-essential | 135.43±4.35a | 124.77±3.41b | 136.73±0.70a | 124.23±1.74b |
| 总和Sumfreeamionacids | 438.25±19.97a | 348.99±12.80c | 401.23±0.81b | 349.20±2.72c |
| 注: 同行数据肩注不同字母表示有显著性差异(P<0.05)。下表同 | ||||
在非必需氨基酸中,总非必需氨基酸在受精卵含量为135.43mg/g,至初产仔鱼显著下降(P<0.05),仔鱼开口摄食后的前期仔鱼又显著回升至136.73mg/g(P<0.05),后仔鱼期再次显著下降(P<0.05)。丙氨酸、酪氨酸的含量以受精卵最高,是仔鱼的2倍左右,仔鱼阶段无显著变化。而羟基脯氨酸、天门冬氨酸的含量变化则相反,受精卵中不含羟基脯氨酸,天门冬氨酸含量最低,仔鱼显著上升(P<0.05),是受精卵含量的1.5倍; 脯氨酸和丝氨酸的含量从受精卵至前期仔鱼呈先显著下降再上升的趋势(P<0.05),甘氨酸和半胱氨酸则表现从受精卵至后期仔鱼呈先显著上升再下降的趋势(P<0.05)。只有谷氨酸的含量在褐菖鲉早期发育各阶段中无显著变化(P>0.05)。
2.1.2 游离氨基酸组成从受精卵到后期仔鱼各阶段游离氨基酸的含量列于表 2。可以看出,游离氨基酸含量在各发育阶段的变化急剧程度远远大于总氨基酸含量,受精卵的游离氨基酸含量为6.31mg/g,初产仔鱼骤升了10倍,至前仔鱼期又下降42%,后仔鱼期再次上升至54.85mg/g。在必需游离氨基酸中,所有必需游离氨基酸从受精卵到初产仔鱼阶段均呈显著升高(P<0.05),而从初产仔鱼到前期仔鱼阶段有显著下降的趋势(P<0.05),前期仔鱼至后期仔鱼阶段中除缬氨酸含量又呈显著递增(P<0.05)。从受精卵至初产仔鱼阶段中必需游离氨基酸的含量除缬氨酸外显著升高(P<0.05),缬氨酸从初产仔鱼至后期仔鱼阶段却显著下降(P<0.05)。在非必需游离氨基酸中,所有游离氨基酸的含量从受精卵到初产仔鱼均显著升高(P<0.05); 除天门冬氨酸从初产仔鱼至后期仔鱼阶段始终无显著变化(P>0.05),其它氨基酸的含量从初产仔鱼至前期仔鱼阶段都呈显著降低(P<0.05),前期仔鱼至后期仔鱼阶段,谷氨酸、甘氨酸和半胱氨酸的含量也无明显变化,其余氨基酸的含量再次呈升高趋势(P<0.05)。表 2中还可见,褐菖鲉游离氨基酸/总氨基酸的比值范围为1.4%—20.0%。
| 氨基酸 | 受精卵 | 初产仔鱼 | 前期仔鱼 | 后期仔鱼 |
| 必需氨基酸Essential | ||||
| 甲硫氨酸Met | 0.04±0.01d | 4.33±0.16a | 2.06±0.44c | 2.71±0.10b |
| 赖氨酸Lys | 2.91±0.02c | 7.75±0.07a | 2.72±0.14d | 7.10±0.09b |
| 缬氨酸Val | 0.16±0.05c | 2.44±0.06a | 1.42±0.05b | 2.60±0.23c |
| 异亮氨酸Ile | 0.13±0.02d | 1.86±0.07b | 1.38±0.10c | 2.19±0.05a |
| 苯丙氨酸Phe | 0.06±0.02d | 3.26±0.12b | 2.19±0.09c | 3.73±0.06a |
| 亮氨酸Leu | 0.25±0.02d | 5.19±0.05a | 3.83±0.02c | 4.38±0.09b |
| 苏氨酸Thr | 0.23±0.05d | 4.03±0.06a | 2.03±0.05c | 2.60±0.16b |
| 精氨酸Arg | 0.40±0.02d | 3.63±0.06a | 1.89±0.09c | 2.55±0.06b |
| 组氨酸His | 0.58±0.09d | 6.03±0.10b | 4.32±0.96c | 7.39±0.30a |
| 必需氨基酸总和Sumessential | 4.77±0.07d | 38.51±0.04a | 21.84±0.92c | 35.25±0.17b |
| 非必需氨基酸Non-essential | ||||
| 羟基脯氨酸Hyp | 0 | 0.04±0.01a | 0.02±0.01b | 0.03±0.01ab |
| 丙氨酸Ala | 0.27±0.02d | 6.15±0.06a | 3.74±0.05c | 3.93±0.06b |
| 脯氨酸Pro | 0.06±0.02d | 1.04±0.11b | 0.90±0.07c | 1.19±0.06a |
| 丝氨酸Ser | 0.80±0.09d | 5.70±0.11a | 3.36±0.02c | 4.10±0.02b |
| 谷氨酸Glu | 0.17±0.03c | 4.47±0.05a | 3.03±0.13b | 3.12±0.10b |
| 酪氨酸Tyr | 0.12±0.03d | 3.50±0.03a | 2.20±0.04c | 3.2±0.06b |
| 天门冬氨酸Asp | 0.05±0.01b | 1.55±0.08a | 0.91±0.05a | 1.04±0.90a |
| 甘氨酸Gly | 0.10±0.02c | 3.93±0.09a | 1.55±0.06b | 1.48±0.11b |
| 半胱氨酸Cys | 0 | 0.10±0.01a | 0.04±0.02b | 0.05±0.02b |
| 非必需氨基酸总和Sumnon-essential | 1.54±0.15d | 28.62±0.32a | 17.64±0.15c | 19.60±0.24b |
| 总和Sumfreeamionacids | 6.31±0.17d | 67.14±0.29a | 39.48±0.81c | 54.85±0.41b |
| 游离氨基酸/总氨基酸 | 0.01 | 0.02 | 0.10 | 0.16 |
表 3为褐菖鲉各阶段总脂的含量,从褐菖鲉受精卵至初产仔鱼,总脂的绝对含量由受精卵的332.52mg/g急剧跌至114.81mg/g,这可能是因为脂肪作为其能量的主要来源; 从初产仔鱼至前期仔鱼阶段因摄食轮虫总脂的含量迅速升至274.24mg/g,至摄食轮虫与丰年虫的后期仔鱼阶段升至366.85mg/g。
| 发育阶段 | 受精卵 | 初产仔鱼 | 前期仔鱼 | 后期仔鱼 |
| 总脂含量 | 332.52±12.37b | 114.81±9.75d | 274.24±10.41c | 366.85±16.32a |
表 4为褐菖鲉各阶段脂肪酸的百分比组成,其中共检测出脂肪酸26种,这些脂肪酸的起始碳链长度在14碳至24碳之间。在这些脂肪酸中,饱和脂肪酸(SFA)有14种,单不饱和脂肪酸(MUFA)和多不饱和
| 脂肪酸 | 受精卵 | 初产仔鱼 | 前期仔鱼 | 后期仔鱼 |
| C14:0 | 1.70±0.13b | 3.93±0.62a | 2.05±0.10b | 0.73±0.18c |
| 9-M-C15:0 | 0.11±0.02b | 0.16±0.03b | 0.14±0.02b | 0.40±0.14a |
| 12-M-C15:0 | 0.02±0.00b | 0.70±0.12a | 0.03±0.01b | 0.04±0.01b |
| C15:0 | 0.19±0.01d | 1.04±0.07a | 0.57±0.09c | 0.42±0.05b |
| 14-M-C16:0 | 0.09±0.01d | 0.48±0.04a | 0.34±0.09c | 0.22±0.03b |
| C16:0 | 20.67±0.54a | 16.28±0.56b | 15.06±0.33c | 13.39±0.43d |
| C16:1n-7 | 6.35±0.46b | 0.01±0.00c | 0 | 7.13±0.33a |
| 15-M-C17:0 | 0.27±0.04c | 0.47±0.04b | 0.33±0.03c | 0.72±0.05a |
| 14-M-C17:0 | 0.06±0.01c | 0.31±0.03a | 0.16±0.05b | 0.13±0.04b |
| C17:0 | 1.42±0.10a | 0.94±0.08b | 0.93±0.08b | 0.93±0.08b |
| 9,10-CP-C17:0 | 0.01±0.00a | 0 | 0 | 0 |
| C18:0 | 6.94±0.12b | 5.70±0.33c | 13.30±0.21a | 13.06±0.27a |
| C18:1n-9 | 12.40±0.53c | 11.04±0.08d | 14.43±0.46b | 19.31±0.39a |
| C18:1n-7 | 3.61±0.05c | 5.03±0.06b | 4.80±0.10b | 6.75±0.18a |
| C18:2n-6 | 0.99±0.03c | 0.83±0.07d | 1.74±0.10a | 1.56±0.08b |
| C18:3n-6 | 0.07±0.01c | 0.23±0.06b | 0.34±0.02a | 0.33±0.02a |
| C18:3n-3 | 0.64±0.02b | 0.48±0.04c | 0.59±0.03b | 2.09±0.10a |
| C19:0 | 0 | 0.39±0.02a | 0.36±0.03a | 0.01±0.00b |
| C20:0 | 0.21±0.02c | 0.72±0.03a | 0.53±0.06b | 0.52±0.04b |
| C20:1n-9 | 0.29±0.02d | 0.73±0.04c | 0.81±0.01b | 1.70±0.02a |
| C20:4n-6 | 3.75±0.16c | 4.17±0.16bc | 6.27±0.37a | 4.50±0.50b |
| C20:5n-3 | 8.19±0.33b | 8.25±0.21b | 9.58±0.50a | 9.22±0.36a |
| C22:0 | 0.02±0.00c | 0.01±0.00c | 0.07±0.01b | 0.71±0.05a |
| C22:1n-9 | 0.16±0.02c | 0.22±0.03c | 0.42±0.09b | 0.61±0.08a |
| C22:6n-3 | 31.54±1.43b | 37.31±0.59a | 26.53±0.23c | 15.57±0.52d |
| C24:1n-9 | 0 | 0 | 0.14±0.02a | 0 |
| ∑n-3PUFA | 39.73±1.60b | 45.56±0.39a | 36.11±0.56c | 24.79±0.87d |
| ∑n-6PUFA | 3.75±0.16c | 4.17±0.16bc | 6.27±0.37a | 4.50±0.49b |
| ∑SFA | 31.71±0.55b | 31.12±0.57b | 33.86±0.37a | 31.30±0.51b |
| ∑MUFA | 22.81±0.94b | 17.03±0.09d | 20.68±0.53c | 35.50±0.34a |
| ∑PUFA | 45.18±1.70b | 51.27±0.35a | 45.05±0.37b | 33.27±1.31c |
| ∑DHA+EPA | 39.73±1.61b | 45.56±1.29a | 36.11±0.56c | 24.79±1.07d |
| EPA/DHA | 25.97% | 22.11% | 36.11% | 59.22% |
脂肪酸(PUFA)均各有6种。前期仔鱼的∑SFA最高,为33.86%(P<0.05),SFA中百分含量居前两位的是C16:0(软脂酸)和C18:0(硬脂酸),C16:0在受精卵含量最高,为20.67%,随着仔鱼发育百分含量不断下降,至后期仔鱼显著下降为13.39%(P<0.05); C18:0则不同,受精卵至初产仔鱼阶段显著下降,但开口后又显著上升为受精卵含量的2倍; ∑MUFA表现为从受精卵至前仔鱼期显著降低,后期仔鱼又显著升高(P<0.05),其中以C18:1 n-9(油酸)含量最高,受精卵为12.4%,初产仔鱼下降至11.4%,前仔鱼期开始迅速上升,后期仔鱼含量是受精卵的1.5倍。∑PUFA比例占33.27%—51.27%,在前三个阶段占绝对优势,但后期仔鱼阶段∑SFA、∑MUFA和∑PUFA各占1/3。PUFA中DHA高达15.57%—37.31%,其次是EPA保持在8.19%—9.58%,第三位的是ARA(花生四烯酸),占3.75%—6.27%。
由总脂含量计算得到几种重要脂肪酸的实际含量见表 5。由表 5可知,在褐菖鲉发育早期的各个阶段,这17种重要的脂肪酸中DHA的实际含量最高,在受精卵至初产仔鱼不断下降,而到了开口摄食阶段后立即呈显著回升趋势(P<0.05),多数脂肪酸升至峰值,这与其它10种脂肪酸变化规律完全相同。也有C18:3n-6、C20:1n-9、C20:5n-3、C22:0、C22:1n-9和C24:1n-9等6种重要的脂肪酸从受精卵至初产仔鱼阶段均无明显变化,但开口摄食后立即出现显著上升(P<0.05),且多数升至峰值。C16:1n-7从受精卵至前期仔鱼阶段均无明显变化,但从后期仔鱼开始显著上升(P<0.05)。
| 脂肪酸 | 受精卵 | 初产仔鱼 | 前期仔鱼 | 后期仔鱼 |
| C16:0 | 68.74±1.78a | 18.69±0.64d | 41.31±3.14c | 49.13±4.23b |
| C16:1n-7 | 21.10±1.54b | 0.01±0.00c | 0 | 26.17±1.22a |
| C17:0 | 4.73±0.32a | 1.08±0.09d | 2.54±0.27c | 3.41±0.29b |
| C18:0 | 23.07±0.38c | 6.54±0.48d | 36.46±2.35b | 47.91±1.34a |
| C18:1n-9 | 41.23±5.80b | 12.67±0.09c | 39.58±1.25b | 70.84±1.45a |
| C18:1n-7 | 11.99±0.16b | 5.77±0.29c | 13.16±0.87b | 24.76±0.88a |
| C18:2n-6 | 3.28±0.40c | 0.95±0.08d | 4.76±0.27b | 5.74±0.29a |
| C18:3n-6 | 0.23±0.04c | 0.26±0.06c | 0.93±0.06b | 1.21±0.04a |
| C18:3n-3 | 2.12±0.34b | 0.55±0.04c | 1.61±0.30b | 7.67±0.50a |
| C20:0 | 0.69±0.10c | 0.83±0.09c | 1.46±0.11b | 1.92±0.21a |
| C20:1n-9 | 0.97±0.05c | 0.84±0.05c | 2.23±0.27b | 6.22±0.43a |
| C20:4n-6 | 12.48±0.85b | 4.79±0.28c | 17.20±1.00a | 16.49±3.22a |
| C20:5n-3 | 27.23±1.11b | 9.48±0.93c | 26.27±1.51b | 33.81±2.02a |
| C22:0 | 0.05±0.01bc | 0.01±0.00c | 0.19±0.06b | 2.62±0.17a |
| C22:1n-9 | 0.54±0.14c | 0.25±0.08c | 1.16±0.24b | 2.24±0.29a |
| C22:6n-3 | 104.88±4.76a | 42.83±0.68d | 72.76±3.03b | 57.13±1.91c |
| C24:1n-9 | 0 | 0 | 0.38±0.01c | 0.01±0.00a |
| ∑n-3PUFA | 134.24±5.47a | 52.86±1.45c | 100.64±1.79b | 98.61±4.25b |
| ∑n-6PUFA | 15.99±0.50b | 6.01±0.19c | 22.89±0.94a | 23.44±3.49a |
| ∑SFA | 105.40±1.80b | 36.02±0.74d | 92.87±0.73c | 114.83±3.89a |
| ∑MUFA | 75.85±4.859b | 19.55±0.44d | 56.52±1.41c | 130.24±1.23a |
| ∑PUFA | 150.23±5.75a | 58.86±1.49c | 123.54±1.54b | 122.05±5.08b |
| ∑DHA+EPA | 132.11±5.34a | 52.31±1.48d | 99.04±1.55b | 90.94±3.91c |
| EPA/DHA | 0.26 | 0.22 | 0.36 | 0.59 |
褐菖鲉受精卵中的脂肪酸以PUFA和SFA为主,分别为150.23 mg/g和105.40 mg/g,MUFA稍低,为75.85 mg/g。就单个脂肪酸而言,以DHA、C16:0两者含量最高,分别为104.88 mg/g和68.74 mg/g; C18:1n-9和EPA次之,分别为41.23 mg/g和27.23 mg/g; 初产仔鱼尚未开口摄食,此时脂肪酸的实际含量急剧显著下降(P<0.05),∑SFA、∑MUFA和∑PUFA分别跌至36.02、19.55和58.86 mg/g,主要表现为DHA、C16:0、C18:1n-9、EPA、C18:0和C16:1n-7显著下降(P<0.05); 因为开始摄食轮虫,前期仔鱼脂肪酸的含量出现显著回升(P<0.05),∑SFA、∑MUFA和∑PUFA分别比初产仔鱼升高1.6倍、1.9倍和1.1倍,其中C16:0、C18:0分别升高1.2倍和5.6倍,同时,DHA、EPA和ARA含量也迅速上升至72.76、26.27和17.20 mg/g; 后期仔鱼以摄食卤虫为主,∑MUFA和∑SFA含量继续显著增加(P<0.05),尤其是∑MUFA含量比前期仔鱼增加了1.3倍,此时,17种重要脂肪酸中的∑SFA、∑MUFA和∑PUFA的实际含量分别是114.83、130.24、122.05 mg/g,三者约各占1/3。
由表 5计算得图 1、图 2。∑SFA、∑MUFA、∑PUFA之间的比值,以及∑n-3 PUFA与∑n-6 PUFA比值变化见图 1,褐菖鲉从受精卵至初产仔鱼阶段,∑SFA/ ∑MUFA及∑PUFA/∑MUFA 比值显著升高(P<0.05),说明MUFA相对于SFA和PUFA被选择性消耗,又因
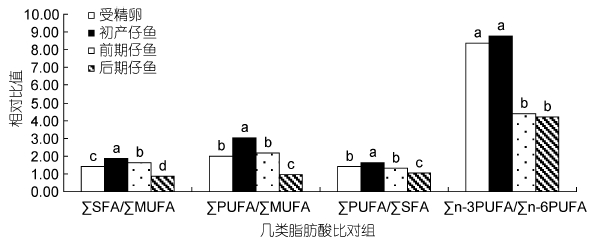 |
| 图 1 褐菖鲉胚胎及仔鱼发育中几类重要脂肪酸相对比值的变化 Fig. 1 Changes in relative ratio among essential fatty acids in developmental egg and larvae of S. marmoratus 同一组标注不同字母表示有显著性差异(P<0.05)。下同 |
为∑PUFA/∑SFA比值也显著升高(P<0.05),说明SFA相对于PUFA被选择性消耗,所以在受精卵至初产仔鱼阶段脂肪酸选择性消耗次序为MUFA > SFA > PUFA。而从初产仔鱼至后期仔鱼阶段,上述三个比值却呈显著降低(P<0.05),说明此阶段利用次序为PUFA > SFA > MUFA。在PUFA中,∑n-3 PUFA/∑n-6 PUFA在褐菖鲉受精卵至初产仔鱼以及前期仔鱼至后期仔鱼阶段无显著变化(P>0.05),但在初产仔鱼至前期仔鱼阶段却显著下降(P<0.05)。说明在这一阶段中,∑n-3 PUFA相对∑n-6 PUFA被机体选择性消耗。
由图 2可知,从受精卵至后期仔鱼的C16:0/C18:0比值下降,反映了SFA中的C18:0相对得到保留,而C16:0被选择性消耗。同样在主要的MUFA中,C16:1/C18:1变化反映出从受精卵至初产仔鱼阶段,C16:1被选择性大量消耗,而从前期仔鱼至后期仔鱼阶段,比值显著上升(P<0.05),则此阶段C18:1被选择性消耗。DHA/EPA比值在受精卵至初产仔鱼显著升高,此后比值显著降低(P<0.05)。从初产仔鱼至前期仔鱼阶段,EPA/ARA与DHA/ARA显著降低(P<0.05),反映在此阶段中EPA和DHA相对ARA被选择性消耗,且DHA相对EPA消耗更甚。而前期仔鱼至后期仔鱼阶段,EPA/ARA显著升高(P<0.05),DHA/ARA则变化不显著(P>0.05),这说明在此阶段ARA相对EPA被选择性消耗。
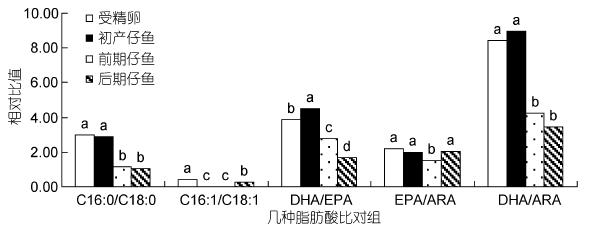 |
| 图 2 褐菖鲉胚胎及仔鱼发育中几种重要脂肪酸的相对比值变化 Fig. 2 Changes in relative ratio among essential fatty acids in developmental egg and larvae of S. marmoratus |
很多海水硬骨鱼类的卵子中有一个或者数个油球,为浮性卵,林丹军等(2002)却发现褐菖鲉卵子虽含有1个较大的油球,但其为沉性卵。另据研究认为,海洋鱼类浮性卵的游离氨基酸含量为总氨基酸含量的20%—50%而沉性卵仅为2%—3%(Rønnestad et al,1993)。由表 2已知,褐菖鲉的受精卵中游离氨基酸/总氨基酸值为1.4%,因褐菖鲉属于卵胎生鱼类,具有其特殊性,故其比值接近沉性卵而低于沉性卵。
褐菖鲉从受精卵到初产仔鱼时总氨基酸含量显著下降了23.23%(P<0.05),必需氨基酸总和、非必需氨基酸总和也分别下降了30.13%和7.83%,这与半滑舌鳎(Cynoglossus semilaevis)的报道类似(常青等,2007)。褐菖鲉的受精卵在母体内完成胚胎发育,孵化出膜后继续在卵巢液中发育至开口,当卵黄囊将要耗尽时才由母体内产出,在母体内的这个过程中胚胎和仔鱼消耗了卵黄囊中的大量能量与营养物质。因此,初产仔鱼所含的氨基酸总量呈显著降低。随着仔鱼开口摄食,前期仔鱼开始获得外源营养,故其体内的总氨基酸也迅速积累。但是随着仔鱼的快速生长,代谢活动不仅要消耗大量的能量物质,各个器官组织的发育也需要大量的氨基酸用于身体结构蛋白的合成,可能是由于摄入的蛋白质跟不上鱼体对氨基酸的需求,因而出现了后期仔鱼中的总氨基酸含量暂时下跌的现象。
从游离氨基酸总量看,初产仔鱼的含量是受精卵的10倍,前期仔鱼又显著下降了41.20%,游离氨基酸占总氨基酸比值也表明,在受精卵发育阶段游离氨基酸被大量利用,使游离氨基酸含量降到谷底。至初产仔鱼随着水解氨基酸总量下降,但游离氨基酸迅速上升,这与六带牙鯻(Pelates sexlineatus)、半滑舌鳎的游离氨基酸含量从受精卵到卵黄囊仔鱼再到初产仔鱼一直降低的研究结果差异较大(Brown et al,2005; 常青等,2007)。但却与大西洋鲑鱼(Salmo salar)(Srivastava et al,1995)以及硬头鳟(Salmo gairdneri)(徐绍刚等,2011)的研究结果一致。有报道指出海水仔鱼受精卵发育到开口仔鱼期间,游离氨基酸的总和持续下降,但是有的种类在卵和卵黄囊两个阶段都有发生,而有的种类在二者中的一个阶段中发生。褐菖鲉孵化后1d便可以看到摄食现象,卵黄囊体积减小,消化道也已分化。由此可见,褐菖鲉游离氨基酸的消耗主要发生在受精卵阶段,而在摄食后的消耗相对较少。在胚胎发育中游离氨基酸的主要作用是参加鱼体蛋白的合成以及作为能源被分解利用,而氧化分解代谢基质的模式又根据鱼的受精卵是否具有油球而异,对于具有油球的受精卵,50%的能量来自氨基酸的分解代谢(主要是游离氨基酸,但当其耗尽则分解蛋白质),50%的能量来自中性脂如蜡酯和甘油三酯的分解代谢(Rønnestad et al,1993)。褐菖鲉的受精卵具有1个较大的油球,其能量的代谢模式应该属于这种。
对于褐菖鲉仔鱼开口饵料来说,从受精卵到开口仔鱼氨基酸的变化更有参考意义。有研究指出,仔鱼的开口期是发育的关键时期,其营养逐步由内源性营养经混合型营养最后转换为外源性营养,此时会表现仔鱼快速死亡,它常被称作“死亡期”或是“危险期”,所以及时地供给丰富、足够的开口饵料在鱼苗培育过程中十分重要。褐菖鲉仔鱼从母体产出时就已开口,第6 天卵黄囊彻底消失,鱼体进入完全外源性营养阶段。鱼体的氨基酸组成往往作为其氨基酸需要量的参考标准,当饲料中含有的可消化吸收氨基酸比例与鱼类对各种氨基酸需要量的比例相近时,即达到氨基酸平衡时,就能满足鱼类对氨基酸的需要量。褐菖鲉从受精卵到开口仔鱼时期总氨基酸含量快速下降的是丙氨酸,其次是异亮氨酸、亮氨酸、酪氨酸和甲硫氨酸,必需氨基酸下降程度高于非必需氨基酸。因此,在褐菖鲉仔鱼的开口饵料中添加一定水平的上述氨基酸尤其是必需氨基酸是十分必要的。
3.2 褐菖鲉发育早期的脂肪酸组成及其变化规律在鱼类受精卵和仔鱼发育过程中,脂肪酸起着十分重要的作用。海水鱼类在开口摄食前的发育过程完全依赖内源性营养物质维持正常的生理活动(常青,2006)。褐菖鲉的受精卵的主要脂肪酸实际含量中,以DHA、C16:0最高,其次是C18:1n-9和EPA,这一结果与大菱鲆(Scophthalmus maximus)、大西洋鳕、真鲷(Pagrus major)和庸鲽(Hippoglossus hippoglossus)等(Klungsøyr et al,1989)海洋鱼类鱼卵总脂中的主要脂肪酸组成相同,说明这些脂肪酸对褐菖鲉早期发育至关重要。但与金头鲷(Sparus aurata)鱼卵中主要脂肪酸组成顺序不同(刘镜恪等,2002),这可能是由于存在种间差异所致。
在褐菖鲉的内源性营养阶段中,PUFA的含量显著高于MUFA和SFA,这个结果与半滑舌鳎(常青等,2007)以及黑线鳕(Melanogrammus aeglefinus)(Plante et al,2007)等许多海水鱼类的研究结果一致。淡水鱼类中的受精卵中,却是SFA高于MUFA和PUFA的含量,这是淡水鱼类与海水鱼类受精卵和卵黄囊仔鱼中脂肪酸组成的重要差别(黄旭雄等,2013)。
有研究表明,某些鱼类在发育过程中对脂肪酸的利用存在一定的选择性(黄旭雄等,2013)。图 1和图 2中,在褐菖鲉吸收卵黄内源营养的发育阶段,C16:0 > C18:1 > EPA > DHA > ARA为被选择性消耗的主要脂肪酸,PUFA相对SFA和MUFA被机体选择性保留,而SFA又相对于MUFA被机体选择性保留。所以,SFA、MUFA、PUFA三者在褐菖鲉内源性营养阶段的利用率为 MUFA > SFA > PUFA。即MUFA和SFA作为褐菖鲉胚胎及仔鱼发育阶段重要能源被首先利用,其中MUFA利用率较SFA高,而PUFA被适当地保存下来,这与海水鱼类在内源性营养阶段首先利用SFA和MUFA的规律一致(刘镜恪等,2002)。如黄颡鱼(Pelteobagrus fulvidraco)(卢素芳等,2008)和突吻鳕鲈(Maccullochella macquariensis)(Gunasekera et al,1999)的仔鱼也优先利用MUFA作为能量基质被消耗,MUFA中C16:1相对C18:1被选择性消耗。其次,SFA中C16:0、C18:0在菖鲉受精卵至后期仔鱼发育期间亦起着重要作用,表 5所示,从受精卵至初产仔鱼显著下降,可以认为在褐菖鲉胚胎及体内仔鱼发育阶段也主要利用C16:0和C18:0为主要能源物质,这与硬头鳟、条石鲷(Oplegnathus fasciatus)等海水鱼鱼类的研究结果一致(徐绍刚等,2011; 徐善良等,2013)。
大量研究证实,EPA、DHA和ARA是海水仔、稚鱼的必需脂肪酸(Lie,1993),尤其是n-3系列PUFA(EPA、DHA)在海水鱼类细胞膜的脂类中占相当大的比例,能影响水产动物亲体的繁殖力、受精率以及仔鱼生长和存活(Gunasekera et al,2001)。n-6系列中,ARA是海水鱼前列腺素合成的主要来源,且ARA对海水仔稚鱼的生长存活等多方面发挥重要的影响(徐善良等,2013)。本研究结果显示,在褐菖鲉的受精卵中含有丰富DHA、EPA和ARA,三者的百分含量在初产仔鱼期表现出不降反升的现象。这说明PUFA中,EPA、DHA和ARA利用率较低被优先保存下来。尽管如此,在褐菖鲉仔鱼开口前既无外源营养,又不能将短链脂肪酸延长去饱和生成EPA和DHA。因此表现为初产仔鱼DHA、EPA和ARA实际含量仍然显著下降,这表明在褐菖鲉仔鱼卵黄囊被吸收的前期阶段,已开始利用DHA等PUFA。这也与条石鲷的研究结果相似(徐善良等,2013)。而与Mourente等(1996)对饥饿的塞内加尔鳎仔鱼的研究中发现DHA始终保持不变的结果不同。
而当褐菖鲉仔鱼开口摄食轮虫后,SFA中C16:0、C18:0,MUFA中C18:1,以及PUFA中DHA、EPA和ARA均得到迅速补充,此后的脂肪酸利用次序则表现为PUFA > SFA > MUFA。至后仔鱼期,由于开始摄食富含C18:0、C18:1而缺乏PUFA的卤虫,仔鱼体内的C18:0和C18:1迅速上升,这与黄旭雄等(2013)对日本鬼鲉的研究结果完全相同。同时,在后仔鱼期因食物中PUFA获取不足或n-3 PUFA被选择性消耗,出现∑PUFA百分比显著下降,而DHA相对EPA和ARA则被选择性消耗,实际含量下降更甚。因此,在褐菖鲉后期仔鱼阶段适当补充DHA,对获得其良好的生长性能很有必要。也证明了这些鱼类的高度不饱和脂肪酸含量变化与饵料密切相关,主要依赖外界营养提供。以上结果表明褐菖鲉在各发育阶段对脂肪酸的利用同样具有不同的选择性。
| 王金燕,2011.哲罗鲑胚胎和仔鱼发育期的生化组成变化及温度对仔稚鱼生长的影响研究.上海:上海海洋大学硕士学位论文, 2-4 |
| 冯隆峰,2012.日本鬼鲉早期发育及其脂类与脂肪酸特性变化:与含油球浮性卵仔鱼的比较.上海:上海海洋大学硕士学位论文, 50-54 |
| 卢素芳,赵娜,刘华斌等,2008.黄颡鱼早期发育阶段受精卵和鱼体脂肪酸组成变化.水产学报, 32(5):711-716 |
| 石戈,王健鑫,刘雪珠等,2007.褐菖鲉消化道的组织学和组织化学.水产学报, 31(3):293-302 |
| 刘镜恪,陈晓琳,2002.海水仔稚鱼的必需脂肪酸——n-3系列高度不饱和脂肪酸研究概况.青岛海洋大学学报, 32(6):897-902 |
| 吴莹莹,柳学周,马爱军等,2006.饥饿对半滑舌鳎仔鱼生长和发育的影响.海洋水产研究, 27(2):87-93 |
| 汪正范,2000.色谱定性与定量.北京:化学工业出版社, 168-169 |
| 邱成功,徐善良,林少珍等,2014.不同温度条件下褐菖鲉幼鱼的耗氧率和排氨率.应用海洋学学报, 33(1):84-89 |
| 林丹军,尤永隆,2002.卵胎生硬骨鱼褐菖鲉胚胎及仔鱼的发育.台湾海峡, 21(1):45-52 |
| 徐绍刚,田照辉,王跃智等,2011.硬头鳟受精卵、发眼卵、卵黄囊仔鱼和开口仔鱼氨基酸及脂肪酸的变化.水生生物学报, 35(6):1032-1037 |
| 徐善良,王亚军,王丹丽等,2013.条石鲷(Oplegnathus fasciatus)发育早期的脂肪酸组成变化研究.海洋与湖沼, 44(2):438-444 |
| 常青,2006.半滑舌鳎仔稚鱼营养生理与开口饲料的开发研究.青岛:中国海洋大学博士学位论文, 1-2 |
| 常青,梁萌青,陈四清等,2007.半滑舌鳎受精卵、卵黄囊仔鱼和开口仔鱼氨基酸及脂肪酸的变化.水生生物学报, 31(6):767-773 |
| 黄旭雄,冯隆峰,温文等,2013.日本鬼鲉胚胎及卵黄囊仔鱼发育过程中脂肪及脂肪酸特性变化.水产学报, 37(4):526-535 |
| Bligh E G, Dyer W J,1959. A rapid method of total lipid extraction and purification. Canadian Journal of Biochemistry and Physiology, 37(8):911-917 |
| Brown M R, Battaglene S C, Morehead D T et al,2005. Ontogenetic changes in amino acid and vitamins during early larval stages of striped trumpeter (Latris lineata). Aquaculture, 248(1-4):263-274 |
| Gunasekera R M, De Silva S S, Ingram B A,2001. Chemical changes in fed and starved larval trout cod, Maccullochella macquarensis during early development. Fish Physiology and Biochemistry, 25(4):255-268 |
| Gunasekera R, Desilva S S, Ingram B A,1999. The amino acid profiles in developing eggs and larvae of the freshwater Percichthyid fishes, trout cod, Maccullochella macquariensis and Murry cod, Maccullochella peelii. Aquaculture, 12:255-261 |
| Klungsøyr J, Tilseth S, Wilhelmsen S et al,1989. Fatty acid composition as an indicator of food intake in cod larvae Gadus morhua from Lofoten, Northern Norway. Marine Biology, 102(2):183-188 |
| Konishi S, Koyama S, Hayashi J et al,2009. Establishment and characterization of scorpion fish (Sebastiscus marmoratus) fin cell line KSG-1. Journal of Bioscience and Bioengineering, 108(1):S5-S6 |
| Lie O,1993. Changes in the fatty acid composition of neutral lipids and glycerophospholipids in developing cod eggs. In:Walther B T, Fyhn H J ed. Physiological and Biochemical Aspects of Fish Development. University of Bergen, Bergen, Norway, 330-337 |
| Metcalfe L D, Schmitz A A, Pelka J R,1996. Rapid preparation of fatty acid esters from lipids for gas chromatographic analysis. Analytical Chemistry, 38(3):514-515 |
| Mourente G, Vázquez R,1996. Changes in the content of totallipid, lipid classes and their fatty acids of developing eggs and unfed larvae of the Senegal sole, Solea senegalensis Kaup. Fish Physiol Biochem, 15:221-235 |
| Nakanishi T,1986. Seasonal changes in the humoral immune response and the lymphoid tissues of the marine teleost, Sebastiscus marmoratus. Veterinary Immunology and Immunopathology, 12(1-4):213-221 |
| Plante S, Pernet F, Haché R et al,2007. Ontogenetic variations in lipid class and fatty acid composition of haddock larvae Melanogrammus aeglefinus in relation to changes in diet and microbial environment. Aquaculture, 263(1-4):107-121 |
| Rønnestad I, Fyhn H J,1993. Metabolic aspects of free amino acids in developing marine fish eggs and larvae. Reviews in Fisheries Science, 1(3):239-259 |
| Srivastava K R, Brown J A, Shahidi F,1995. Changes in the amino acid pool during embryonic development of cultured and wild Atlantic salmon (Salmo salar). Aquaculture, 131(1-2):115-124 |
 2016, Vol. 47
2016, Vol. 47


