中国海洋湖沼学会主办。
文章信息
- 姜宇, 李福艳, 刘冲冲, 徐慧, 孙虎山, 王磊. 2016.
- JIANG Yu, LI Fu-Yan, LIU Chong-Chong, XU Hui, SUN Hu-Shan, WANG Lei. 2016.
- 山楂提取物生物合成纳米银对四种常见水产病原菌的抑制作用
- BIOSYNTHEZIED SILVER NANOPATICLES USING HAWTHORN FRUIT EXTRACT AND THEIR ANTIBACTERIAL ACTIVITY AGAINST FOUR COMMON AQUATIC PATHOGENS
- 海洋与湖沼, 47(1): 253-260
- Oceanologia et Limnologia Sinica, 47(1): 253-260.
- http://dx.doi.org/10.11693/hyhz20150900248
-
文章历史
- 收稿日期: 2015-09-21
- 收修改稿日期: 2015-12-25
2. 鲁东大学化学与材料科学学院 烟台 264025
2. College of Chemistry and Material Sciences, Ludong University, Yantai 264025, China
随着全球水产养殖规模和养殖密度的逐步扩大及养殖环境的不断恶化,水产病害对养殖产业的破坏日趋严重。其中水产病原菌是水产品的主要病害之一,给水产养殖业造成巨大的经济损失,严重影响了水产养殖业的可持续发展(黄利强等,2010; 李晨等,2011)。目前人们对水产病原菌的防治普遍采用传统消毒灭菌的方法,通过大量施用各种消毒剂和抗生素等药剂来控制病害的传播蔓延,但这些药物大量频繁的使用容易导致水产品药物残留、污染水体环境并对人体健康造成危害。另外,病原菌受抗生素等药物刺激后会发生变异产生耐药性,从而使抗菌药物的杀菌效力下降(黄利强等,2010)。因此,研制开发绿色环保、不易产生耐药性的新型抑菌剂成为目前水产养殖业亟待解决的重要问题。
人类很早就认识到银具有广谱杀菌作用,并用银来杀菌消毒(Crabtree et al,2003)。纳米银(Silver nanoparticles,AgNPs)是采用纳米技术合成的粒径在1—100 nm的金属银单质,纳米化处理后的抑菌材料,其大的比表面积和小尺寸效应,极大提高了对细菌表面的吸附性和渗透性,显著提高了抗菌效果,所以它的杀菌作用比普通银提高了数百倍。大量研究表明: 纳米银具有抗菌谱广、抗菌性强、生物安全性高、不易产生耐药性等优点,近年来受到人们的普遍关注(Kathiresan et al,2009)。目前,纳米银已成为一种重要的无机杀菌剂,并逐渐实现了商品化。在传统的抗菌领域中抗生素等抑菌剂占据统治地位,而纳米银作为一种新兴的纳米抗菌材料异军突起,激发了人们极大的研究兴趣,具有广阔的应用前景(Rai et al,2009)。
纳米银的制备技术种类繁多,采用较多的是化学法和物理法(Frattini et al,2005; Chen et al,2010)。但这些方法或者对仪器要求高、能源消耗大; 或者尺寸难以控制; 或者在实验过程中需要添加还原剂、稳定剂或分散剂等化学试剂,在一定程度上对环境和人体健康造成危害。另外,银纳米粒子极易团聚和被氧化,导致在应用时失去其应有的功能,不利于长期稳定使用。因此,研究和探索新的纳米银制备方法,改善已有纳米银的品质,将成为纳米银材料的重要发展方向。与传统的合成技术相比,纳米生物合成技术在合成过程中利用植物、微生物等生物中的活性物质同时发挥还原剂和稳定剂的双重作用,无需添加其它化学试剂,一步法即可制备出纳米银材料。生物合成法具有原料价格低廉易得、反应条件温和可控、合成效率高、环境友好安全等优点,并且该方法适合在短时间内大规模制备纳米银颗粒(Mude et al,2009; Lukman et al,2011)。
山楂(Crataegus pinnatifida Bunge),为蔷薇科山楂属。其适应环境性强,广泛分布于亚洲、欧洲、中北美洲及南美洲北部,是一种重要的植物资源(赵二劳等,2008)。山楂的果实营养丰富,可生吃或作果脯糖点,干制后可入药,综合利用价值很高。中国传统医学认为山楂具有消食健胃,行气散瘀,化浊降脂的作用,可用于开胃健脾、消食化滞、降血压、降血脂、抗动脉粥样硬化、治疗心绞痛等(Vierling et al,2003; Dalli et al,2008)。山楂中的主要成分是黄酮类化合物,从山楂中分离的黄酮成分有30余种,包括原花青素、表儿茶酚、槲皮素等,此外山楂中还含有绿原酸、咖啡酸、山楂酸、果酸、鞣质、金丝桃甙、表儿茶酚、胆碱、乙酰胆碱、维生素C、胡萝卜素等成分,这些物质多具有抗氧化作用,能减少体内氧自由基的产生(Rayyan et al,2005; 金宁等,2007)。山楂中这些丰富的还原性物质为纳米银的生物合成提供了保障。
目前有关生物合成纳米银体外抑制临床病原菌方面的研究报道很多(Kumar et al,2014; Sadeghi et al,2015b),而探讨其在水产领域中应用的甚少,以山楂制备纳米银并开展其对水产病原菌抑菌方面的研究未见报道。本研究系统比较了以山楂果实超纯水提取物和乙醇提取物所制备的纳米银抑菌材料的理化性质,并检测其对典型的水产病原菌的抑菌活性,为新型纳米抑菌材料的研制与开发乃至在水产抑菌领域中的应用打下基础。
1 材料与方法 1.1 材料山楂果实为市场销售。
1.2 菌种实验中所用供试病原菌菌株大肠杆菌(Escherichia coli)、金黄色葡萄杆菌(Staphylococcus aureus)、鳗弧菌(Vibrio anguillarum)、溶藻弧菌(Vibrio alginolyticus)、副溶血弧菌(Vibrio parahaemolyticus)和点状气单胞菌(Aeromonas punctata)均由本实验室保藏。
1.3 试剂和培养基硝酸银(AgNO3)、蛋白胨、酵母提取物、氯化钠、琼脂粉,均为分析纯,购买于国药集团化学试剂有限公司。实验用水为超纯水。
LB培养基: 胰蛋白胨 10 g,酵母提取物 5 g,氯化钠5 g,琼脂粉15 g,蒸馏水定容至1000 mL,1mol/L的NaOH调节pH值至7.4; 以上成分不加琼脂粉配制液体培养基。120℃高压灭菌20 min。该培养基用于大肠杆菌、金色葡萄球菌等临床病原菌的培养。
2216E培养基: 蛋白胨5 g,酵母膏1 g,磷酸高铁0.01 g,琼脂粉15 g,陈海水定容至1000 mL,用1mol/L的NaOH调节pH值至7.6—7.8; 以上成分不加琼脂粉配制液体培养基。120℃高压灭菌20 min。该培养基用于鳗弧菌、溶藻弧菌、副溶血弧菌和点状气单胞菌等海洋水产病原菌的培养。
1.4 方法 1.4.1 生物合成纳米银取新鲜的山楂果实清洗后切成小块,称取10 g,分别采用100 mL超纯水或者100 mL乙醇为提取液,80℃加热回流2 h,回流结束后将制得的溶液进行抽滤,得到山楂提取液,冷却至室温后4℃保存备用。
取18.8 mL超纯水,加入200 μL 0.1mol/L的AgNO3溶液(终浓度为1 mmol/L),再加入1 mL上述山楂提取液,混合后,94℃水浴加热回流1 h,注意观察溶液颜色的变化,反应结束即得到生物合成的纳米银,4℃避光保存。
1.4.2 生物合成纳米银的表征合成的纳米银颗粒的最大吸收波长采用UV-255紫外-可见分光光度计(岛津,日本)检测,以山楂提取液为对照,扫描波长为300—700 nm。纳米银颗粒的形态及粒径用JEM-1230透射电子显微镜(日立,日本)进行表征: 取5 μL样品滴加在覆炭铜网上,室温干燥,在100 kV电压下观察。X射线晶体衍射(XRD)分析: 取一定量合成的纳米银,浓缩后滴到样品槽内,60℃真空干燥1h,反复操作5—6次,在槽内形成固体纳米银,使用X射线衍射仪(D/max-2500PC,日本,理学)进行表征,以CuKα为辐射源,λ=0.15406nm,电压40kV,电流200mA,扫描范围5°—80°。
1.4.3 生物合成纳米银的抑菌活性检测(1)抑菌圈试验 采用杯碟法检测生物合成纳米银的抗菌活性。将供试病原菌液体培养基中培养至对数增长期(OD600=1.0),稀释至106 CFU/mL,取100 μL均匀涂布于固体培养基上,在培养基上放置牛津杯(杯外径8 mm),然后在杯中加入20 μL生物合成的纳米银溶液,并用生理盐水和山楂提取物做阴性对照,每种菌做三次重复。将培养平皿在恒温培养箱中培养24 h后观察,分别测量抑菌圈直径,取平均值,判断合成纳米银材料的抑菌活性。
(2)抑菌动力学实验 将鳗弧菌在2216E液体培养基中28℃,150 r/min培养至对数增长期,将培养好的菌液稀释到1×106 CFU/mL。分别加入不同量的纳米银材料使终浓度分别为10、20 μg/mL,以加生理盐水的菌液为对照,28℃恒温摇床150 r/min培养,每隔0、10、30、60、120、180 min取样,用分光光度计测OD600值,做供试菌生长动力学曲线。
(3)最小抑菌浓度(MIC)与最小杀菌浓度(MBC)的测定 选取鳗弧菌作为供试菌,采用二倍稀释法测定生物合成纳米银的最小抑菌浓度(Minimum inhibitory concentration,MIC): 将培养至对数增长期的菌悬液稀释到1×106 CFU/mL,分装到8个试管中,每管加1 mL菌液。将生物合成的纳米银溶液(102.8 μg/mL)分别两倍梯度稀释成8个浓度梯度,各取1mL分别加入上述装有菌液的试管中,另取两支试管分别加入2 mL 2216E液体培养液和106 CFU/mL的鳗弧菌菌悬液作为阴性对照组和阳性对照组。28℃,150r/min培养24 h,观察实验结果,找到稀释倍数最大且澄清的试管,其所对应的纳米银溶液的浓度即为该活性物质的MIC。将上述各澄清试管中的培养物分别涂布于2216E固体培养基平板上,28℃恒温培养箱中培养24 h,菌落数小于5个的培养平皿所对应的最低纳米银溶液浓度即为该活性物质的最小杀菌浓度(Minimum bactericidal concentration,MBC)。上述实验均重复3次。
2 结果与分析 2.1 生物合成纳米银的制备分别采用山楂的超纯水提取物和乙醇提物作为还原剂合成纳米银。随着反应的进行,未与AgNO3混合的两种山楂提取液无任何颜色变化,而加入AgNO3溶液的两种提取液的颜色均发生了明显变化: 山楂的超纯水提取液由淡红色变成浅金黄色; 山楂乙醇提取液由浅褐色变成金黄色(图 1)。这种颜色的改变是由于金属纳米粒子表面等离子体子共振(surface plasmon resonance,SPR)造成的,金黄色是纳米银水溶液的特征颜色,而纳米银所呈现的颜色的深浅与其粒径和浓度有关,一般粒径和浓度越大颜色越深(Ashokkumar et al,2015)。通过颜色的变化初步表明了纳米银粒子的形成,山楂中所富含的黄酮类化合物、原花青素、绿原酸、果酸、维生素C、胡萝卜素等还原性物质能够将Ag+还原成纳米银,山楂的两种提取液均能用于纳米银的生物合成。我们将山楂的超纯水提取物制备的纳米银命名为W-AgNPs; 山楂的乙醇提取物制备的纳米银命名为E-AgNPs。
 |
|
图 1 山楂提取液及其制备的纳米银溶液的效果图
Fig. 1 The photographs of hawthorn fruit extract and synthesized AgNPs
a. 山楂超纯水提取液(左侧)及其制备的纳米银W-AgNPs(右侧); b. 山楂乙醇提取液(左侧)及其制备的纳米银E-AgNPs(右侧) |
我们进一步用UV-vis光谱对山楂生物合成的纳米银进行鉴定。UV-vis光谱是表征银纳米颗粒的重要手段,典型的银纳米粒子在400—500 nm范围内由于特征性的表面等离子体共振而产生特征吸收峰(Singhal et al,2011)。由图 2可以看出W-AgNPs在413 nm附近出现了一个明显的吸收峰,E-AgNPs在420 nm处出现一个吸收峰,这证实两种山楂提取物都成功将AgNO3还原成纳米银颗粒。另外,E-AgNPs特征峰的位置比W-AgNPs略有红移,说明E-AgNPs的粒径比W-AgNPs略大,这是由于提取物中活性成分的不同所导致的合成产物的差异。
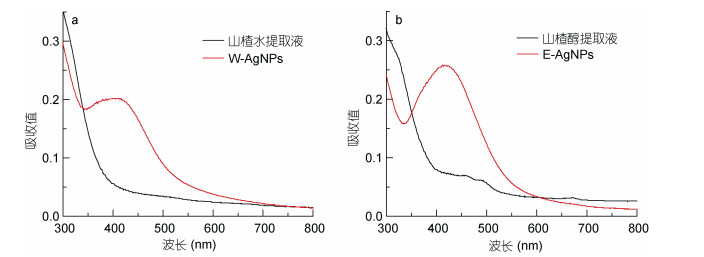 |
| 图 2 山楂提取液及其制备的纳米银的紫外可见吸收图谱 Fig. 2 UV-visible absorption spectra of hawthorn fruit extract and the synthesized AgNPs a. 山楂超纯水提取液(黑色曲线)及其制备的W-AgNPs(红色曲线)的吸收图谱; b. 山楂乙醇提取液(黑色曲线)及其制备的E-AgNPs(红色曲线)的吸收图谱 |
2.2.2 透射电子显微镜(TEM)图谱 通过透射电镜能直观有效地观察纳米粒子的形貌、分散情况和粒径大小。从图 3a可以看出W-AgNPs颗粒为多边形或椭圆形,大小较为均匀,平均粒径为30—60nm,呈良好的单一分散状态; 由图 3b可以看出E-AgNPs为多边形或不规则的颗粒,粒径分布范围较大,为10—80nm,团聚较为明显。TEM观察结果与UV-vis光谱一致。形态结构是评价纳米银的重要指标,这直接关系到其光学、电学乃至生物学特性。研究表明粒径均匀、尺寸较小、分散良好的纳米银在抑菌、靶向药物的运输及医疗等应用领域中具有较大的优势(Miri et al,2015),因此,从形态指标上判断W-AgNPs的合成状态较为理想。
 |
| 图 3 山楂提取液制备的纳米银的透射电镜照片 Fig. 3 TEM images of AgNPs synthesized from hawthorn fruit extract a. 山楂超纯水提取物制备的纳米银W-AgNPs; b. 山楂乙醇提取物制备的纳米银E-AgNPs |
为了证明制备的银纳米颗粒的晶体结构,本研究分别对W-AgNPs和E-AgNPs进行了XRD测试,如图 4所示,两种纳米银样品均在2θ角为27.831°、32.243°、38.100°、44.369°和46.233°处出现了5个显著衍射峰,其中在38.100°和44.369°处分别对应了银纳米颗粒的(111)和(200)晶面(JCPDS卡01-1167),在27.831°、32.243°和46.233°处分别对应了氯化银的(111)、(200)和(220)晶面(JCPDS卡31-1238)。这说明两种样品中均存在银纳米颗粒,晶体结构为面心立方系(fcc),从而证明以超纯水和乙醇制备的山楂提取液均可以有效地合成银纳米颗粒。而产物中比较强的氯化银衍射峰的出现可能是由于山楂提取液中的生物残基存在氯离子,制备银纳米粒子的同时形成了氯化银,在前人生物合成纳米银的过程中也有类似现象的发生(Mandal et al,2006; Sadeghi et al,2015a)。
 |
| 图 4 山楂提取液制备的纳米银的XRD图谱 Fig. 4 XRD patterns of AgNPs synthesized from hawthorn fruit extract a. 山楂超纯水提取物制备的纳米银W-AgNPs; b. 山楂乙醇提取物制备的纳米银E-AgNPs |
传统方法制备的纳米银溶胶颗粒易发生凝聚,常常1个月就出现明显的沉淀,随之失去其原有的特性(Narayanan et al,2008)。而利用山楂的提取液生物制备的W-AgNPs和E-AgNPs均有优良的稳定性,在低温避光条件下保存6个月无明显颜色变化,无团聚沉淀现象发生。研究表明植物材料中的生物大分子物质可以增加纳米银材料的稳定性,能有效地防止了纳米银粒子聚集形成沉淀。并且,植物细胞内富含的蛋白质、脂类、多糖、氨基酸、维生素等有机化合物在合成过程发挥还原剂、络合剂、稳定剂等作用,从而影响纳米银的形状、大小,并赋予其独特的生物学特性(Patil et al,2012)。因此,生物合成的纳米银具备优良的特性,越来越受到研究人员的关注。
2.3 生物合成纳米银的抑菌活性检测 2.3.1 抑菌圈试验我们首先采用琼脂扩散法以常规的指示菌大肠杆菌(革兰氏阴性细菌)和金黄色葡萄球菌(革兰氏阳性细菌)分别检测W-AgNPs和E-AgNPs的抑菌效果(表 1)。由表 1可以看出山楂的超纯水提取物和乙醇提物对大肠杆菌和金黄色葡萄球菌没有抑菌活性,而由这两种提取物合成的W-AgNPs和E-AgNPs对两种指示菌均产生明显的抑菌圈,W-AgNPs的抑菌活性更强,对大肠杆菌和金黄色葡萄球菌的平均抑菌直径分别为10.7 mm和11.4mm; 相比之下,E-AgNPs对金黄色葡萄球菌的抑菌直径为10.3 mm,而对大肠杆菌的抑菌直径仅为8.1 mm,抑菌范围仅限于牛津杯内,几乎不产生扩散。结合表征实验,我们推测由于W-AgNPs具有较小的粒径,具有较好的渗透性和扩散性,因而表现出较高的抑菌活性。这与Panáček等(2006)的研究一致,他们的实验结果表明纳米银粒子的抗菌作用与粒子的大小有关,粒径越小,抗菌活性越强。
| (n=3) | ||||
| 菌种 | 抑菌圈直径(mm) | |||
| 超纯水提取物 | W-AgNPs | 乙醇提取物 | E-AgNPs | |
| E. coli | 0 | 10.7±0.3 | 0 | 8.1±0.1 |
| S. aureus | 0 | 11.4±0.4 | 0 | 10.3±0.4 |
综合上述实验,我们可以看出W-AgNPs分散均匀、粒径小、稳定性好,且具有较好的抑菌活性。所以,我们确定以山楂水提取物为还原剂和稳定剂合成纳米银,并在后续实验中以W-AgNPs为抑菌材料,对鳗弧菌、溶藻弧菌、副溶血弧菌和点状气单胞菌等4种常见的水产病原菌进行全面的抑菌活性测定分析。
 |
| 图 5 W-AgNPs对4种水产病原菌的抑菌效果 Fig. 5 The antibacterial effect of W-AgNPs against 4 different aquatic pathogens 1: W-AgNPs; 2: 生理盐水; 3: 山楂水提物 |
抑菌圈实验表明W-AgNPs能有效抑制供试水产病原菌的生长,对病原菌产生显著的抑菌圈。作为对照的山楂超纯水提取液仅能对牛津杯内的病原菌产生微弱的抑菌效果,但未能形成明显的抑菌圈; 而生理盐水则对病原菌完全没有抑制作用(图 5)。不同病原菌的抑菌圈直径各不相同,反映了供试的4种水产病原菌对合成的纳米银材料的敏感性不同(表 2),其中鳗弧菌抑菌效果最为明显,可作为敏感指示菌。
| (n=3) | |
| 病原菌 | 抑菌圈直径(mm) |
| V. anguillarum | 13.0±0.9 |
| V. alginolyticus | 12.5±0.4 |
| A. punctate | 11.4±1.1 |
| V. parahaemolyticus | 12.2±0.5 |
以鳗弧菌为指示菌,检测W-AgNPs对其生长曲线的影响(图 5)。细菌培养液在600 nm下的OD值与培养液中细菌生长的浓度呈正相关,OD值越高代表培养液中细菌的浓度越高,生长速度越快。由图 6可以看出10 μg/mL和20 μg/mL的W-AgNPs对鳗弧菌都能产生明显的抑制作用,随着培养时间的延长,W-AgNPs处理组菌液的OD值几乎没有发生变化; 而加生理盐水对照组中的菌液随着培养时间的延长,OD值不断增长。上述实验表明山楂合成的纳米银材料在液体环境中可以很好的抑制鳗弧菌的生长,为纳米银抑菌材料在水产养殖中应用奠定了基础。
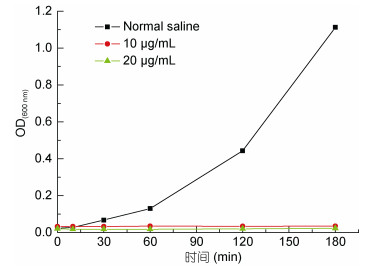 |
| 图 6 不同浓度的W-AgNPs作用下的鳗弧菌的生长曲线 Fig. 6 Growth curve of V. anguillarum treated with W-AgNPs in different concentrations |
采用最小抑菌浓度和最小杀菌浓度法定量评价W-AgNPs的抗菌活力,以鳗弧菌为指示菌,二倍稀释法梯度稀释W-AgNPs溶液,分别处理鳗弧菌菌悬液,于28℃恒温培养24h,观察菌落的生长情况,以不长菌的最低浓度为W-AgNPs的最小抑制浓度(MIC)。由表 3可以看出,从4号管开始溶液出现浑浊,故第4号管中纳米银的浓度6.5 μg/mL即为W-AgNPs对鳗弧菌的MIC。然后,取澄清的1—3号管中的溶液0.1 mL涂布到2216E琼脂平板上,于28℃恒温培养箱中倒置培养24h,观察发现1、2号管对应平皿无菌落生长,而3号管对应的平皿上长出了鳗弧菌的菌落,故3号管对应的纳米银浓度12.9 μg/mL即为此活性物质对鳗弧菌的MBC。
| 试管编号 | 纳米银浓度(μg/mL) | 24h | 48h |
| 1 | 51.4 | - | - |
| 2 | 25.7 | - | - |
| 3 | 12.9 | - | + |
| 4 | 6.5 | + | + |
| 5 | 3.3 | + | + |
| 6 | 1.6 | + | + |
| 7 | 0.8 | + | + |
| 8 | 0.4 | + | + |
| 阴性对照组 | - | - | |
| 阳性对照组 | + | + | |
| “−” 表示无菌生长; “+”表示有菌生长 | |||
近年来随着耐药微生物的不断产生,新型抗菌剂的研发越来越受到人们的重视,纳米抑菌材料作为抗生素的替代品逐渐成为抗菌领域中的研究热点。目前有关纳米材料抑菌的机理尚不太明确,人们普遍认为纳米粒子可与细菌充分接触,直接作用与细胞膜,使细菌细胞膜破裂,细胞内容物外泄; 或者透过细胞膜进入微生物细胞内,与菌体内的蛋白质的巯基、氨基等发生反应,破坏相关酶的活性中心,并干扰DNA复制,使微生物丧失分裂增殖能力,最终导致其死亡(Choi et al,2008)。
纳米抗菌剂具有抗菌速效、广谱、持久、无耐药性等优点,已制备出外科消毒剂、医用材料、抗菌织物、抗菌涂料、抗菌塑料、抗菌陶瓷等多种抗菌材料,在纺织、医药、食品、化工等领域中具有广泛应用的前景。而纳米抑菌材料在水产抗菌领域中的研究和利用才刚刚起步,这方面的报道尚少。刘鹏威等(2009)研究了载铜蒙脱石纳米材料对嗜水气单胞菌、荧光假单胞菌和副溶血弧菌等三种水产病原菌的杀菌效果,结果表明对3种致病菌具有较强的抑制作用,对嗜水气单胞菌、荧光假单胞菌的MIC均为128 μg/mL,对副溶血弧菌的MIC为64 μg/mL。陈娟(2011)通过抑菌圈实验考察了碳纳米管/纳米银复合材料对黄色链球菌、氯酚节杆菌和芽孢杆菌三种海洋细菌的杀菌效果,结果表明该纳米复合材料对三种海洋细菌均有明显的抑制作用。Umashankari等(2012)研究表明利用红树林植物生物合成的纳米银对变形杆菌、假单胞菌和黄杆菌等海洋鱼类病原菌有着明显的抑制作用,可作为抗生素的替代品来控制鱼类疾病。Vaseeharan等(2010)则利用茶叶提取物成功制备出纳米银并进行了对虾活体实验,结果表明纳米银能够显著降低由哈氏弧菌侵染造成的对虾致死率。
在实验研究的基础上,纳米抑菌剂在水产养殖实际生产中也得到了一定的应用,在台湾地区已有相关材料科技公司推出纳米银杀菌液产品,取代以往养殖过程中的传统杀菌药物,应用于对虾、石斑鱼等高经济价值的水产品的养殖、苗种生产和运输等环节(钟绮文,2014)。
综上所述,目前有关纳米抑菌剂对水产病原菌抑菌方面的研究和应用才刚刚展开,尚缺乏系统的研究和数据支持。本研究首先比较了山楂超纯水提取物和山楂乙醇提物合成的W-AgNPs和E-AgNPs,通过对理化表征和生物活性的比较,最终确定W-AgNPs较为理想。在此基础上,通过检测该绿色合成的纳米银制剂对鳗弧菌、溶藻弧菌、副溶血弧菌和点状气单胞菌等4种常见的水产病原菌的体外抑菌效果,为纳米材料在水产领域中的应用提供了理论依据。
| 刘鹏威,郭彤,魏华,2009.纳米载铜蒙脱石体外对三种水产病原菌及两种肠道有益菌杀菌作用.上海海洋大学学报, 18(5):520-526 |
| 李晨,黄倢,谢国驷等,2011. 3种水产病原菌简型基因芯片检测技术的建立.中国海洋大学学报, 41(3):37-42 |
| 陈娟,2011.纳米银修饰多壁碳纳米管复合材料的制备和杀菌性能研究.青岛:中国海洋大学硕士学位论文 |
| 金宁,刘通讯,2007.山楂原花青素的抗氧化活性研究.食品与发酵工业, 33(1):45-47 |
| 赵二劳,王丽娟,李满秀,2008.山楂提取物抗氧化能力的研究.食品研究与开发, 29(11):19-21 |
| 钟绮文,2014.纳米银提供新防疫方向.海洋与渔业, (12):73-74 |
| 黄利强,许昱,郭松林,2010.纳米TiO2光催化杀灭水产病原菌的研究.集美大学学报(自然科学版), 15(4):254-257 |
| Ashokkumar S, Ravi S, Kathiravan V et al,2015. Synthesis of silver nanoparticles using A. indicum leaf extract and their antibacterial activity. Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 134:34-39 |
| Chen W, Cai W P, Zhang L et al,2001. Sonochemical processes and formation of gold nanoparticles within pores of mesoporous silica. Journal of Colloid and Interface Science, 238(2):291-295 |
| Choi O, Hu Z Q,2008. Size dependent and reactive oxygen species related nanosilver toxicity to nitrifying bacteria. Environmental Science & Technology, 42(12):4583-4588 |
| Crabtree J H, Burchette R J, Siddiqi R A et al,2003. The efficacy of silver-ion implanted catheters in reducing peritoneal dialysis-related infections. Peritoneal Dialysis International, 23(4):368-374 |
| Dalli E, Milara J, Cortijo J et al,2008. Hawthorn extract inhibits human isolated neutrophil functions. Pharmacological Research, 57(6):445-450 |
| Frattini A, Pellegri N, Nicastro D et al,2005. Preparation of amine coated silver nanoparticles using triethylenetetramine. Materials Chemistry and Physics, 94:148-152 |
| Kathiresan K, Manivannan S, Nabeel M A et al,2009. Studies on silver nanoparticles synthesized by a marine fungus, Penicillium fellutanum isolated from coastal mangrove sediment. Colloids and Surfaces B:Biointerfaces, 71(1):133-137 |
| Lukman A I, Gong B, Marjo C E et al,2011. Facile synthesis, stabilization, and anti-bacterial performance of discrete Ag nanoparticles using Medicago sativa seed exudates. Journal of Colloid and Interface Science, 353(2):433-444 |
| Mandal D, Bolander M E, Mukhopadhyay D et al,2006. The use of microorganisms for the formation of metal nanoparticles and their application. Applied Microbiology and Biotechnology, 69(5):485-492 |
| Miri A, Sarani M, Rezazade Bazaz M R et al,2015. Plant-mediated biosynthesis of silver nanoparticles using Prosopis farcta extract and its antibacterial properties. Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 141:287-291 |
| Mude N, Ingle A, Gade A et al,2009. Synthesis of silver nanoparticles using callus extract of Carica papaya——a first report. Journal of Plant Biochemistry and Biotechnology, 18(1):83-86 |
| Kumar P P N V, Pammi S V N, Kollu P et al,2014. Green synthesis and characterization of silver nanoparticles using Boerhaavia diffusa plant extract and their anti bacterial activity. Industrial Crops and Products, 52:562-566 |
| Narayanan K B, Sakthivel N,2008. Coriander leaf mediated biosynthesis of gold nanoparticles. Materials Letters, 68(30):4588-4590 |
| Panáček A, Kvítek L, Prucek R et al,2006. Silver colloid nanoparticles:synthesis, characterization, and their antibacterial activity. The Journal of Physical Chemistry B, 110(33):16248-16253 |
| Patil R S, Kokate M R, Kolekar S S,2012. Bioinspired synthesis of highly stabilized silver nanoparticles using Ocimum tenuiflorum leaf extract and their antibacterial activity. Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 91:234-238 |
| Rai M, Yadav A, Gade A,2009. Silver nanoparticles as a new generation of antimicrobials. Biotechnology Advances, 27(1):76-83 |
| Rayyan S, Fossen T, Nateland H S et al,2005. Isolation and identification of flavonoids, including flavone rotamers, from the herbal drug ‘Crataegi folium cum flore’ (hawthorn). Phytochemical Analysis, 16(5):334-341 |
| Sadeghi B, Gholamhoseinpoor F,2015a. A study on the stability and green synthesis of silver nanoparticles using Ziziphora tenuior (Zt) extract at room temperature. Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 134:310-315 |
| Sadeghi B, Rostami A, Momeni S S,2015b. Facile green synthesis of silver nanoparticles using seed aqueous extract of Pistacia atlantica and its antibacterial activity. Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 134:326-332 |
| Singhal G, Bhavesh R, Kasariya K et al,2011. Biosynthesis of silver nanoparticles using Ocimum sanctum (Tulsi) leaf extract and screening its antimicrobial activity. Journal of Nanoparticle Research, 13(7):2981-2988 |
| Umashankari J, Inbakandan D, Ajithkumar T T et al,2012. Mangrove plant, Rhizophora mucronata (Lamk,1804) mediated one pot green synthesis of silver nanoparticles and its antibacterial activity against aquatic pathogens. Aquatic Biosystems, 8:11 |
| Vaseeharan B, Ramasamy P, Chen J C,2010. Antibacterial activity of silver nanoparticles (AgNps) synthesized by tea leaf extracts against pathogenic Vibrio harveyi and its protective efficacy on juvenile Feneropenaeus indicus. Letters in Applied Microbiology, 50(4):352-356 |
| Vierling W, Brand N, Gaedcke F et al,2003. Investigation of the pharmaceutical and pharmacological equivalence of different hawthorn extracts. Phytomedicine, 10(1):8-16 |
 2016, Vol. 47
2016, Vol. 47


