中国海洋湖沼学会主办。
文章信息
- 左涛, 王俊, 吴强, 袁伟, 栾青杉. 2016.
- ZUO Tao, WANG Jun, WU Qiang, YUAN Wei, LUAN Qing-Shan. 2016.
- 2015年5月黄海及东海北部大型水母分布及生物量估算
- SPATIAL DISTRIBUTION AND BIOMASS OF LARGE JELLYFISH IN THE YELLOW SEA AND NORTHERN PART OF THE EAST CHINA SEA IN MAY 2015
- 海洋与湖沼, 47(1): 195-204
- Oceanologia et Limnologia Sinica, 47(1): 195-204.
- http://dx.doi.org/10.11693/hyhz20150800214
-
文章历史
- 收稿日期: 2015-08-05
- 收修改稿日期: 2015-11-17
2. 青岛海洋科学与技术国家实验室海洋生态与环境科学功能实验室青岛 266000;
3. 农业部海洋渔业可持续发展重点实验室 青岛 266071
2. Laboratory for Marine Ecology and Environmental Science, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266000, China;
3. Key Laboratory for Developmental Utilization of Marine Fisheries, Ministry of Agriculture, P.R.China, Qingdao 266071, China
2003年以来,黄、东海大型水母季节性旺发已近于常态(Dong et al,2010)。由于许多大型水母旺发季节多处于鱼类种群补充、生长繁殖时期,它们通过与渔业生物的捕食竞争、生存空间的挤占等生态交互作用,直接或间接地改变海洋生物群集结构及食物链的营养途径(Jiang et al,2008; 江红等,2010); 水母旺发还损坏渔具(周永东等,2004)、引起鱼类捕捞资源量可能下降(严利平等,2004; 丁峰元等,2005; 单秀娟等,2011),直接影响黄、东海海洋生态系统的生物资源产出和服务功能、以及正常的渔业生产活动。此外,黄、东海出现的大型水母中,海蜇和沙海蜇还是很重要的渔业捕捞对象,如2013年沙海蜇的捕捞产量达50万t(李建生等,2014)。因此,开展黄、东海自然海域的大型水母类种类组成和资源分布的长期监测,不仅可以深入了解黄、东海大型水母数量变动规律,促进水母旺发所引起的生态影响评估研究,而且对渔业资源预测、预报和指导渔业生产也有着极为重要的现实意义。
近十年来,围绕着黄东海大型水母的时空分布及物理驱动机制、种群动态、水母旺发引发的渔业资源效应和生态效应等方面的研究已见于诸多国内外报道(严利平等,2004; 周永东等,2004; Yoon et al,2008,2014; 单秀娟等,2011; 王世伟等,2012; 张海彦等,2012; 罗晓凡等,2012; Zhang et al,2012; Shi et al,2015)。特别2011年启动的中国水母973项目对黄东海大型水母的群落结构及关键种种群动力学展开了系统的研究。黄海和东海旺发的大型水母种类主要有洋须水母、沙海蜇、霞水母、海月水母和多管水母等(周永东等,2004; 程家骅等,2005; 王彦涛等,2012; Zhang et al,2012)。上述水母的生态习性及种群分布特点各有不同。其中,沙海蜇对生态系统、渔业生产造成的负面影响较大(严利平等,2004; 李建生等,2015),因而黄、东海大型水母研究更多集中于沙海蜇旺发的夏、秋两季而展开(丁峰元等,2007; Yoon et al,2008,2014; 李建生等,2009,2014,2015; Moon et al,2010; Toyokawa et al,2012; Xu et al,2013; Kitajima et al,2015; Sun et al,2015)。而在许多大型水母快速生长和数量增加的春季(3—5月),相关数据积累较少,仅在少数文献中有所体现(程家骅等,2005; Zhang et al,2012; Sun et al,2015)。
作者于2015年5月使用渔拖网的采样方式,在整个黄海及东海北部进行了系统的走航式大面调查,记录了30°N—39°N海区内的大型水母种类组成、形态特征及生物量分布,结合水母973项目研究基础、对此季大型水母与其它渔业生物的生物量进行了评估和比较。本次调查范围广,涉及大型水母旺发的主要区域,调查时间属于大型水母沙海蜇种群旺发的补充期和霞水母旺发初期。此次调查分析结果不仅有助于系统刻画春季黄海和东海北部大型水母的分布格局,弥补现有资料的不足,促进黄、东海大型水母生物生态学特征参数的长期积累; 还为深入开展大型水母旺发机理研究、资源预测和预报,评估其对渔业生态环境和渔业生产的影响的相关研究提供重要基础数据。
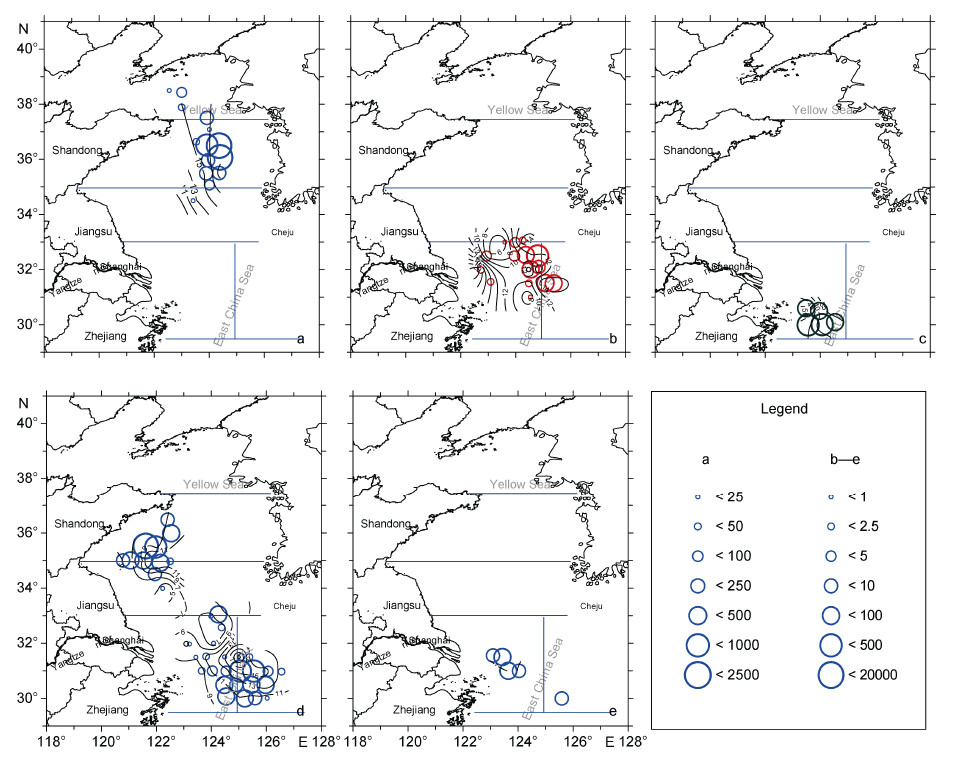
1 材料与方法 1.1 数据采集2015年5月6—28日,依托农业部“黄渤海渔业资源调查”专项,搭载渔业科学调查船“北斗”号,在整个黄海中央水域以及东海北部开展了大面生物及环境调查。调查航线设计采用系统式预定航线,航线包含自北而南19个平行断面、120个站位,站位按0.5°×0.5°设定。根据唐启升(2006),整个调查海区分为黄海北部、黄海中部和黄海南部以及东海北部近海和外海共5个分区(图 1a)。渔业生物及大型水母采用渔业底拖网采集。渔业底拖网网具袖网宽度为25m,囊网网目为24mm,其它网具参数见唐启升(2006)。除少数站位受恶劣天气影响致使拖网时间略短外,大多数站位拖网时间为1h,拖速控制在3kn左右。各站位水深、水温和盐度使用Seabird219型CTD测定,表层和底层水温、盐度分布见图 1b—图 1e。海上测定记录水母和渔业生物的种类、湿重、个数,取样测定水母伞径(cm)。由于大型水母的体径大小并没有明确的规定。本文暂根据常用的大型浮游动物个体标准(>2cm)(Lenz,2000),将直径大于2cm的水母种类归入大型水母进行分析。
 |
| 图 1 调查海域站位及分区、温度和盐度以及渔业生物资源密度的地理分布 Fig. 1 Geographic distributions of sampling stations, divisions of the survey area, temperature, salinity, and stock density of fisheries(excluding jellyfish) a. 站位、分区及水深(m)线分布; b. 表层海水温度(℃); c. 底层水温度(℃); d. 表层海水盐度; e. 底层海水盐度; f. 鱼类生物资源密度(kg/km2)。DⅠ:黄海北部; DⅡ: 黄海中部; DⅢ: 黄海南部; DⅣ: 东海北部外海; DⅤ: 东海北部近海 |
生物量估算借助渔业资源评估扫海面积法(唐启升,2006)。首先估算各分区i(以各站位为中心的0.5°× 0.5°分区)的水母及主要渔业生物生物量密度和生物量,即:

ρi为第i分区/种类的生物量密度(kg/km2); Ci为底拖网渔获量(kg); αi为网具取样扫海面积(km2),由网口宽度乘以实际拖距得到。q为网具的捕获系数,游泳生物取值0.5,水母类游泳能力较弱、取值1。Ai为各分区面积。
网具网口宽度多随水深有所变动。基于唐启升(2006)的测试数据,李凡等(2008)建立了网口宽度与水深的回归方程式:
网口宽度(m)= 0.12 ×放网水深(m)+ 15.7。
以各站位为中心的分区面积Ai估算公式为:

总生物量B为各分区的生物量Bi的总和,即

见图 2。整个调查海区采集到的水母有: 水螅虫总纲自育水母纲硬水母亚纲的四叶小舌水母(Liriope tetraphylla)、水螅水母纲中软水母亚纲的多管水母(Aequorea spp.)和瘤手水母(Tima formosa); 钵水母纲旗口水母目的白色霞水母(Cyanea nozakii)和紫色霞水母(Cyanea purpurea)、洋须水母(Ulmaridae,Zhang et al,2012)一种,以及根口水母目的沙海蜇(Nemopilema nomurai)。另有一未知水母、种类待定。因紫色霞水母出现频率和数量较少、且常与白色霞水母一起出现,因而将两种并于霞水母(Cyanea spp.)进行阐述。数量较多的种类有四叶小舌水母、多管水母和霞水母、洋须水母和沙海蜇。
 |
| 图 2 2015年5月黄海和东海北部采集水母海上照片 a. 洋须水母; b. 沙海蜇; c. 霞水母; d.多管水母; e. 四叶小舌水母; f. 瘤手水母; g. 未知水母 Fig. 2 Photos of large jellyfish in the Yellow Sea and northern part of East China Sea during May 2015 a. Ulmaridae; b. Nemopilema nomurai; c. Cyanea spp.; d. Aequorea spp.; e. Liriope tetraphylla; f. Tima formosa; g. Unknown species |
各种水母伞径大小呈正态分布,显示为单峰型(图 3)。洋须水母的个体介于9—25 cm、均值为(15.47±3.37)cm; 黄海的多管水母的伞径介于3—12 cm,均值为(7.74±3.65)cm; 东海北部的多管水母较黄海的个体大,伞径介于6—18 cm,均值为(11.67±4.32)cm; 5月采集到的沙海蜇数量少、个体小,没有采集到成熟水母体,其个体介于2.5—36 cm间,均值为(12.7±6.20)cm; 霞水母的个体介于15—60 cm间,均值为(40±14.17)cm; 四叶小舌水母的个体介于2—6 cm,均值为(3.71±1.05)cm。
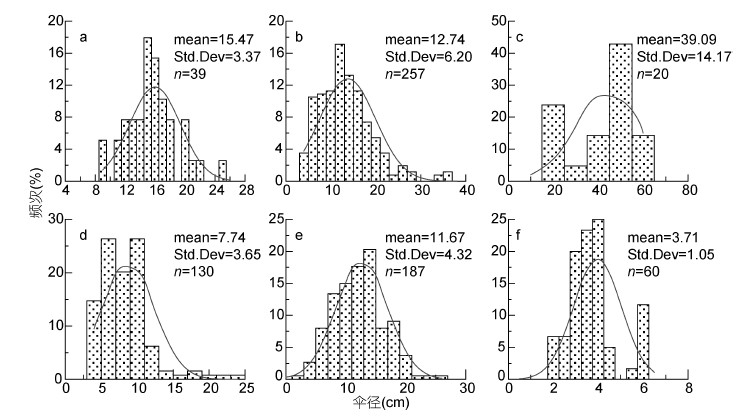 |
| 图 3 2015年5月黄海和东海北部大型水母个体伞径大小百分比分布。a. 洋须水母; b. 沙海蜇; c. 霞水母; d. 黄海中部的多管水母; e.东海北部的多管水母; f. 四叶小舌水母 Fig. 3 Occurring frequency distributions of bell diameters of large jellyfish in the Yellow Sea and northern part of East China Sea during May 2015. a. Ulmaridae; b. Nemopilema nomurai; c.Cyanea spp.; d. Aequorea spp. in the Yellow Sea; e. Aequorea spp. in the northern part of East China Sea; f. Liriope tetraphylla |
各水母的平均伞径分布如图 4所示。由西往东,随底层水温的降低,洋须水母伞径有所增加(图 1c和图 4a)。伞径小于5cm的沙海蜇多出现于底层盐度31—32.5的区域。图 4b中,多数站位的沙海蜇平均直径<15cm,沙海蜇的平均伞径总体分布趋势以123.5°N—124.5°N为中心,分别向东、济州岛南侧以及向西、长江口近岸两侧增加。霞水母出现的个体不多,结合图 1b、图 1c和图 4c,其伞径随离岸、温度降低而逐渐减少。黄海和东海北部的多管水母伞径均表现为由西向东逐渐增加的趋势。四叶小舌水母的平均伞径分布相对均匀、均值为4cm。
 |
| 图 4 2015年5月黄海和东海北部大型水母伞径(cm)和生物量密度(kg/km2)地理分布。a. 洋须水母; b. 沙海蜇; c. 霞水母; d. 多管水母; e. 四叶小舌水母 Fig. 4 Distributions of bell diameters(contours)and biomass(circle)of large jellyfish in the Yellow Sea and northern part of East China Sea during May 2015. a. Ulmaridae; b. Nemopilema nomurai; c. Cyanea spp.; d. Aequorea spp.; e.Liriope tetraphylla |
各大型水母种类的生物量密度地理分布特征为: 黄海北部和中部东侧主要为洋须水母,高密区(生物量密度>1000 kg/km2)位于黄海中部36ºN断面的124ºE东侧(图 4a); 黄海中部西侧主要为多管水母,其生物量密度一般<200 kg/km2,但在邻近121.5ºE、35.5ºN区域有>20000 kg/km2极高密区(图 4d)。东海北部为多管水母、霞水母、沙海蜇和四叶小舌水母。沙海蜇集中出现于31ºN—33ºN、东海北部与黄海南部交汇区(图 4b),其生物量密度介于1—200 kg/km2; 霞水母出现于31ºN以南东海北部近岸、近长江口岸西侧水域,其生物量密度介于80—300 kg/km2(图 4c); 多管水母在东海北部分布较广,在近岸和外海水域都有分布,未出现类似于黄海中部的极高密区(图 4d),该种出现站位的生物量密度介于1—300 kg/km2。
由表 1和图 5,5月的整个调查区域,大型水母的总生物量近6万t。各调查分区中,以黄海中部的水母生物量密度和总生物量最高,该分区水母生物量密度>1000 kg/km2、总生物量超过5万t; 其次为东海北部近岸; 黄海南部水母生物量密度和生物量最低。出现的水母中,以黄海中部的多管水母的生物量最高,其次为黄海中部的洋须水母。东海北部外海以多管水母和沙海蜇的生物量较高; 东海北部近岸水母生物量主要由沙海蜇和霞水母组成。
| 分区 | 洋须水母 Ulmaridae | 沙海蜇 Nemopilema nomurai | 霞水母 Cyanea spp. | 多管水母 Aequorea spp. | 四叶小舌水母 Liriope tetraphylla | 水母总计 | |
| 平均生物 量密度 (kg/km2) | 黄海北部 | 17.33 | — | — | — | — | 17.33 |
| 黄海中部 | 266.11 | — | — | 1101.03 | — | 1367.13 | |
| 黄海南部 | 0.79 | 0.29 | — | 1.52 | — | 2.85 | |
| 东海北部外海 | — | 26.20 | — | 32.16 | 0.51 | 41.00 | |
| 东海北部近岸 | — | 17.84 | 49.88 | 6.77 | 5.28 | 79.78 | |
| 总生物量 (t) | 黄海北部 | 688 | — | — | — | — | 688 |
| 黄海中部 | 10572 | — | — | 43743 | — | 54315 | |
| 黄海南部 | 31.59 | 11.57 | — | 60.34 | — | 113.18 | |
| 东海北部外海 | — | 1043.16 | — | 1280.69 | 20.30 | 1632.57 | |
| 东海北部近岸 | — | 711.58 | 1989.25 | 269.86 | 210.75 | 3181.43 | |
| 总计 | 11291.59 | 1766.31 | 1989.25 | 45353.89 | 231.05 | 59930.18 |
 |
| 图 5 2015年5月黄海和东海北部大型水母和渔业生物生物量(t)和密度(kg/km2)相对组成。Fish: 鱼类; Crustacea: 甲壳类; Cephalopoda: 头足类; Jellyfish: 水母类。图中横坐标DⅠ-DⅤ分别代表黄海北部、黄海中部、黄海南部及东海北部外海、东海北部近海 Fig. 5 Relative biomass and stock density compositions of jellyfish and other fishery organisms in the Yellow Sea and the northern part of East China Sea in May 2015. The DI-DV on the X-axis stand for the divisions of the northern, central, and southern part of the Yellow Sea, and offshore, inshore of the northern part of the East China Sea |
本次调查,利用扫海面积法估算的鱼类、头足类和甲壳类的总生物量为7.5万t,其中鱼类生物量评估值为5.1万t。东海北部总生物量高于黄海各分区的相应值(图 5)。在黄海,以中部的鱼类生物量最高。与上述渔业生物生物量相比较,除黄海中部外,其它四分区的水母生物量均小于鱼类生物生物量。黄海中部的水母生物量远超过该区域内其它渔业生物相应值,是后者的4.22倍; 黄海南部水母生物量所占比例较低,仅为该分区上述三类渔业生物的1%,其它三个分区的水母生物量约占各分区的总渔业生物生物量的10%。
对比图 1f和图 4,霞水母和部分多管水母出现站位为渔业生物高密区(>750 kg/km2),洋须水母密集区的鱼类生物生物量密度较低(<100 kg/km2),其它水母密集出现的水域为渔业生物生物量密度次高密集区(介于125—250 kg/km2)。
调查区底层水温介于4.6—20.2℃、盐度介于29.8— 34.3。以洋须水母出现站位的水温最低、霞水母出现的盐度和温度最高。洋须水母的高密区的底层水温和盐度分别是7℃和32.7。沙海蜇分布的底层水温范围介于洋须水母和霞水母之间、但其分布的盐度范围低于洋须水母相应值。沙海蜇最高生物量出现的站位的底层温度和盐度分别为12.76℃和32.67。四叶小舌水母出现的温度也较高且其出现的盐度范围较广。
从相关性分析来看,除霞水母与所分布域的底层水温呈显著正相关外,其它水母与底层水温、盐度和鱼类密度的相关性均不显著(表 2)。
| 种类 | 底层温度(BST)范围 | 底层盐度(BSS)范围 | 相关性分析 | ||
| BST | BSS | Fish | |||
| 洋须水母Ulmaridae | 5.37—9.67 | 32.11—33.39 | -0.10 | 0.03 | -0.10 |
| 沙海蜇Nemopilema nomurai | 10.82—17.68 | 29.84—32.67 | -0.24 | 0.27 | 0.28 |
| 霞水母Cyanea spp. | 16.98—19.32 | 33.50—34.30 | 0.90* | 0.71 | -0.44 |
| 多管水母(黄海)Aequorea spp.(in the YS) | 7.33—12.62 | 31.34—32.69 | -0.47 | -0.49 | -0.16 |
| 多管水母(东海)Aequorea spp.(in the ECS) | 10.82—17.20 | 30.23—33.55 | -0.16 | 0.25 | 0.10 |
| 四叶小舌水母Liriope tetraphylla | 15.05—17.68 | 29.84—33.30 | 0.39 | 0.26 | 0.37 |
| *显著相关(P<0.05) | |||||
除瘤手水母和一未知水母外,本文中所述及的其它水母均为该季节黄海和东海北部区域内的常见种类(Zhang et al,2012)。总体而言,5月黄海及东海北部海区,大型水母分布具有明显地理区域性,以黄海中部水母生物量最高。主要出现的水母种类的分布由北向南、由西向东分别为: 洋须水母、多管水母、沙海蜇、多管水母和霞水母。其中,洋须水母主要分布于黄海中、北部50m水深以深的东侧水域; 多管水母主要分布于黄海中部50m水深以浅的西侧,及在整个东海北部都有出现,其高密区位于31°N以南; 沙海蜇主要分布于黄、东海交汇区31°N—33°N间; 四叶小舌水母和霞水母较为集中出现于31°N以南、123°E以西近海。各水母种类的高密区的底层水温按洋须水母、沙海蜇、四叶小舌水母、霞水母依次升高。东海多管水母分布区的底层水温与沙海蜇分布区相近; 黄海多管水母分布区的底层水温较洋须水母分布区略高。霞水母和洋须水母多出现于相对高盐区域,多管水母次之; 沙海蜇和四叶小舌水母较其它水母的适温范围更宽。
黄、东海4—5月以多管水母生物量居多(程家骅等,2005)。从拍摄的海上照片来看,多管水母可能包含3种以上,因技术原因未加以区分。5月正值多管水母旺发季节,该种类在沿岸站位(水深<50m)出现的频率和生物量很高,但有关该水母类在黄海生态学研究报道仅见Zhang等(2012)。这可能由于该水母类并非经济种类,且个体小、透明,较其它种类含水量大、脆,拖网过程受机械挤压易破碎,不会像沙海蜇或霞水母聚集后堵塞渔网,而且该水母的粘糊残碎部分可以通过海水冲洗及筛滤而分离出去,对渔业生产影响较小,因而并未受到较多的关注。多管水母主要摄食鱼卵、桡足类及包括其它水母在内的胶质浮游生物。根据本文研究结果(表 1),5月多管水母在黄海中部的生物量超过4万t,接近此季黄海和东海北部海区内所有鱼类生物资生物量。以该水母类含水量为96%—97%和干重含碳量3.15%(Zhang et al,2012; 王彦涛等,2012)估算,黄海中部的多管水母碳含量为50—60t。如果按照10%同化率、浮游动物鲜重含水量80%和干重含碳量40%的均值计算,则黄海中部的多管水母现存量至少需要90—100 mg/m2饵料浮游生物支持。由唐启升(2006),黄海中部的饵料浮游生物生物量较低,1998年5月黄海中部(调查站位平均水深65m)的饵料浮游动物生物量平均不足1000mg/m2。假设不考虑年度差异,可粗略地认为黄海中部多管水母的现存量需要近1/10的饵料浮游动物生物量来支持。因此,春季,多管水母在黄海中部的旺发对海域内浮游生物群落存在着很大的摄食压力,其在该海域生态系统的地位和作用应不容忽视。多管水母在东海北部也是一类季节性旺发的水母(周永东等,2004; 程家骅等,2005)。图 4d显示东海北部多管水母的密集区与之前报道的济州岛南侧,长江口外和舟山外30°N以北分布区域(周永东等,2004; Zhang et al,2012)基本相符。此外,本文图 4d中东海北部的多管水母较黄海中部的伞径要大,且多管水母伞径分布与长江口和浙江外墨绿多管水母(Aequorea coerulescens)伞径分布相似,均为随离岸而增大(王彦涛等,2012)。究其原因,可能是温度越高、离发生源地越远的站位,多管水母的伞径会相对较大(王彦涛等,2012)。
沙海蜇广泛分布于渤海、黄海、东海以及日本海、鄂霍次克海、瀬戸内海和西太平洋(Omori et al,2004; Kawahara et al,2006; Uye,2008; Yoon et al,2008; Dong et al,2010; Zhang et al,2012)。其夏、秋季高密度聚集,对渔业生产危害特别大,因而近年来受到中、日、韩三国学者的格外关注。根据野外生态调查和物理模式分析结果,黄、东海沙海蜇多出现于5—12 月的30°N以北海域,幼体最早发现于黄、东海交界处、长江口外海域,之后水母体分布范围向北、东北向扩展,个体也逐渐增大,10—12月生物量急剧减少、分布范围回缩; 东海北部、长江口外水域是黄、东海沙海蜇旺发的起源地已基本形成共识,但该来源地的具体地理分布范围还存在着一定分岐(程家骅等,2004; 孙松,2012; Yoon et al,2014; Kitajima et al,2015; Sun et al,2015)。Sun等(2015)在长江口外31.50°—33.00°N、122.00°—122.75°E发现有沙海蜇蝶状体的分布。Toyokawa等(2012)在该区域外的东侧和西北侧(32°12.30′N,123°12′E; 34°05.8′N,121°50.00′E)也曾报道发现蝶状幼体。本文调查范围未包括Sun等(2015)研究中123°E以西的水域,而且受采样方式所限,无法采集到伞径小于2cm的个体。但就目前的调查而言,出现许多幼水母(伞径<5 cm)中心区域主要位于123.5°—124.5°N。此区曾在2011年5月发现有蝶状幼体(Toyokawa et al,2012)。沙海蜇旺发时间、年份及扩散分布往往受黄海冷水团、长江冲淡水等强弱消长、风和海流、温度和盐度分布、食物丰度的作用(Yoon et al,2008,2014; Moon et al,2010; Kitajima et al,2015),它的生物量和密集区等具有明显的年间变化(丁峰元等,2007; Sun et al,2015)。黄、东海的沙海蜇虽有广泛的温度(7.5—28℃)和盐度(28.6—34.7)适应性,但其幼水母体更偏向于分布于相对高温低盐水域(李建生等,2009; 王彬等,2013)。本文结果显示沙海蜇幼水母体分布中心的底温为15—16℃、底盐介于31.5—32(图 1c、1f和图 4b),这与Sun等(2015)观察蝶状幼体出现的底层水温16.4℃和底层盐度31.4基本相近。在此,作者认为长江口外沙海蜇发生源地应受水文分布影响而存在着一定程度的地理分布年间差异。
与沙海蜇相似,霞水母也主要发生于长江口及邻近海域(孙松,2012)。但霞水母生态习性更偏暖水高盐(Dong et al,2008; Zhang et al,2012; 王彬等,2014),与温度表现了显著的正相关(表 2)。它在东海主要分布于31ºN以南的暖水高盐水域(周永东等,2004; 程家骅等,2005; Zhang et al,2012),从地理分布上可以容易地与沙海蜇区分开来。表 1中霞水母在东海北部的生物量仅为49 kg/km2,远低于2007年同期的平均生物量380 kg/km2(Zhang et al,2012),这可能因为本文的调查范围仅限于30ºN以北离岸水域,并未涉及浙江中部近岸高密集区(周永东等,2004; Zhang et al,2012)。
本次调查出现的洋须水母个体较大,多为成体,其主要分布在北黄海和南黄海的水深>50m、底层水温<9℃的冷水区域,这是因为该种类是适温范围较窄的冷水性种类,主要分布在黄海冷水团控制的中部水域(Zhang et al,2012)。与已报道的该种适温范围(7.67—11.93 ºC)(Zhang et al,2012)相比较,本文发现该种可出现于更低温的冷水水域,底层水温的最低域值可达5.37℃,且其高密集区的底层水温7—8℃和盐度32—33(图 4和图 1)亦低于Zhang等(2012)报道的9—10℃和33—34。
除上述水母外,长江口近岸水域春季还出现斑块状聚集的四叶小舌水母(Zhang et al,2012)。该水母个体较小(<6cm),对渔业生产影响较小,故不易受关注,受采样网具采集效率所限,本文估算该种的生物量远小于实际值。
很多研究表明,6月之后东海北部夏、秋季水母的旺发往往伴随着渔业资源量的下降以及渔业生物群落结构的改变(陈卫平等,2007; 单秀娟等,2011; 李建生等,2015); 但5月大型水母分布与渔业生物并不表现显著相关(单秀娟等,2011)。从本文结果来看,5月黄海和东海北部的分区中,水母生物量高的区域,鱼类生物的生物量也并不低(图 5)。各水母的资源密度分布并未与水温、盐度及渔获生物量表现出显著的相关性,水母对鱼类生物的生物量分布的作用并不清晰。可能的解释是,5月是许多鱼类孵育、种群补充的季节,我们在实际渔获生物中发现了许多仔稚幼鱼,但它们并不构成渔获生物生物量主体。夏、秋季,水母数量及分布区域的快速增加,对鱼类补充群体形成巨大的摄食压力和食物竞争,由此可能引起渔业生物资源量和生物群落结构的明显改变。
4 结语从本文大型水母的种类组成及生物量分布格局可以看出,2015年5月黄海和东海北部各大型水母分布表具有很明显的地理偏好性。这一时期内对渔业生产危害较大的沙海蜇尚处于种群补充初期,个体小、数量少。水母的生物量主要贡献者为多管水母。5月,水母总生物量虽然远低于其它报道中的夏秋季,但其与当月的其它渔业生物生物量评估值相当,因此黄海和东海北部水母对生态系统中其它生物摄食压力和食物竞争力应不容低估。
致谢 本文海上调查航次由农业部“黄渤海渔业资源调查”专项资助,海上采样获得了“北斗”渔业调查船全体船员的大力支持,水母样品鉴定得到了中国科学院海洋研究所张芳老师的技术指导,谨致谢忱。| 丁峰元,程家骅, 2005.东海区夏、秋季大型水母分布区渔业资源特征分析.海洋渔业, 27(2):120-128 |
| 丁峰元,程家骅, 2007.东海区沙海蜇的动态分布.中国水产科学, 14(1):83-89 |
| 王彬,李玉龙,沈鸿等, 2014. 2005-2013年辽东湾北部近海白色霞水母的数量分布.海洋渔业, 36(2):146-154 |
| 王彬,秦宇博,董婧等, 2013.辽东湾北部近海沙蜇的动态分布.生态学报, 33(6):1701-1712 |
| 王世伟,张光涛,孙松等, 2012. 2011年夏季胶州湾三种大型水母的种群动态研究.海洋与湖沼, 43(3):471-479 |
| 王彦涛,孙松,王世伟等, 2012. 2011年春季黄、东海墨绿多管水母(Aequorea coerulescens)分布特征.海洋与湖沼, 43(6):1096-1102 |
| 江红,程和琴,徐海根等, 2010.大型水母爆发对东海生态系统中上层能量平衡的影响.海洋环境科学, 29(1):91-95 |
| 孙松, 2012.对黄、东海水母暴发机理的新认知.海洋与湖沼, 43(3):406-410 |
| 严利平,李圣法,丁峰元, 2004.东海、黄海大型水母类资源动态及其与渔业关系的初探.海洋渔业, 26(1):9-12 |
| 李凡,李显森,赵宪勇, 2008.底拖网调查数据的Delta-模型分析及其在黄海小黄鱼和银鲳资源评估中的应用.水产学报, 32(1):145-151 |
| 李建生,凌建忠,程家骅, 2014.中国海域两种大型食用水母利用状况分析及沙海蜇资源量评估.海洋渔业, 36(3):202-207 |
| 李建生,凌建忠,程家骅, 2015.东、黄海沙海蜇暴发对游泳动物群落结构的影响.海洋渔业, 37(3):208-214 |
| 李建生,凌建忠,程家骅等, 2009. 2008年夏秋季东海区北部沙海蜇资源状况分析.海洋渔业, 31(4):444-449 |
| 张海彦,赵亮,魏皓, 2012.青岛外海夏季水母路径溯源研究.海洋与湖沼, 43(3):662-668 |
| 陈卫平,薄治礼,周婉霞等, 2007.浙江海域常见水母种类及旺发年份对渔业生产影响的调查研究.浙江海洋学院学报(自然科学版), 26(3):266-271 |
| 罗晓凡,魏皓,王玉衡, 2012.黄、东海水母质点追踪影响因素分析.海洋与湖沼, 43(3):635-642 |
| 周永东,刘子藩,薄治礼等, 2004.东、黄海大型水母及其调查监测.水产科技情报, 31(5):224-227 |
| 单秀娟,庄志猛,金显仕等, 2011.长江口及其邻近水域大型水母资源量动态变化对渔业资源结构的影响.应用生态学报, 22(12):3321-3328 |
| 唐启升, 2006.中国专属经济区海洋生物资源与栖息环境.北京:科学出版社, 3-380 |
| 程家骅,丁峰元,李圣法等, 2005.东海区大型水母数量分布特征及其与温盐度的关系.生态学报, 25(3):440-445 |
| 程家骅,李圣法,丁峰元等, 2004.东、黄海大型水母暴发现象及其可能成因浅析.现代渔业信息, 19(5):10-12 |
| Dong J, Sun M, Wang B et al, 2008. Comparison of life cycles and morphology of Cyanea nozakii and other scyphozoans. Plankton and Benthos Research, 3(Sl):118-124 |
| Dong Z J, Liu D Y, Keesing J K, 2010. Jellyfish blooms in China:dominant species, causes and consequences. Marine Pollution Bulletin, 60(7):954-963 |
| Jiang H, Cheng H Q, Xu H G et al, 2008. Trophic controls of jellyfish blooms and links with fisheries in the East China Sea. Ecological Modelling, 212(3-4):492-503 |
| Kawahara M, Uye S I, Ohtsu K et al, 2006. Unusual population explosion of the giant jellyfish Nemopilema nomurai (Scyphozoa:Rhizostomeae) in East Asian waters. Marine Ecology Progress Series, 307:161-173 |
| Kitajima S, Iguchi N, Honda N et al, 2015. Distribution of Nemopilema nomurai in the southwestern Sea of Japan related to meandering of the Tsushima Warm Current. Journal of Oceanography, 71(3):287-296 |
| Lenz J, 2000. Introduction. In:Harris R P, Wiebe P H, Lenz J eds. ICES Zooplankton Methodology Manual. London:Academic Press, 7 |
| Moon J H, Pang I C, Yang J Y et al, 2010. Behavior of the giant jellyfish Nemopilema nomurai in the East China Sea and East/Japan Sea during the summer of 2005:a numerical model approach using a particle-tracking experiment. Journal of Marine Systems, 80(1-2):101-114 |
| Omori M, Kitamura M, 2004. Taxonomic review of three Japanese species of edible jellyfish (Scyphozoa:Rhizostomeae). Plankton Biology and Ecology, 51(1):36-51 |
| Shi Y Q, Sun S, Zhang G T et al, 2015. Distribution pattern of zooplankton functional groups in the Yellow Sea in June:a possible cause for geographical separation of giant jellyfish species. Hydrobiologia, 754(1):43-58 |
| Sun S, Zhang F, Li C L et al, 2015. Breeding places, population dynamics, and distribution of the giant jellyfish Nemopilema nomurai (Scyphozoa:Rhizostomeae) in the Yellow Sea and the East China Sea. Hydrobiologia, 754(1):59-74 |
| Toyokawa M, Shibata M, Cheng J-H et al, 2012. First record of wild ephyrae of the giant jellyfish Nemopilema nomurai. Fisheries Science, 78(6):1213-1218 |
| Uye S I, 2008. Blooms of the giant jellyfish Nemopilema nomurai:a threat to the fisheries sustainability of the East Asian Marginal Seas. Plankton and Benthos Research, 3(Sl):125-131 |
| Xu Y J, Ishizaka J, Yamaguchi H et al, 2013. Relationships of interannual variability in SST and phytoplankton blooms with giant jellyfish (Nemopilema nomurai) outbreaks in the Yellow Sea and East China Sea. Journal of Oceanography, 69(5):511-526 |
| Yoon W D, Lee H E, Han C et al, 2014. Abundance and distribution of Nemopilema nomurai (Scyphozoa, Rhizostomeae), in Korean Waters in 2005-2013. Ocean Science Journal, 49(3):183-192 |
| Yoon W D, Yang J Y, Shim M B et al, 2008. Physical processes influencing the occurrence of the giant jellyfish Nemopilema nomurai (Scyphozoa:Rhizostomeae) around Jeju Island, Korea. Journal of Plankton Research, 30(3):251-260 |
| Zhang F, Sun S, Jin X S et al, 2012. Associations of large jellyfish distributions with temperature and salinity in the Yellow Sea and East China Sea. Hydrobiologia, 690(1):81-96 |
 2016, Vol. 47
2016, Vol. 47


