中国海洋湖沼学会主办。
文章信息
- 陈漪, 王晓杰, 冉皓宇, 林昱. 2016.
- CHEN Yi, WANG Xiao-Jie, RAN Hao-Yu, LIN Yu. 2016.
- 海水模式种青鳉鱼(Oryzias melastigma)的胚胎发育观察
- DEVELOPMENTAL STAGES OF A MARINE MODEL FISH——MEDAKA ORYZIAS MELASTIGMA
- 海洋与湖沼, 47(1): 71-82
- Oceanologia et Limnologia Sinica, 47(1): 71-82.
- http://dx.doi.org/10.11693/hyhz20150100039
-
文章历史
- 收稿日期: 2015-01-31
- 收修改稿日期: 2015-08-01
2. 上海海洋大学国际海洋研究中心上海 201306;
3. 上海海洋大学海洋生物系统与神经科学研究所 上海 201306
2. International Center of Marine Study, Shanghai 201306, China;
3. Institute for Marine Biosystem and Neurosciences, Shanghai Ocean University, Shanghai 201306, China
海水青鳉鱼(Oryzias melastigma)隶属辐鳍亚纲(Actinopterygii)、颌针鱼目(Beloniformes)、怪颌鳉科(Adrianichthyidae)、青鳉属(Oryzias),原产于印度沿岸(Abraham,2013)。由于海水青鳉鱼具有个体小、性别容易区分、世代周期短、产卵率高、盐度适应范围广等特点,目前已被推荐为“一种理想的海洋模式鱼种”(Kong et al,2008;Bo et al,2011;Dong et al,2014)。由于对污染物干预敏感,海水青鳉越来越广泛用于海洋生态毒理学研究,其胚胎已被国际生命科学学会健康和环境科学研究所认定为毒理学研究的重要工具(Dong et al,2014)。
在基因组学中,淡水日本青鳉(O.latipes)全基因组序列已经解析,而海水青鳉鱼与日本青鳉在系统发育上非常相近,因此海洋青鳉鱼基因信息也可较方便地获得,目前已开发出相关基因芯片(陈瑶等,2010)。海水青鳉鱼的分子生物学基础数据正逐步完备,目前已鉴定了一批器官特异性表达的分子标记物(如脑部、眼部、心脏、胸鳍、胰腺、肝脏、肌肉和神经等器官和系统)。Lau等(2014)利用小RNA深度测序技术,研究低氧胁迫对O.Melastigma雌雄成鱼的miRNAs影响。利用全胚胎免疫组化法筛选出的17种斑马鱼抗体可与海水青鳉鱼发生特异性的免疫反应(Chen et al,2011)。这些抗体与神经、心脏和脑部等器官的发育关系密切,为蛋白质水平的毒性研究提供了基础。此外,针对日本青鳉的解剖学和生理学等方面的研究已比较完善和系统(Huang et al,2011),这也为海水青鳉鱼的相关研究提供了参考资料。
鱼类发育的早期阶段对污染物最为敏感,因此,胚胎毒性分析是广泛应用的毒性检测方法,并认为是传统的鱼类毒性实验的替代方法(Brannen et al,2010;Embry et al,2010)。斑马鱼(Danio rerio),黑头呆鱼(Pimephales promelas)和日本青鳉鱼已被认为是典型的胚胎毒性分析种类(Chen et al,2011)。近年来,而海水青鳉鱼作为新兴的海水鱼模式种在胚胎毒性分析中也引起关注。有研究者(Iwamatsu,2004)已经详细描述了淡水日本青鳉的胚胎发育过程,但尚未见有关海水青鳉胚胎发育的有关报道。本研究对海洋青鳉鱼(O.melastigma)的繁殖习性以及胚胎发育过程进行了详细的观察,它的早期胚胎发育过程无论是在基因组学和分子生物学,还是在环境毒理学上的应用都有着密切的联系,本研究结果在于积累海水青鳉鱼在发育生物学上的基础资料,为进一步的科学研究提供参考。
1 材料与方法 1.1 实验鱼养殖海水青鳉鱼2—3月龄即进入性成熟,本试验选用3月龄性成熟海水青鳉置于室内循环水体中养殖。实验用水是由曝气自来水加入红海盐配制而成,盐度为31,水温控制在27—28.5°C;定期换水、吸污;光暗周期为14h : 10h;每天3次,定时投喂初孵卤虫的无节幼体,达到饱食。
1.2 人工采卵及孵化方法根据臀鳍的形态,可区分青鳉鱼的雌雄(图 1a,图 1b)。雌性青鳉大约在每天早上8—9点产卵(光照开始后1h),卵通过长丝挂于雌性青鳉鱼泄殖腔,受精,悬挂数小时后脱落(图 1c)。为了及时发现刚受精的受精卵,当发现雌鱼泄殖腔附近有成簇的受精卵后,立即将雌鱼用鱼网捞出,置于垫有滤棉的大培养皿中,用镊子将受精卵取下,转移到装有新鲜配置海水培养皿中。每天更换培养皿中的海水,水温控制在25.5—27.5°C,盐度31,pH为8.15—8.20。
 |
| 图 1 海水青鳉鱼性成熟亲鱼及未受精的卵子(标尺100 µm)Fig. 1 The matured marine medaka Oryzias melastigma and an unfertilizedegg(scale bar 100 µm) a. 雌性海水青鳉鱼性成熟亲鱼; b. 雄性海水青鳉鱼性成熟亲鱼; c. 雌性海水青鳉性成熟亲鱼挂卵; d. 海水青鳉鱼未受精的卵子 |
取受精卵在解剖镜下观察其外部形态变化,在观察到1细胞期后立即使用Zeiss Stereo Discovery V12体视显微镜进行连续拍照。为达到最佳的拍摄效果,依照Iwamatsu(2014)的方法并加改动,将受精卵放入浮游动物计数框上加盖玻片进行拍照,盖玻片下有1mm深的凹槽,拍摄时轻轻移动盖玻片可调整受精卵的朝向。在胚胎发育前期,每5min观察一次,到达囊胚阶段后每1h观察一次,器官形成后每6h观察一次,选取胚胎发育各个时期的典型形态特征拍照。
2 结果 2.1 卵的特征青鳉鱼卵为球形,半透明,直径约为0.9mm;卵具有一定的粘性,卵黄被一层较厚的绒毛膜紧密包裹,绒毛膜上具有长短不一的丝状小绒毛均匀地分布在整个绒毛膜表面,中心是一个大的透明的卵黄囊,在未受精的情况下,直径为10—30µm的微油滴嵌其中(图 1d);接近卵的植物极,有粘性长细丝成簇状地分布;雌鱼产卵时卵子的粘性长丝一头附着在泄殖腔内,另一头固着在绒毛膜上,使产出的未受精卵成簇的悬挂在雌鱼泄殖腔后方(图 1)。雌鱼挂卵后,雄鱼追赶雌鱼,排精,进行授精。青鳉鱼受精卵属于沉性卵,受精后沉于水底。
2.2 胚胎发育观察采受精卵进行胚胎发育观察。首先,根据青鳉鱼胚胎发育时序及形态特点,对其胚胎发育过程进行分期,整个发育过程分为受精卵激活阶段、受精卵胚盘形成阶段、卵裂阶段、囊胚阶段、原肠胚阶段、神经胚阶段、器官形成阶段、孵化出膜阶段8个阶段。根据各阶段形态特征的变化,又把整个发育阶段划分为33个时期(各时期发育简要特征、受精后时间见表 1),受精卵在平均26°C的水温条件下,10天内孵化出膜,历时220h30min。
| 发育时期 | 各发育时期简要特征 | 受精后时间 | 图序(图 2) |
| 1. 受精卵激活阶段 | 均匀地分散的油脂微滴逐渐融合,变大,数目变少并开始向植物极聚集 | 15min | 0-a 0-b 0-c |
| 2. 受精卵胚盘形成阶段 | |||
| 1细胞期 | 原生质向动物极集中而形成凸起的胚盘 | 1h | 1-1 1-2 |
| 3. 卵裂阶段 | |||
| 2细胞期 | 第一次卵裂,胚盘经裂为两个大小相等的卵裂球 | 1h 15min | 2-1 2-2 |
| 4细胞期 | 第二次卵裂,与第一次卵裂沟相垂直,胚盘分为四个大小相等的卵裂球 | 1h 45min | 3-1 3-2 |
| 8细胞期 | 第三次卵裂,胚盘分为八个不等卵裂球 | 2h | 4-1 4-2 |
| 16细胞期 | 第四次卵裂,胚盘被分裂成十六个大小不等的卵裂球,形成4行排列,卵裂沟不明显 | 2h 50min | 5-1 5-2 |
| 32细胞期 | 第五次卵裂,胚盘周边卵裂球发生经裂,胚盘中央区域卵裂球发生水平分裂, 形成两层分布 | 3h 10min | 6-1 6-2 |
| 桑葚胚早期 | 卵裂球越分越小,大小不一 | 4h | 7-1 7-2 |
| 桑葚胚晚期 | 细胞变得更小,边缘细胞分裂增多 | 4h 30min | 8-1 8-2 |
| 4. 囊胚阶段 | |||
| 囊胚早期 | 胚盘细胞很小,半圆形囊胚层形成 | 5h | 9-1 9-2 |
| 囊胚中期 | 细胞界限逐渐不清晰 | 8h | 10-1 10-2 |
| 囊胚晚期 | 细胞分裂向胚盘边缘扩散,细胞越来越小,完全分不出细胞界限 | 10h 55min | 11-1 11-2 |
| 囊胚扩展 | 胚盘平坦,外包开始 | 15h | 12-1 12-2 |
| 5. 原肠胚阶段 | |||
| 原肠胚起始 | 细胞层扩展向植物极方向下包 | 17h | 13-1 13-2 |
| 原肠胚早期 | 胚层细胞覆盖卵黄囊的1/4 | 18h 30min | 14-1 14-2 |
| 原肠胚中期 | 胚层细胞覆盖卵黄囊的1/2,形成胚环,胚盾增厚 | 19h 30min | 15-1 15-2 |
| 原肠胚晚期 | 胚层细胞覆盖卵黄囊超过2/3,胚盾变窄 | 20h 45min | 16-1 16-2 |
| 6. 神经胚阶段 | |||
| 胚孔闭合前期 | 胚孔接近闭合 | 21h 15min | 17-1 |
| 胚孔闭合期 | 胚孔闭合; 胚体形成 | 25h 30min | 18-1 |
| 头部原基形成期 | 柱状胚体一端发育为头部原基 | 25h 30min | 19-1 19-2 |
| 7. 器官形成阶段 | |||
| 眼基形成期 | 头部两侧隆起眼原基 | 28h | 20-1 20-2 |
| 眼囊形成期 | 眼囊形成,克氏泡明显 | 29h | 21-1 21-2 |
| 耳囊和脑分化期 | 眼囊后方形成椭圆形耳胞原基 | 35h 30min | 22-1 22-2 |
| 耳囊和脑形成期 | 头部后方形成圆形耳囊,脑进一步分化 | 38h | 23-1 23-2 |
| 晶状体形成期 | 晶状体形成; 管状心脏形成 | 45h | 24-1 24-2 |
| 心脏形成期 | 心脏发育成长管状结构,出现在头部末端下方 | 58h 45min | 25-1 25-2 |
| 胚胎包围1/2卵黄囊期 | 心脏有微弱跳动,胚体包围卵黄囊的1/2 | 65h 30min | 26-1 26-2 |
| 心脏跳动期 | 心脏开始有节奏地跳动,克氏泡消失 | 70h | 27-1 27-2 |
| 卵黄静脉循环期 | 卵黄静脉形成,并且开始循环 | 80h | 28-1 28-2 |
| 胚胎包围3/4卵黄囊期 | 尾部的1/3脱离卵黄囊,耳石出现,眼球黑化 | 80h 15min | 29-1 29-2 |
| 胚胎完全包围卵黄囊期 | 胚胎完全包围卵黄囊 | 130h | 30-1 30-2 |
| 尾芽期 | 尾部鳍褶开始形成,胚胎下颌形成,卵内可以明显看到红色的血液流动 | 145h | 31-1 31-2 |
| 8. 孵化出膜阶段 | |||
| 出膜前期 | 血液循环明显; 绒毛膜变薄 | 217h | 32-1 32-2 |
| 出膜期 | 尾部和头部略微弯曲; 身体有色素斑点,卵黄囊为椭圆形 | 220h 30min | 33-1 33-2 |
处于刚受精阶段的卵,卵的外周是由较厚的绒毛膜包围,此时的绒毛膜和卵黄之间的卵周隙在体视镜下很难辨认。有许多油脂微滴均匀地分散在整个卵中(图 2.0-a);10min后,随着皮质泡的破裂开始形成卵周间隙,油滴逐渐融合,变大,数目变少并开始向植物极聚集(图 2.0-b);15min后卵周间隙更加明显,卵壳外绒毛膜变薄和硬化,可以看到它与卵黄逐渐分离,卵中央是大而透明的卵黄,周围形成宽的卵周隙。油滴进一步融合形成数个大油滴,并移向植物极(图 2.0-c)。
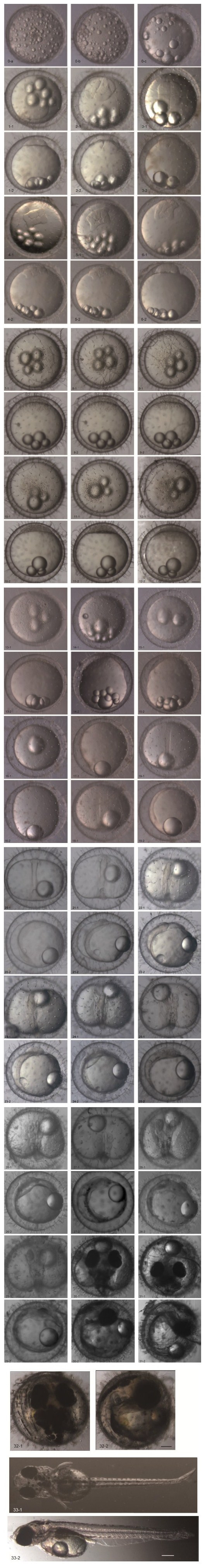 |
| 图 2 海水青鳉鱼胚胎发育照片(标尺100 µm)Fig. 2 Photos of embryonic development of marinemedaka O. melastigma (scale bar: 100 µm) |
受精后60min,靠近皮质侧的胞质开始往动物极聚集,随后原生质集中在动物极,并逐渐加厚而形成一个凸起,胚盘隆起呈帽状,即1细胞期;此时油滴已全部迁移到植物极,并开始聚集(图 2.1-1,1-2)。
2.2.3 卵裂阶段受精后1h 15min,受精卵开始卵裂。在动物极所在半球发生卵裂,形成第一次卵裂沟,胚盘逐渐由外向内缢裂,分裂成两个大小相似近半球形的卵裂球,进入2细胞期(图 2.2-1、2-2.);受精后1h 45min,出现第二次卵裂沟,与第一次卵裂沟相垂直形成4个大小形态相似的卵裂球,进入4细胞期(图 2.3-1、3-2);受精后2h,开始第三次卵裂,形成两条卵裂沟与第一次卵裂沟平行,将胚盘分成八个大小略有不同的卵裂球,排列成两行,每行四个卵裂球,进入8细胞期(图 2.4-1、4-2);受精后2h 5min,开始第四次卵裂,形成四行排列,外圈12个细胞较大,内部4个细胞较小,进入16细胞期(图 2.5-1、5-2);3h 10min,开始第五次卵裂,外缘的12个卵裂球经向分为24个卵裂球,中央的4个卵裂球水平分成8个卵裂球,形成两层分布,卵裂球不规则排列,为32细胞期(图 2.6-1、6-2);受精后4h,进入桑葚胚早期,卵裂球越分越小,大小不一且排列不规则,边缘卵裂界限较清晰(图 2.7-1、7-2)。细胞分裂的轨迹难以追踪,细胞大致呈3—4层排列,在外周的细胞较小且扁平。4h 30min,进入桑葚胚晚期,细胞变得更小,边缘细胞分裂增多,细胞堆叠为4—5层(图 2.8-1、8-2)。
2.2.4 囊胚阶段受精后5h,形成半圆形囊胚层,胚盘细胞很小,胚胎进入囊胚早期(图 2.9-1、9-2);受精后8h,进入囊胚中期,与囊胚早期无较大差别,细胞界限逐渐不清晰(图 2.10-1、10-2);受精后10h 55min,细胞数目增多且变得更小,分不出细胞界限,细胞分裂向胚盘边缘扩散,进入囊胚晚期(图 2.11-1、11-2)。受精后15h,胚盘开始延展,细胞越来越小,进入囊胚扩展期。胚盘变得平坦,在卵黄囊表面扩展,外包开始(图 2.12-1、12-2)。
2.2.5 原肠胚阶段17h囊胚层细胞逐渐增多,细胞层扩展并逐渐向植物极方向下包,原肠胚起始(图 2.13-1、13-2);18h30min,胚层细胞继续下包,覆盖卵黄囊的1/4,胚胎进入原肠胚早期(图 2.14-1、14-2);受精后19h 30min,进入原肠胚中期,胚层细胞继续下包,并内卷开始在胚层边缘形成胚环,胚层细胞在一侧向内插入,增厚形成胚盾,此时囊胚层覆盖卵黄接近1/2(图 2.15-1、15-2);受精后20h 45min,囊胚层继续下包,覆盖卵黄超过2/3,胚盾变窄并向动物极延伸,进入原肠胚晚期(图 2.16-1、16-2)。
2.2.6 神经胚阶段受精后21h 15min,囊胚层细胞下包至卵黄囊的底部,进入神经胚阶段,胚盾一端(靠近动物极处)膨大,胚孔边缘接近闭合,处于胚孔闭合前期(图 2.17-1);受精后25h 30min,胚孔闭合,进入胚孔闭合期,胚体形成,呈柱状(图 2.18-1),其中一段发育为头部原基(图 2.19-1、19-2)。
2.2.7 器官形成阶段受精后28h,进入眼基形成期,头部两侧出现一对肾形的隆起,为眼的原基,开始出现克氏泡(Kupffer′s vesicles)结构(图 2.20-1、20-2);受精后29h进入眼囊形成期,头部两侧的肾形隆起更加明显,眼囊形成,胚体尾部有明显的克氏泡结构,出现两个体节(图 2.21-1、21-2);受精后35h 30min,进入耳囊和脑分化开始期,在胚体背侧,眼囊后方形成椭圆形耳胞原基,位于胚体两侧;克氏泡在胚体尾部十分明显,油滴合并成一个大油球(图 2.22-1、22-2)。38h后,进入脑和耳囊形成期,头部后方形成圆形耳囊,脑进一步分化,前脑中脑后脑均可见,体腔扩张,体节6—9个(图 2.23-1、23-2);45h,进入晶状体形成期,视囊处出现晶状体结构,耳囊中缺乏耳石,前脑、中脑、后脑的界限逐渐分明,体腔扁平,心脏原基出现,开始形成管状心脏,胚体包围近卵黄囊体的1/2(图 2.24-1、24-2);胚胎发育至58h 45min,体腔进一步伸向眼囊泡的后端,耳囊尚未出现耳石,心脏发育成长管状结构,出现在头部末端下方,心脏有微弱跳动,但仍不明显(图 2.25-1、25-2);65h 30min管状心脏发育开始到达眼囊的后方,在腹侧区可以看到明显的血岛结构(在6—11体节之间),同样在腹侧区形成消化管,克氏泡明显缩小,胚体包围卵黄囊的1/2(图 2.26-1、26-2);胚胎发育至70h,开始心脏跳动期,心脏开始有节奏地跳动,可以观察到一对半圆形的居维叶氏(Cuvierian)管道在胚体左右两侧形成,克氏泡基本消失,胚胎尾尖自由脱离卵黄囊,胚体出现微弱抽动现象(图 2.27-1、27-2);胚胎发育至80h,进入卵黄静脉循环期,在尾部出现尾静脉,卵黄静脉由左右两侧居维叶氏管和尾静脉组成,居维叶氏管中观察到血液的流动(图 2.28-1、28-2);胚胎发育至90h 15min,进入胚胎包围3/4卵黄期,胚体包围卵黄囊的3/4,尾部的1/3脱离卵黄囊;胸鳍原基形成,耳石出现在充分扩展的耳囊内表面上,呈现为两个颗粒,眼球由于黑色素出现开始黑化(图 2.29-1、29-2);胚胎发育至130h,进入胚胎完全包裹卵黄囊时期,胚胎尾部离开卵黄囊(图 2.30-1、30-2);胚胎发育至145h,胚胎发育到达尾芽期,卵黄囊明显变小,胚胎包绕卵黄囊并且胚胎尾尖接触到眼睛,尾部鳍褶开始形成,胚胎下颌形成,卵内可以明显看到红色的血液流动,尾部开始出现色素细胞(图 2.31-1、31-2)。
2.2.8 孵化出膜阶段胚胎发育至217h,进入孵化出膜阶段。卵黄囊比之前阶段变得更小,胚体的血液循环路线可以清晰地看到,黄绿色的胆囊胚胎体可以在胚胎的侧面观察到,整个胚体偶尔在绒毛膜内翻转(图 2.32-1、32-2);发育至220h 30min左右,仔鱼开始陆续出膜,仔鱼出膜的方式主要是通过尾巴摆动破膜而出,尾巴出膜后,仔鱼通过猛烈抖动身体摆脱卵膜。刚出膜的仔鱼尾部和头部略微弯曲,体长约3—4mm,在水底很少运动,身体有少量色素斑;卵黄囊为椭圆形(图 2.33-1、33-2)。
3 讨论海水环境与淡水环境存在较大差异(如盐度,密度,pH,离子强度和溶解氧等),决定了污染物在海洋中的生态毒理学特性与在淡水中不同(French et al,2009;Jeon et al,2010)。同一属不同种的海水青鳉鱼(O.melastigma)和淡水青鳉鱼(O.latipes)在这两种环境中的反应也不同(Yang et al,2013),这些差异也表明淡水生态毒理的研究结果不能直接用于评估海水环境的毒性效应(伍辛泷等,2012;Dong et al,2014)。海水青鳉鱼目前已被推荐为“一种理想的海洋模式鱼种”。
本文对海水青鳉鱼的胚胎发育过程进行了观察及拍照,与日本青鳉鱼(Iwamatsu,2004)相似,胚胎发育遵循典型的硬骨鱼类的模式,即经过受精卵、卵裂、囊胚、原肠胚、神经胚、器官分化形成及出膜等时期。卵受精后不久,卵母细胞成熟,生殖泡破裂释放出第二极体并排出到细胞质表面,完成受精卵的激活并进一步形成胚盘。卵裂方式为盘状不完全卵裂,早期卵裂以经裂-纬裂的模式卵裂球自外向内发生缢裂,分裂迅速。其中,本文观察海水青鳉鱼在神经胚阶段中,胚孔闭合后,胚体出现;但是淡水青鳉鱼在原肠胚末期,囊胚层下包3/4时,胚体出现。这是整个胚胎发育过程中,观察到两种青鳉鱼发育时序上的主要差别。除此之外,Iwamatsu(2014)将淡水青鳉鱼的胚胎发育过程,以手绘图形式将各个发育时期的特征显示,本文利用显微拍照显示各个时期的发育特征,两篇文章可以互为补充。
青鳉鱼的卵和幼体对许多环境污染物和环境胁迫因子非常敏感(Tseng et al,2013;Tian et al,2014)。本文在对其发育过程各个时期特点进行描述后,将利于进行海洋环境因子变化对器官发育及发育进程影响的研究。并且,O.melastigma胚胎的分子分期,主要是心脏、胸鳍、脑、眼、肌肉、胰腺、肝脏和神经系统也已进行了研究(Chen et al,2011)。对青鳉鱼胚胎发育器官形态观察结合分子水平研究如利用基因敲除等技术,可以找到对污染物或其他环境胁迫因子敏感的基因,这将有助于更深入的阐述其毒理机制。
4 结论本文对海水青鳉鱼胚胎发育过程进行了观察和描述,整个发育过程分为受精卵激活阶段、受精卵胚盘形成阶段、卵裂阶段、囊胚阶段、原肠胚阶段、神经胚阶段、器官形成阶段、孵化出膜阶段八个阶段。根据各阶段形态特征的变化,又把整个发育阶段划分为33个时期。本研究为开展海洋生态毒理对海水青鳉鱼器官发育影响的研究提供了资料。
| 伍辛泷,黄乾生,方超等, 2012.新兴海洋生态毒理学模式生物——海洋青鳉鱼(Oryzias melastigma).生态毒理学报, 7(4):345-353 |
| 陈瑶,方志俊,郑金树等, 2010.海洋青鳉鱼专用型基因芯片的设计及其在生态毒理学上的应用研究.台湾海峡, 29(3):359-366 |
| Abraham R, 2013. Oryzias melastigma. The IUCN Red List of Threatened Species. Version 2014. 3, http://www.iucnredlist.org/details/172408/0 |
| Bo J, Cai L, Xu J H et al, 2011. The marine medaka Oryzias melastigma-a potential marine fish model for innate immune study. Mar Pollut Bull, 63(5-12):267-276 |
| Brannen K C, Panzica-Kelly J M, Danberry T L et al, 2010. Development of a zebrafish embryo teratogenicity assay and quantitative prediction model. Birth Defects Res B Dev Reprod Toxicol, 89(1):66-77 |
| Chen X P, Li L, Cheng J P et al, 2011. Molecular staging of marine medaka:a model organism for marine ecotoxicity study. Mar Pollut Bull, 63(5-12):309-317 |
| Dong S J, Kang M, Wu X L et al, 2014. Development of a promising fish model (Oryzias melastigma) for assessing multiple responses to stresses in the marine environment. BioMed Res Int, 2014:Article ID:563131, http://dx.doi.org/10.1155/2014/563131 |
| Embry M R, Belanger S E, Braunbeck T A et al, 2010. The fish embryo toxicity test as an animal alternative method in hazard and risk assessment and scientific research. Aquat Toxicol, 97(2):79-87 |
| French R A, Jacobson A R, Kim B et al, 2009. Influence of ionic strength, pH, and cation valence on aggregation kinetics of titanium dioxide nanoparticles. Environ Sci Technol, 43(5):1354-1359 |
| Huang Q S, Fang C, Wu X L et al, 2011. Perfluorooctane sulfonate impairs the cardiac development of a marine medaka (Oryzias melastigma). Aquat Toxicol, 105(1-2):71-77 |
| Iwamatsu T, 2004. Stages of normal development in the medaka Oryzias latipes. Mech Dev, 121(7-8):605-618 |
| Jeon J, Kannan K, Lim H K et al, 2010. Bioaccumulation of perfluorochemicals in Pacific oyster under different salinity gradients. Environ Sci Technol, 44(7):2695-2701 |
| Kong R Y C, Giesy J P, Wu R S S et al, 2008. Development of a marine fish model for studying in vivo molecular responses in ecotoxicology. Aquat Toxicol, 86(2):131-141 |
| Lau K, Lai K P, Bao J Y J et al, 2014. Identification and expression profiling of MicroRNAs in the brain, liver and gonads of marine medaka (Oryzias melastigma) and in response to hypoxia. PloS One, 9(10):e110698, http://dx.doi. org/10.1371/journal.pone.0110698 |
| Tian L, Cheng J P, Chen X P et al, 2014. Early developmental toxicity of saxitoxin on medaka (Oryzias melastigma) embryos. Toxicon, 77:16-25 |
| Tseng Y C, Hu M Y, Stumpp M et al, 2013. CO2-driven seawater acidification differentially affects development and molecular plasticity along life history of fish (Oryzias latipes). Comp Biochem Physiol A Mol Integr Physiol, 165(2):119-130 |
| Yang W K, Kang C K, Chang C H et al, 2013. Expression profiles of branchial FXYD proteins in the brackish medaka Oryzias dancena:a potential saltwater fish model for studies of osmoregulation. PloS One, 8(1):e55470 |
 2016, Vol. 47
2016, Vol. 47


