中国海洋湖沼学会主办。
文章信息
- 朱卫东, 任夙艺, 申屠琰, 邹李昶, 王志铮. 2016.
- ZHU Wei-Dong, REN Shu-Yi, SHENTU Yan, ZOU Li-Chang, WANG Zhi-Zheng. 2016.
- 水温对棘胸蛙(Paa spinosa)蝌蚪行为及尾部皮肤和肝脏相关功能酶活力的影响
- IMPACT OF WATER TEMPERATURE ON PAA SPINOSA TADPOLE BEHAVIOR AND ENZYME ACTIVITY IN TAIL SKIN AND LIVER
- 海洋与湖沼, 47(1): 245-252
- Oceanologia et Limnologia Sinica, 47(1): 245-252.
- http://dx.doi.org/10.11693/hyhz20141100301
-
文章历史
- 收稿日期: 2014-11-03
- 收修改稿日期: 2015-12-28
2. 余姚市水产技术推广中心 余姚 315040;
3. 宁波市江北区农林水利局 宁波 315020
2. Fishery Technology Extension Center of Yuyao, Yuyao 315400, China;
3. Forestry and Water Conservancy Bureau of Ningbo Jiangbei, Ningbo 315020, China
棘胸蛙(Paa spinosa)隶属于无尾目(Anura)、蛙科(Ranidae)、棘蛙属(Paa),系主布于我国南方丘陵海拔500—600m溪流区的特有大型水产经济动物(林光华等,1990),具很高的食用、保健和药用价值,是一种极具养殖开发潜力的名贵蛙种。棘胸蛙繁殖期为5—9月(陈平等,2012),属一年多次产卵类型(刘元楷等,1990; 耿宝荣等,2004),故在自然水温条件下,中、晚期孵化的蝌蚪需延至次年5—6月方可完成变态(杨伟国等,1990),致使其养成周期明显延长,管理成本和养殖风险显著提高。因此,开展人控条件下蝌蚪的适温性研究,以有效缩短蝌蚪阶段培育周期并显著提高变态成活率,无疑对于促进该蛙的集约化健康养殖具重要现实意义。
棘胸蛙为变温动物,培育水温往往与其运动强度和呼吸代谢水平有着极为密切的关系。已有研究也表明,水温为可改变棘胸蛙行为习性和影响其生长发育的重要环境因子。据报道,繁殖期雄性棘胸蛙体温与其鸣叫时长和音节时长均呈存显著负相关(陈平等,2012); 幼、成蛙均进入冬眠状态的临界水温为8℃(王爱民等,2002),适宜摄食和生长发育的水温范围为15—34℃,其中以18—30℃为最佳(胡石柳,1991); 蝌蚪孵化率达80%以上的培育水温为20— 23℃,且水温对蝌蚪表型生长具显著影响(陈雯等,2010),23℃为最利于蝌蚪快速增长的水温(陶志英等,2015),在相同营养条件下蝌蚪变态所需时长及变态时的体长和体重均随温度上升而减少,反之亦然(肖调义等,2004; 赵蒙蒙等,2014)。但迄今国内外尚未见有关水温胁迫下棘胸蛙蝌蚪行为和生理调节方面的系统报道。鉴于此,本文作者为探明棘胸蛙蝌蚪对水温的耐受与响应特征,并据此找寻最适养殖温度,在观察水温对棘胸蛙蝌蚪行为和尾部表观色泽影响的基础上,以兼具运动和呼吸功能的尾部与作为其机体代谢中枢的肝脏为靶标,较系统地开展了水温对棘胸蛙蝌蚪尾部、肝脏相关功能酶活力的影响研究,以期为指导该蛙蝌蚪的科学养殖提供基础资料。
1 材料与方法 1.1 材料 1.1.1 棘胸蛙蝌蚪购自浙江省余姚市龙坑石蛙养殖场,运回实验基地经停饲驯养2d(驯养水温19℃,为余姚市龙坑石蛙养殖场蝌蚪培育水温)后,选取其中肢体完好、规格相近、反应敏捷的1月龄健壮个体作为实验对象,具体规格为体长(1.694±0.121)cm、体质量(0.548±0.062)g。
1.1.2 理化条件以自然曝气48h,水温(24±0.2)℃、pH 7.30±0.01、DO(7.30±0.01)mg/L的自来水为实验水源,水质符合《NY 5051-2001无公害食品 淡水养殖用水水质》(中华人民共和国农业部,2001)要求。本研究以直径为32cm的白色圆形塑料盆为实验容器单元(实验实际容积为5L),并均采用SPX-250B-2型生化培养箱(温控范围: 2—60℃)调控驯养及实验水温。
1.1.3 检测试剂盒所用ATP、CAT、GSH-Px和SOD酶活力测试盒均购自南京建成生物工程研究所,以岛津UV-1240型紫外可见分光光度计为检测仪器,测定步骤及计算方法按所附说明书。
1.2 实验方法 1.2.1 水温胁迫下蝌蚪行为及尾部皮肤表观色泽Hunter L、A、B值的观测设置14、18、22、26和30℃五个实验水温处理组(每一处理重复3次,每个重复各投放蝌蚪10ind),以96h为实验周期,采用静水停饲实验法,连续观察其水层分布、集群状况与个体移动率(以30s为间隔,用有效像素1200万的尼康COOLPIX S570型照相机随机拍摄3次,并统计各实验水温处理组内发生位移的蝌蚪百分比),并于实验结束时刻,借助CR-400型色差分析仪分别测定实验蝌蚪尾部皮肤的黑、白斑表观色泽Hunter L、A、B值,每一实验水温处理组各任测实验蝌蚪5 ind。
1.2.2 水温胁迫及恢复后蝌蚪尾部皮肤组织和肝脏相关功能酶活力的测定设置19℃(驯养对照组)、21.5、23、24.5和26℃五个实验水温处理组(每一处理重复3次,每个重复各放蝌蚪10 ind),采用静水停饲实验法,以96h为水温胁迫时长,12d为水温恢复(恢复至驯养水温19℃)时长,以24h、48h、72h、96h、6d、12d为测定时点,开展水温对棘胸蛙蝌蚪尾部ATP酶和抗氧化酶(SOD和CAT),以及肝脏抗氧化酶(SOD,CAT,GSH)活力的影响实验。每一测定时点从各实验水温处理组中任取实验蝌蚪3 ind,于冰盘上解剖取尾部皮肤组织和肝脏后,标号保存于-80℃超低温冰箱备测。
1.3 数据处理采用LSD多重比较法分别检验不同水温处理组间尾部皮肤黑、白斑表观色差及相关功能酶活力的差异(P<0.05为显著水平)。上述统计分析均借助SPSS 17.0软件来完成。
2 结果 2.1 行为由表 1可见,棘胸蛙蝌蚪的行为与其所处水温环境关系密切,主要表现为:(1)14℃实验组蝌蚪静止于实验容器底部,18℃和22℃实验组蝌蚪出没于整个实验容器,而26℃和30℃实验组蝌蚪则仅分布于水表面;(2)诸实验组别中,仅14℃和30℃实验组蝌蚪无集群现象;(3)蝌蚪个体移动率随水温升高呈逐渐增大趋势,18℃和22℃实验组的个体移动率均低于50%,而26℃和30℃实验组蝌蚪的个体移动率则分别达86.67%和100%。综上可知,水温26℃和14℃分别为可显著改变蝌蚪分布水层和个体移动率的高、低温临界。
| 实验水温 | 14℃ | 18℃ | 22℃ | 26℃ | 30℃ |
| 分布区域 | 容器底部 | 整个容器 | 整个容器 | 水表面 | 水表面 |
| 群聚特征 | 分散 | 集群 | 集群 | 集群 | 分散 |
| 个体移动率 | 0 | 33.33% | 43.33% | 86.67% | 100% |
由表 2可见,棘胸蛙蝌蚪尾部皮肤黑、白斑表观色泽的A、B值均无组间差异(P>0.05),而L值则均呈14℃实验组≈18℃实验组≈22℃实验组<26℃实验组<30℃实验组,表明水温增加可显著改变用以表征棘胸蛙蝌蚪尾部皮肤亮度的L值,即L值可作为表征蝌蚪感应环境水温增高的指示色差,其中水温26℃为可致蝌蚪尾部表观色泽发生显著改变的高温临界。
| 部位 | 指标 | 实验水温 | ||||
| 14℃ | 18℃ | 22℃ | 26℃ | 30℃ | ||
| 黑斑 | L | 7.971±0.764 a | 8.008±0.558 a | 8.746±0.944 a | 10.919±0.922 b | 16.156±1.604 c |
| A | 1.064±0.108 a | 1.030±0.127 a | 0.962±0.094 a | 1.205±0.104 a | 1.167±0.109 a | |
| B | 3.148±0.365 a | 3.219±0.363 a | 2.993±0.223 a | 2.952±0.278 a | 3.094±0.403 a | |
| 白斑 | L | 20.955±2.221 a | 21.037±2.336 a | 21.844±2.066 a | 25.024±1.789 b | 35.05±3.408 c |
| A | 1.232±0.156 a | 1.052±0.121 a | 0.923±0.079 a | 1.020±0.101 a | 0.957±0.089 a | |
| B | 7.181±0.861 a | 7.046±0.452 a | 7.147±0.551 a | 7.106±0.604 a | 6.996±0.517 a | |
| 同一行上标不同字母表示具显著差异(P<0.05),字母相同表示无差异 | ||||||
由图 1可见,蝌蚪尾部皮肤ATP酶活力在水温胁迫及恢复条件下的变化特征主要表现为:(1)水温胁迫阶段,各测定时点的酶活力随水温升高均呈以19℃实验组(对照组)为最小(P<0.05)和24.5℃实验组为最大(P<0.05)的先升后降趋势,即24.5℃为蝌蚪尾部皮肤ATP酶耐受水温胁迫的最适高限;(2)水温恢复阶段,各测定时点酶活力随恢复前实验水温的升高均保持以26℃实验组与对照组持平(P>0.05)的先升后降趋势,其中恢复6d时的酶活力以23℃实验组为最大(P<0.05),而21.5℃实验组和24.5℃实验组间的酶活力则无显著差异(P>0.05),恢复12d时21.5℃实验组、23℃实验组和24.5℃实验组间的酶活力均无显著差异(P>0.05),即21.5—24.5℃为蝌蚪尾部皮肤ATP酶耐受温降胁迫的适温范围。
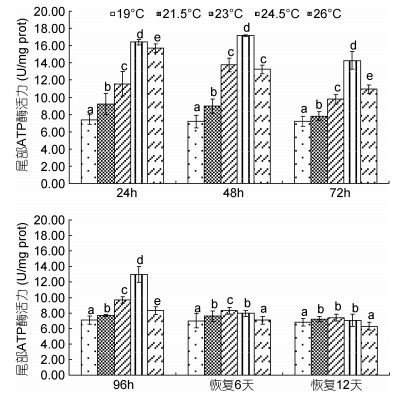 |
| 图 1 不同温度条件下棘胸蛙蝌蚪尾部ATP酶活力的变化 Fig. 1 The ATP activity in P.spinosa tadpole tail in different water temperatures |
由图 2可见,蝌蚪尾部皮肤SOD酶活力在水温胁迫及恢复条件下的变化特征主要表现为:(1)水温胁迫阶段,尾部皮肤各测定时点的酶活力均以对照组为最小(P<0.05),随实验时间推移,表露酶活力最大值的实验组别依次由26℃实验组、24.5℃实验组逐渐过渡至23℃实验组,即23℃为蝌蚪尾部皮肤SOD酶耐受水温胁迫的最适高限;(2)水温恢复阶段,尾部皮肤各测定时点的酶活力仍均以对照组为最小(P<0.05),恢复6d时23℃实验组、24.5℃实验组和26℃实验组间的酶活力均无显著差异(P>0.05),且均显著大于21.5℃实验组,恢复12d时的酶活力以26℃实验组为最大(P<0.05),24.5℃实验组则与21.5℃实验组持平(P>0.05),而23℃实验组均显著小于21.5℃实验组和24.5℃实验组(P<0.05),即降温胁迫后蝌蚪尾部皮肤SOD酶的活跃度以23℃实验组为最大,表明蝌蚪尾部皮肤SOD酶耐受温降胁迫的最适水温为23℃,适宜水温范围为21.5—24.5℃。
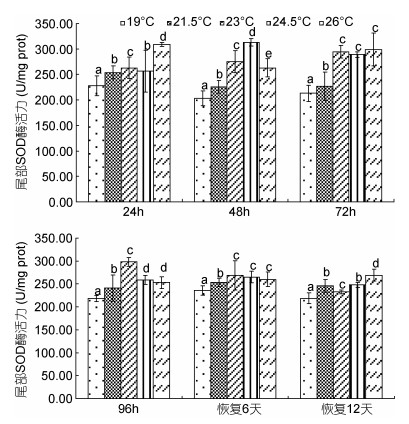 |
| 图 2 不同温度条件下棘胸蛙蝌蚪尾部SOD酶活力的变化 Fig. 2 The SOD activity in P.spinosa tadpole tail in different water temperatures |
由图 3可见,蝌蚪肝脏SOD酶活力在水温胁迫及恢复条件下的变化特征主要表现为:(1)水温胁迫阶段,肝脏各测定时点的酶活力均以对照组为最大(P<0.05)和26℃实验组为最小(P&llt;0.05),其中23℃实验组的酶活力均显著小于同一测定时点的21.5℃实验组和24.5℃实验组(P<0.05),即以水温23℃实验组为参照,其两侧实验组的肝脏SOD酶活力均会出现一定程度的高企,表明23℃为肝脏SOD酶处于未受胁迫状态下的水温,水温26℃时该酶已表露受损;(2)水温恢复阶段,对照组各测定时点的肝脏SOD酶活力均与21.5℃实验组持平(P>0.05),且两者均显著大于其它实验组(P<0.05),恢复6d时23℃实验组、24.5℃实验组和26℃实验组间的酶活力均无显著差异(P>0.05),而恢复12d时23℃实验组的酶活力则均显著大于24.5℃实验组和26℃实验组(P<0.05),即 23℃为蝌蚪肝脏SOD酶耐受温降胁迫的适温高限。综上可知,蝌蚪尾部皮肤和肝脏表露SOD酶活力的最适水温均为23℃。
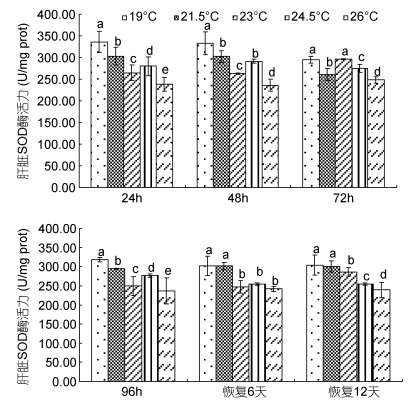 |
| 图 3 不同温度条件下棘胸蛙蝌蚪肝脏SOD酶活力的变化 Fig. 3 The SOD activity in P.spinosa tadpole liver in different water temperatures |
由图 4可见,蝌蚪尾部皮肤CAT酶活力在水温胁迫及恢复条件下的变化特征主要表现为:(1)水温胁迫阶段,尾部皮肤各观测时点的CAT酶活力均以对照组为最小(P<0.05),随实验时间推移,表露酶活力最大值的实验组别依次由26℃实验组、24.5℃实验组逐渐过渡至23℃实验组,即23℃为蝌蚪尾部皮肤表露CAT酶活力的最适水温;(2)水温恢复阶段,各测定时点的酶活力随恢复前实验水温的升高均保持以24.5℃实验组为最大(P<0.05)的先升后降趋势,其中26℃实验组恢复6d和12d时的酶活力分别与对照组和21.5℃实验组持平(P>0.05),即降温胁迫下蝌蚪尾部皮肤CAT酶的活跃度以24.5℃实验组为最大,而26℃则为蝌蚪尾部皮肤CAT酶耐受降温胁迫的临界高温。
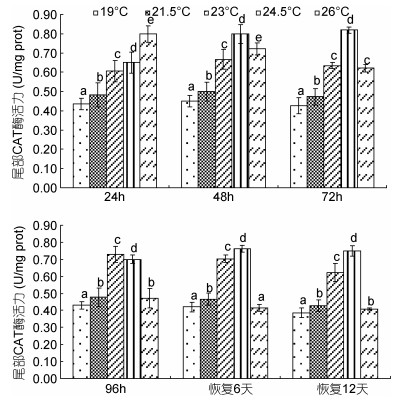 |
| 图 4 不同温度条件下棘胸蛙蝌蚪尾部CAT酶活力的变化 Fig. 4 The CAT activity in P.spinosa tadpole tail in different water temperature |
由图 5可见,蝌蚪肝脏CAT酶活力在水温胁迫及恢复条件下的变化特征主要表现为:(1)水温胁迫阶段,对照组和21.5℃实验组各观测时点的酶活力均显著小于其它实验组别(P<0.05),24h、48h酶活力均以26℃实验组为最大,72h以24.5℃实验组为最大,而23℃实验组、24.5℃实验组、26℃实验组的96h 酶活力则均无组间差异(P>0.05),即23—24.5℃为蝌蚪肝脏CAT酶耐受水温胁迫的适宜范围;(2)水温恢复阶段,蝌蚪肝脏CAT酶活力随恢复前实验水温的升高均保持以26℃实验组为最小(P<0.05),21.5℃实验组和对照组持平(P>0.05)的先升后降趋势,其中恢复6d时的酶活力以24.5℃实验组为最大(P<0.05),恢复12d时的24.5℃实验组酶活力则与23℃实验组无显著差异(P>0.05),即24.5℃为蝌蚪肝脏CAT酶耐受温降胁迫的最适水温,而26℃则为温降胁迫下肝脏CAT酶表露轻度受损的高温临界。综上可知,蝌蚪尾部皮肤和肝脏表露CAT酶活力的最适水温分别为23℃和24.5℃。
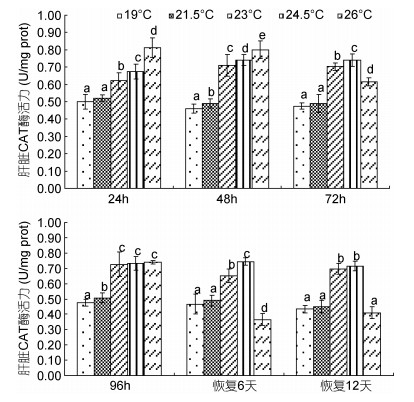 |
| 图 5 不同温度条件下棘胸蛙蝌蚪肝脏CAT酶活力的变化 Fig. 5 The CAT activity in P.spinosa tadpole liver in different water temperatures |
由图 6可见,蝌蚪肝脏GSH酶活力在水温胁迫及恢复条件下的变化特征主要表现为:(1)水温胁迫阶段,随实验水温升高,24h肝脏GSH酶活力呈单调上升趋势(P<0.05),23℃实验组、24.5℃实验组、26℃实验组于48h持平(P>0.05),72h和96h均呈以24.5℃实验组为最大(P<0.05)的先升后降趋势,对照组除96h酶活力与26℃实验组持平(P>0.05)外,其余观测时点均显著小于其它实验组(P<0.05);(2)水温恢复阶段,蝌蚪肝脏GSH酶活力随恢复前实验水温的升高均保持以26℃实验组为最小(P<0.05)和24.5℃实验组为最大(P<0.05)的先升后降趋势。综上可知,24.5℃为蝌蚪肝脏表露GSH酶活力的最适水温,而26℃则为肝脏GSH酶活力表露受损的高温临界。
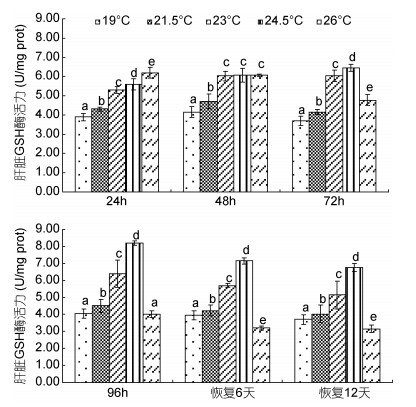 |
| 图 6 不同温度条件下棘胸蛙蝌蚪肝脏GSH酶活力的变化 Fig. 6 The GSH activity in P.spinosa tadpole liver in different water temperatures |
变温动物往往采取行为和生理调节来响应外界温变,以尽量使其机体维持于相对适合的生存状态(Chen et al,2011; Zhang et al,2015)。尽管上述调节作用均极为有限,但仍需为此付出相应的代价。观察发现,仿生态条件下饲养的棘胸蛙蝌蚪在入秋前常具聚群活动的生活习性(陈文豪,2004),实验环境条件下棘胸蛙蝌蚪于水温25—28℃时便减少或停止摄食,浮于水面并伴随着气泡病的发生(胡石柳等,1989)。无疑,本研究中14℃实验组蝌蚪分散静止于实验容器底部,26℃实验组蝌蚪集群分布于水表层,以及30℃实验组蝌蚪散游于水表面的情形(表 1),实际上就是蝌蚪针对水温胁迫而采取的行为调节,其中分布水层的温度性移栖(thermal migration)和固有集群行为的丧失则是其所付代价的宏观表现。故,分布水层和集群行为的保持与否是判别棘胸蛙蝌蚪是否处于适宜水温的重要依据。
皮肤系动物首先感知外界温度变化的器官。蝌蚪约60%的氧靠皮肤吸收,其中尾部皮肤因薄且布有大量毛细血管而具重要的呼吸功能(Burggren et al,1982); 解剖观察也发现,生活于含氧量较低水域中的蝌蚪会表露出皮肤变薄、毛细血管增多并产生水—血屏障的变化特征(Burggren et al,1983; Jia et al,1997),故其尾部肤色对外界环境温度胁迫做出的供氧反应也就最为直观。本研究中,26℃和30℃两实验组尾部肤色L值均显著大于其它实验组(P<0.05)的结果(表 2),与两者蝌蚪移动率均明显大于其它实验组且均分布于水表面的现象(表 1)相呼应,既客观反映了高温胁迫下蝌蚪尾部的行为调节机制,即: 随水温的升高,蝌蚪尾部的运动节律随之加快,机体需氧压力也随之增大,从而驱使蝌蚪分布水层上移以进一步增加皮肤对氧的吸收量,并导致其尾部肤色因皮肤变薄和毛细血管的增多而显著变亮,也揭示了机体需氧压力的持续增加是导致棘胸蛙蝌蚪对高温胁迫更具敏感性的根本原因。无疑,棘胸蛙主布于我国南方丘陵海拔500—600m溪流区的调查结果(林光华等,1990)所示的环境水温和水域含氧特征,也从侧面印证了上述分析的可靠性。综上可知,26℃和14℃分别为棘胸蛙尾部启动行为调节的水温上、下限阈值。
3.2 水温胁迫及恢复条件下棘胸蛙蝌蚪尾部的生理调节ATP酶具催化ATP水解产生ADP和无机磷酸并释放自由能的作用(Häsler et al,1998),与机体能量代谢有着极为密切的关系,脏器供能压力过大势必会导致其ATP酶活力的受抑。SOD和CAT系水生动物表露氧化应激机制中的标志酶(高晓莉等,2004; Francesco et al,2011),在保护细胞免受氧化损伤和维持机体内氧自由基代谢平衡上具重要作用(Palacea et al,1998; 高蓉等,2009),酶活力的高企往往预示着机体消除活性氧自由基压力的提高(Andersen et al,1998; Ross et al,2001),而酶活力的受抑则表明着机体已受到一定程度的氧化伤害(Winston et al,1991)。
本研究水温胁迫阶段,蝌蚪尾部皮肤各观测时点ATP酶活力随实验水温的提高均呈以24.5℃实验组为最大(P<0.05)的先升后降趋势,表露SOD和CAT酶活力最大值的实验水温均随实验时间的推移而逐渐下降,并最终均以23℃实验组为最大(P<0.05)的结果(图 1,图 2,图 4),表明23℃为棘胸蛙蝌蚪尾部生理活动的最适水温,这既与陶志英等(2015)研究所述23℃为最利于其快速生长的培育水温的结果完全吻合,也与陈雯等(2010)观察发现23℃为蝌蚪孵化率达80%以上的培育水温高限相一致。与此同时,上述测定结果与26℃实验组蝌蚪分布水层、个体移动率、尾部肤色L值均发生显著改变的情形(表 1,表 2)相呼应,既客观反映了蝌蚪尾部对高温胁迫所具生理调节的局限性,即: 适宜的培育水温可激活并促进蝌蚪尾部的ATP、SOD和CAT酶活力的显著提高,但培育水温过高不仅会抑制尾部皮肤ATP酶活力的进一步提高,而且还会导致尾部皮肤因活性氧自由基存量的不断累积而表露SOD和CAT酶活力的时序性受抑,也由此揭示了高温胁迫下机体需氧压力的持续增加是导致蝌蚪尾部皮肤抗氧化酶较ATP酶更具敏感性的根本原因。张克烽等(2007)指出SOD在清除活性氧过程中最早发挥作用。故,本研究水温恢复12d时,各实验组尾部皮肤ATP、SOD和CAT酶活力均显著大于或等于对照组,SOD酶活力以23℃实验组与对照组最为接近,23℃实验组ATP酶活力与21.5℃实验组、24℃实验组均无显著差异(P<0.05),以及23℃实验组CAT酶活力仅低于24.5℃实验组(P<0.05)的结果(图 1,图 2,图 4),在进一步印证23℃为蝌蚪尾部生理活动最适水温的基础上,也揭示了尾部皮肤SOD在表征棘胸蛙蝌蚪适温性上所具的生理重要性,即SOD酶活力系蝌蚪尾部对水温胁迫启动行为调节的重要生理基础。
3.3 肝脏抗氧化酶对水温胁迫及恢复的响应特征在正常生理状况下,抗氧化酶系统可有效清除活性氧,以保护机体免受氧化损伤。肝脏作为脊椎动物新陈代谢和氧气消耗的主要器官,往往具较高的抗氧化酶活力(Otto et al,1996),其SOD为最能代表机体抗氧化防御变化特征的指标酶(Wilhelm-Filho et al,1993)。无疑,本研究中各观测时点棘胸蛙蝌蚪肝脏与尾部皮肤的SOD酶活力变动区间均较为接近,表露肝脏SOD酶活力最大值和尾部皮肤SOD酶活力最小值的实验组别均为对照组(P<0.05),以及胁迫结束时点肝脏SOD酶活力呈26°C实验组<23°C实验组<24.5°C实验组<21.5°C实验组(P<0.05),和尾部皮肤SOD酶活力呈以23°C实验组为最大(P<0.05)的先升后降趋势的结果(图 2,图 3),均表明SOD酶活力与其机体呼吸代谢水平的高低和皮肤供氧压力的增减均有着极为密切关系,即适度偏离最适水温23°C不仅会导致肝脏SOD酶活力的显著高企,而且也会导致其尾部皮肤SOD酶活力的显著下降,上述情形既印证了棘胸蛙蝌蚪皮肤具较强的氧吸收能力(Burggren et al,1982; Burggren et al,1983; Jia et al,1997)的观点,也客观反映了肝脏和尾部皮肤SOD酶在表征棘胸蛙蝌蚪最适水温上所具的同等生理重要性。
CAT和GSH均系抗氧化系统的重要成员。其中,CAT 可将H2O2还原为H2O和O2,以维持细胞和机体的正常生理活动(Parihar et al,1997),GSH可通过间接还原过氧化物或直接消除羟自由基来减少细胞氧化受损(Noctor et al,1998; Seo et al,2006)。本研究中,水温胁迫结束时点26°C实验组的肝脏GSH酶活力与对照组持平(P>0.05),而肝脏和尾部皮肤CAT酶活力则均显著大于对照组(P<0.05),水温恢复结束时点26°C实验组的肝脏GSH酶活力显著小于对照组(P<0.05),而肝脏和尾部皮肤CAT酶活力则分别大于和等于对照组的结果(图 4,图 5,图 6),与水温胁迫阶段26°C实验组肝脏SOD酶活力显著小于23°C实验组(P<0.05),而尾部皮肤SOD酶活力显著大于对照组(P<0.05)的情形(图 2,图 3)相呼应,既揭示了GSH在表征棘胸蛙肝脏抗氧化能力上较CAT更具灵敏性的特质,即保持细胞中高度稳定的GSH含量可提高细胞抗氧化能力(Noctor et al,1998; Lima et al,2007),也进一步印证了Wilhelm-Filho等(1993)指出的肝脏SOD为最能代表机体抗氧化防御变化特征的指标酶的可靠性。
| 王爱民,刘文斌,郭文汉等,2002.棘胸蛙越冬试验初步研究.水利渔业, 22(1):3-4 |
| 中华人民共和国农业部,2001. NY 5051-2001无公害食品淡水养殖用水水质.北京:中国标准出版社, 1-5 |
| 刘元楷,苏向阳,李荣招等,1990.棘胸蛙人工繁殖的研究.福建水产, (3):19-27 |
| 杨伟国,周道三,林溪平等,1990.棘胸蛙的生态习性与人工养殖方法.生物学杂志, 4:19-23 |
| 肖调义,赵玉蓉,章怀云等,2004.人工饲养棘胸蛙蝌蚪变态发育的研究.水利渔业24(1):19-20 |
| 张克烽,张子平,陈芸等,2007.动物抗氧化系统中主要抗氧化酶基因的研究进展.动物学杂志, 42(2):153-160 |
| 陈平,郑荣泉,黄华等,2012.棘胸蛙求偶声与温度有关但与体大小无关.四川动物, 31(4):513-517 |
| 陈雯,俞宝根,郑荣泉等,2010.温度对棘胸蛙胚胎发育及蝌蚪表型特征的影响.贵州农业科学, 38(1):108-110 |
| 陈文豪,2004.棘胸蛙的人工驯养繁育研究.安徽林业科技, (3):10-12 |
| 林光华,虞鹏程,1990.棘胸蛙的繁殖生物学研究.江西大学学报(自然科学版), 14(4):64-70 |
| 赵蒙蒙,郑荣泉,宋婷婷等,2014.饲料营养水平和温度对棘胸蛙蝌蚪变态发育的影响.广东农业科学, (20):119-120 |
| 胡石柳,1991.棘胸蛙人工饲养环境条件的研究.福建水产, (3):10-14 |
| 胡石柳,江福来,蔡葆青,1989.棘胸蛙的人工催产、卵子孵化及蝌蚪培育环境条件的初步研究.厦门水产学院学报, 11(1):22-27 |
| 耿宝荣,张秋金,邓媛霞等,2004.饲养雄性棘胸蛙生理常数及精巢的年周期变化.应用与环境生物学报, 10(4):451-455 |
| 高蓉,张守刚,肖杭,2009.脱氧鬼臼毒素对斑马鱼(Danio rerio)代谢酶和抗氧化酶活性的影响.生态毒理学报, 4(5):700-704 |
| 高晓莉,罗胡英,赵彦珍等,2004.铜、锌对鲤鱼抗氧化酶影响的研究.淡水渔业, 34(4):22-23 |
| 陶志英,马保新,余智杰等,2015.环境因子对棘胸蛙蝌蚪生长发育的影响.湖南农业科学, 45(2):55-56 |
| Andersen F, Lygren B, Maage A et al,1998. Interaction between two dietary levels of iron and two forms of ascorbic acid and the effect on growth, antioxidant status and some non-specific immune parameters in Atlantic salmon (Salmo salar) smolts. Aquaculture, 161:437-451 |
| Burggren W W, West N H,1982. Changing respiratory importance of gills, lungs and skin during metamorphosis in the bullfrog Rata catesbeiana. Respiratory Physiology, 47(2):151-164 |
| Burggren W, Mwalukoma A,1983. Respiration during chronic hypoxia and hyperoxia in larval and adult bullfrogs (Rana catesbeiana) I. Morphological responses of lungs, skin, and gills. Journal of Experimental Biology, 105(l):191-203 |
| Chen C P, Hwang R L, Chang S Y et al,2011. Effects of temperature steps on human skin physiology and thermal sensation response, Building and Environment, 46(11):2387-2397 |
| Francesco R, Maria E G, Maura B et al,2011. Molecular and biochemical biomarkers in environmental monitoring:A comparison of biotransformation an antioxidant defense systems in multiple tissues. Aquatic Toxicology, 105(3-4):56-66 |
| Häsler K, Engelbrecht S, Junge W,1998. Three-stepped rotation of subunits gamma and epsilon in single molecules of F-ATPase as revealed by polarized, confocal fluorometry. Febs Letters,1998, 426(3):301-304 |
| Jia X X, Burggren W W,1997. Development Changes in chemoreceptive control of gill ventilation in larval bullfrog (Rata catesbeiana) I. Reflex ventilatory responses to ambient hyperoxia, hypoxia and NaCN. Journal of Experimental Biology, 200(16):2229-2236 |
| Lima I, Moreira S M, Osten J R V et al,2007. Biochemical responses of the marine mussel Mytilus galloprovincialis to petrochemical environmental contamination along the North-western coast of Portugal, Chemosphere, 66:1230-1242 |
| Noctor G, Foyer C H,1998. Ascorbate and glutathione:Keeping active oxygen under control. Annual Review of Plant Physiology and Plant Molecular Biology, 49:249-279 |
| Otto D M E, Moon T W,1996. Endogenous antioxidant systems of two teleost fish. the rainbow trout and the black bullhead, and the effect of age. Fish Physiol Biochem, 15(4):349-358 |
| Palacea V P, Brown S B, Baron C L et al,1998. An evaluation of the relationships among oxidative stress, antioxidant vitamins and early mortality syndrome (EMS) of lake trout (Salvelinus namaycush) from Lake Ontario. Aquatic Toxicology, 43(2-3):195-208 |
| Parihar M S, Javeri T, Hemnai T et al,1997. Response of superoxide dismutase, glutathione peroxidase and reduced glutathione antioxidant defenses in gills of the freshwater catfish (Heteropneustes fossilis) to short term elevated temperature. Journal of Thermal Biology, 22(2):151-156 |
| Ross S W, Dalton D A, Kramer S et al,2001. Physiological (antioxidant) responses of estuarine fishes to variability in dissolved oxygen. Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology, 130:289-303 |
| Seo J S, Lee K W, Rhee J S et al,2006. Environmental stressors (salinity, heavy metals, H2O2) modulate expression of glutathione reductase (GR) gene from the intertidal copepod Tigriopus japonicus. Aquatic Toxicology, 80:281-289 |
| Wilhelm-Filho D W, Giulivi C, Boveris A,1993. Antioxidant defenses in marine fish I:Teleosts. Comp Biochem Physiol, 106C:409-413 |
| Winston G W, Di Giulio R T,1991. Prooxidant and antioxidant mechanisms in aquatic organisms. Aquatic Toxicology, 19:137-161 |
| Zhang H Z, Zou Y J, Sun Y J et al,2015. A novel thermal-insulating film incorporating microencapsulated phase-change materials for temperature regulation and nano-TiO2 for UV-blocking. Solar Energy Materials & Solar Cells, 137:210-218 |
 2016, Vol. 47
2016, Vol. 47


