中国海洋湖沼学会主办。
文章信息
- 陈雪峰, 杨国梁, 高强, 夏正龙, 濮剑威, 慎佩晶, 黄振远. 2015.
- CHEN Xue-Feng, YANG Guo-Liang, GAO Qiang, XIA Zheng-Long, PU Jian-Wei, SHEN Pei-Jing, HUANG Zhen-Yuan. 2015.
- 罗氏沼虾(Macrobrachium rosenbergii)幼体新暴发病病原阴沟肠杆菌的分离鉴定
- IDENTIFICATION AND ISOLATION OF A NOVEL BACTERIAL PATHOGEN (ENTEROBACTER CLOACAE) FROM DISEASED LARVAE OF GIANT FRESHWATER PRAWN MACROBRACHIUM ROSENBERGII
- 海洋与湖沼, 46(6): 1467-1477
- Oceanologia et Limnologia Sinica, 46(6): 1467-1477.
- http://dx.doi.org/10.11693/hyhz20150700200
-
文章历史
- 收稿日期:2015-07-28
- 改回日期:2015-08-29
罗氏沼虾(Macrobrachium rosenbergii)为世界最大淡水虾类,具有重要的经济价值,它是世界上许多热带和亚热带地区内陆水产养殖中重要的经济甲壳动物之一(陈雪峰等,2012)。1976 年我国从日本引进该虾养殖,20 世纪90 年代,我国的罗氏沼虾养殖因国内对虾养殖业遭受灾害性病害及罗氏沼虾规模化人工育苗技术的突破而获得空前发展时机,先由广东、 广西、海南、福建等南方沿海省份快速发展,尔后在江、浙、沪逐渐兴起,并逐步向北方及内陆地区扩展,目前我国已成为全球罗氏沼虾产业最大国(Yang et al,2012)。产业快速发展的同时伴随着病害时有发生,病害已经成为世界各地制约罗氏沼虾产业进一步发展的主要瓶颈,产业中,涉及的病原类型多样且复杂,涵盖细菌、真菌、衣原体、寄生虫、病毒等(Cheng et al,1998; Chen et al,2001; Qian et al,2003; Liang et al,2011)。其中,20 世纪末产业中出现的由诺达病毒(MrNV)引起的罗氏沼虾虾苗的“白尾病”危害最大,该病为国际性疫病,给全球罗氏沼虾育苗产业造成严重损失(Qian et al,2006)。然而,以往的病害研究主要集中在仔虾(樊星等,2011)及成虾养殖阶段,幼体培育阶段的病害报道较少(Tonguthai,1997; 叶星等,1998),在幼体培育阶段造成暴发性疫病的病原尚未见报道。
2010 年浙江湖州某几个罗氏沼虾育苗场在幼体培育阶段发生病害,该病主要表现为: 幼体培育到第7 天前后时,幼体食欲和活力下降,幼体空胃,颜色发黑,生长缓慢,不能正常蜕皮变态,逐渐开始死亡,在倒池后死亡会加剧,此病严重时,在幼体培育3 天时即开始发病。该病使得育苗产量下降至20%,经济损失巨大。在随后的几年流行病学调查中,该病在部分育苗场依然时有暴发。本研究利用从发病幼体内分离得到的优势菌株对健康幼体进行了人工回感试验,确定该病由细菌引起。采用细菌形态、生理生化特性测定结合16S rRNA和gyrB 两对基因序列的系统发育关系对病原菌进行了分类鉴定。通过建立的病原菌快速PCR检测方法,传播途径进行了初探,同时测定了病原菌的耐药性。通过上述工作以期能查明罗氏沼虾幼体暴发病病原,以及对该病原的有效防治提供理论依据。
1 材料与方法1.1 发病幼体来源及细菌分离发病幼体取自浙江湖州地区(119°14′E,30°22′N)具有典型相同病症的2 个育苗场的6 个育苗池。从每个育苗池中随机称取发病幼体0.2g(约20—30 个幼体)于2mL EP 管中,用1.5mL 无菌生理盐水冲洗其表明,冲洗完毕,将生理盐水用移液枪吸干,再加1.5mL 无菌生理盐水冲洗,重复5—6 次,待彻底洗净幼体表面细菌,最后吸出1.2mL 生理盐水,将幼体匀浆,匀浆后加入无菌生理盐水至2mL,用移液枪吹打混匀。 无菌操作条件下,取10μL 匀浆液涂布于普通营养肉汤琼脂培养基,于30°C 培养箱中过夜培养,次日进行观察,从6 个细菌分离平板上挑取优势生长菌落(编号为NTH01、NTH02、NTH03、316D、316X、316C)做纯培养,纯培养物转接于斜面培养基,4°C 冰箱保存备用。
1.2 人工感染试验 1.2.1 试验幼体来源从湖州某正常出苗的育苗场(育苗面积10000m2)亲虾培育车间内,随机捕获67 尾即将产幼体的健康抱卵虾,养殖于3m2 水泥池中,培育至抱卵虾产出幼体,用60 目纱绢网将幼体捕获做为试验材料。
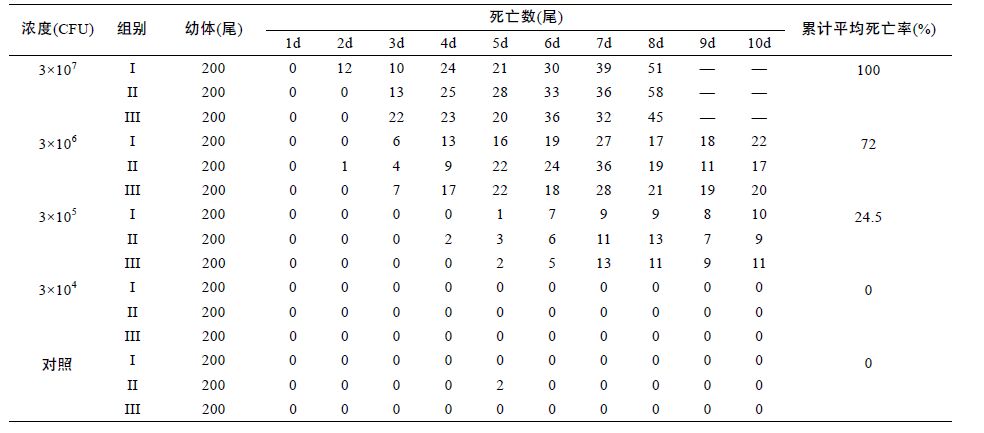
1.2.2 感染方法取代表菌株NTH01 接种于普通营养肉汤中,30°C 恒温培养18h,配置4 个细菌攻毒浓度梯度,分别为3×107、3×106、3×105和3×104CFU/mL。 采用浸泡方式进行攻毒,对照组以无菌营养肉汤培养基浸泡,浸泡时间15min,攻毒组与对照组设置3 个平行重复组,每组试验幼体为200 尾。按照人工育苗的方式进行试验管理,水体设定20L,盐度设定 1%,为确保水源干净,育苗用水经0.22μm 微孔滤膜过滤后使用。布苗第一天水温28°C,以后每天上升 1°C,最后恒定在31°C。每天上午、下午各投喂卤虫无节幼体一次,育苗第8 天开始,投喂人工蛋羹。每天上午吸污一次,记录死亡幼体数量。整个试验观测期为10 天。
1.3 细菌再分离与鉴定从发病死亡幼体进行细菌再分离,分离方法同 1.1,从细菌分离平板上随机挑取10 株优势生长菌株(编号GD1—GD10)用本实验室建立的PCR 方法进行快速鉴定。
1.4 病原菌生理生化鉴定利用杭州天和微生物试剂有限公司生产的细菌微量生化反应管进行细菌生化特性检验,包括葡萄糖氧化发酵、吲哚、MR、VP、动力、氧化酶、枸橼酸盐利用等,主要参照《常见细菌系统鉴定手册》(Holt et al,1994)进行,同时参考已有文献报道的菌株鉴定结果。
1.5 16S rRNA和gyr B 基因序列测定与系统发育分析 1.5.1 模板DNA的制备 水煮法提取细菌基因组DNA,提取的DNA用TE 溶解,1%琼脂糖电泳检测确定质量,紫外分光光度计(eppondorf)测定OD 值,确定浓度,使用液稀释为50 ng/μL。
1.5.2 基因序列PCR 扩增与测序16SrRNA 基因 PCR 扩增的两个引物分别为27F(正向引物): 5′-AGA GTT TGA TC(C/A)TGG CTC AG-3′和1492R(反向引物): 5′-GGT TAC CTT GTT ACG ACT T-3′。引物交由上海捷瑞生物工程有限公司合成。PCR 反应总体积为 25 μL,模板为基因组DNA 50 ng,使用Taq 酶(TaKaRa)进行PCR 扩增,其余组分按照说明书要求。 PCR 反应条件为: 94°C 2 min; 94°C 30 s,55°C 45 s,72°C 1 min,30 个循环; 72°C 延伸10 min; 4°C 保存。
在生理生化与16S rRNA 基因鉴定结果的基础上,根据NCBI 登录的阴沟肠杆菌与产气肠杆菌gyr B 基因保守序列设计引物,引物序列为F: 5′-CGG TAC CAT GGT GCG TTT CTG-3′和R: 5′-TGA CAG TCA GCC ACT TTG CCC G-3′。引物交由上海捷瑞生物工程有限公司合成。PCR 反应总体积为25 μL,模板为基因组DNA 50 ng,使用Taq 酶(TaKaRa)进行PCR 扩增,其余组分按照说明书要求。PCR 反应条件为:94°C 2 min; 94°C 30 s,60°C 30 s,72°C 1 min,30 个循环; 72°C 延伸10 min; 4°C 保存。扩增产物经1%的琼脂糖凝胶(含0.5 μg/mL EB)电泳分离,切下目的条带,用胶回收试剂盒(TaKaRa)纯化,与pMD18-T 载体(TaKaRa)连接,16°C 过夜,转化到DH5α 感受态细胞中,采用蓝白斑挑选阳性克隆,使用EcoR I、Hind III(TaKaRa)双酶切验证,阳性克隆送上海捷瑞生物公司测序。
1.5.3 序列分析与系统发育树构建所测序列经Blast 同源检索,从中选取同源性较高的菌株序列,采用Clustal w1.83 软件进行多序列匹配排列,用 Mega4.0 软件邻接法Neighbore-Joining(NJ)构建系统发育关系树,置信度用自举分析(Bootstrap)进行1000 次重复检验(Tamura et al,2007)。
1.6 病原菌检测方法建立与样品检测根据阴沟肠杆菌Omp A 基因保守且特异序列设计引物,引物序列为OF: 5′-CAT GAC ACC GGT GTT TCC CCA GT-3′和OR: 5′-CGG TCG GTG AAG CCC AGA ACC ACT A-3′。设计的引物用primer blast 在 NCBI 数据库中进行特异性检测。PCR 反应总体积为 25 μL,模板为基因组DNA 50 ng,使用Taq 酶(TaKaRa)进行PCR 扩增,其余组分按照说明书要求。 PCR 反应条件为: 94°C 2 min; 94°C 30 s,61°C 30 s,72°C 1 min,30 个循环; 72°C 延伸10 min; 4°C 保存。 扩增产物经纯化后送上海捷瑞生物工程有限公司测序确定。以本实验室保存的产气肠杆菌(E. aerogenes)、 大肠杆菌(E. coli)、坂崎肠杆菌(E. Sakazakii)、弗氏柠檬酸杆菌(Citrobacter freundii)、粘质沙雷菌(Serratia marcescens)、嗜水气单胞菌(Aeromonas hydrophila)、温和气单胞菌(A. sobria)、腐败希瓦氏菌(Shewanella putrefaciens)进行PCR 扩增反应,检验PCR 扩增特异性。
通过建立的PCR 检测方法,对原发病苗池分离株NTH02、NTH03、316D、316X、316C 与攻毒后分离得到的菌株(编号GD1—GD10)进行检测。2011 年,运用该检测方法对不同育苗场的发病与健康幼体、亲虾、受精卵等样品细菌分离后,进行检测。幼体与受精卵细菌分离方法同1.1,亲虾细菌分离方法为选取肝胰脏、肌肉、肠道、血液等4 个组织,无菌条件下,接种环穿刺后,划线于平板培养。
1.7 对抗菌药物的敏感性测定药敏纸片购自杭州天和微生物试剂有限公司。选择上述经鉴定的代表菌株,采用常规琼脂扩散法(K-B)对抗菌类药物的敏感性测定,以抑菌圈直径大小作为敏感与耐药的判定指标。
2 结果 2.1 发病幼体主要症状育苗期间,发病幼体主要表现为幼体食欲和活力下降,幼体空胃,颜色发黑(图 1 中红色箭头标出),个体间分散开不集群,发病幼体蜕皮不遂,逐渐死亡。

|
| 图 1 病原菌感染罗氏沼虾幼体症状 Fig. 1 The symptom of larvae infected by the pathogenic bacteria strain |
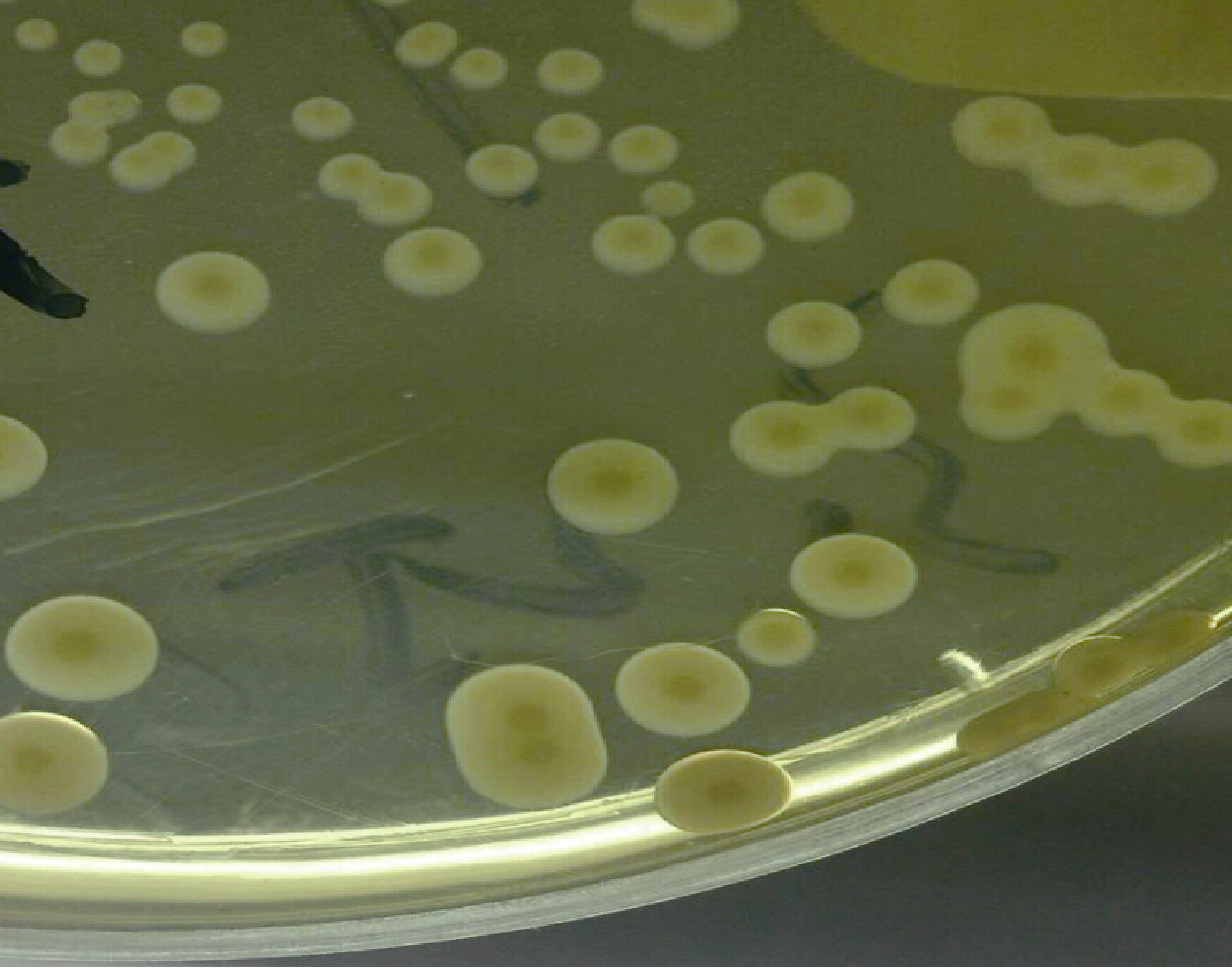
发病罗氏沼虾幼体匀浆液涂布得到大量优势生长菌落,在普通营养肉汤培养基上菌落特征为圆形、 表面光滑、边缘整齐、中央稍隆起、半透明、淡黄色、 湿润粘稠,培养24h 检查直径多在1.5mm 左右,生长丰盛(图 2)。
|
| 图 2 病原菌菌落形态 Fig. 2 The morphological structure of the pathogenic bacteria strain |
选取优势菌株NTH01 分设4 个浓度梯度对健康幼体进行了人工回归感染试验,结果显示,该菌株对罗氏沼虾幼体具有很强的致病性,浓度为3×107、 3×106、3×105 CFU/mL 的3 个平行组在育苗开始3 天左右开始出现幼体死亡。
第7 天左右出现死亡的高峰,发病症状与育苗生产中表现基本一致,幼体空胃,颜色发黑(图 3 中红色箭头标出),累计平均死亡率分别为100%、72%、 24.5%。对照组育苗期间未出现幼体死亡(表 1)。

|
| 图 3 人工感染后幼体发病症状 Fig. 3 The symptom of larvae after artificial infection |
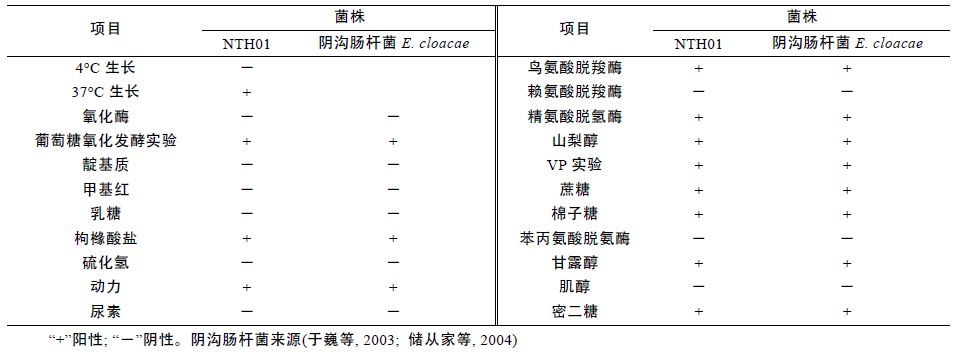
菌株NTH01 在4°C 不生长,37°C 生长; 氧化酶阴性; MR 反应阴性; VP 反应阳性; 具有运动性; 能利用蔗糖、棉子糖、蜜二糖、枸橼酸盐、山梨醇; 鸟氨酸脱羧酶阳性; 赖氨酸脱羧酶阴性等。具体供试菌株主要生理生化特性见表 2。
 |
病原菌NTH01 所扩增的16S rRNA 基因序列长度为1506bp,通过NCBI 数据库BLAST 检索系统进行序列同源性分析,NTH01 菌株16S rRNA 基因序列与阴沟肠杆菌、产气肠杆菌、阪崎肠杆菌的同源性都达到了99%,16S rRNA 基因序列未能准确将菌株 NTH01 定种。同时系统发育树也显示菌株NTH01 同时与阴沟肠杆菌、产气肠杆菌聚在一起(图 4)。初步表明,菌株NTH01 是阴沟肠杆菌或产气肠杆菌中的一种。
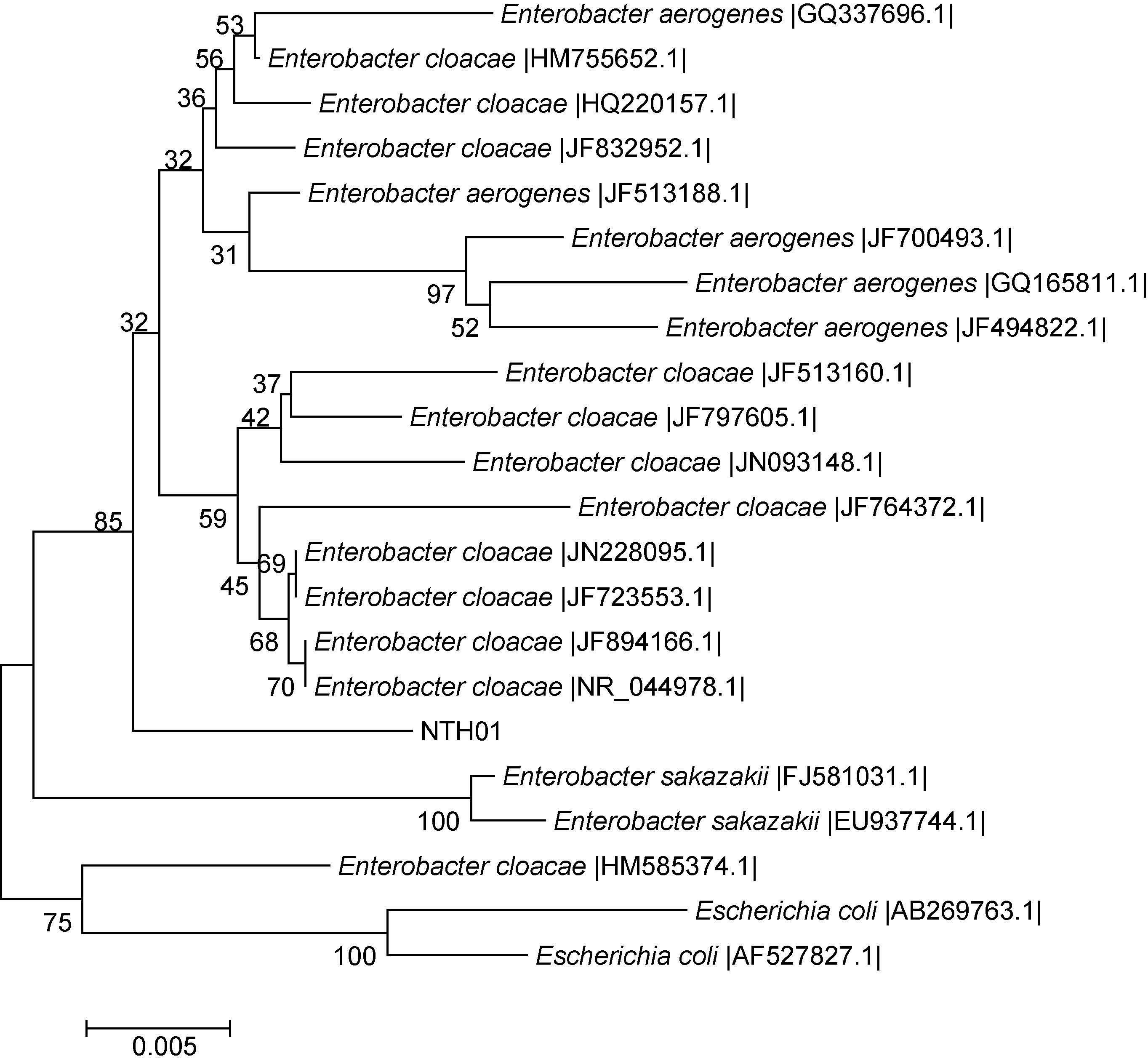
|
| 图 4 16S rRNA 基因序列聚类图 Fig. 4 Dendrogram of 16S rRNA gene sequences |
病原菌NTH01 所扩增的gyrB 基因序列长度为 745bp,通过NCBI 数据库BLAST 检索系统进行序列同源性分析,NTH01 菌株gyrB 基因序列仅与阴沟肠杆菌同源性达到了98%,系统发育树也显示,菌株 NTH01 与阴沟肠杆菌聚类为一支,而与产气肠杆菌明显分开(图 5)。
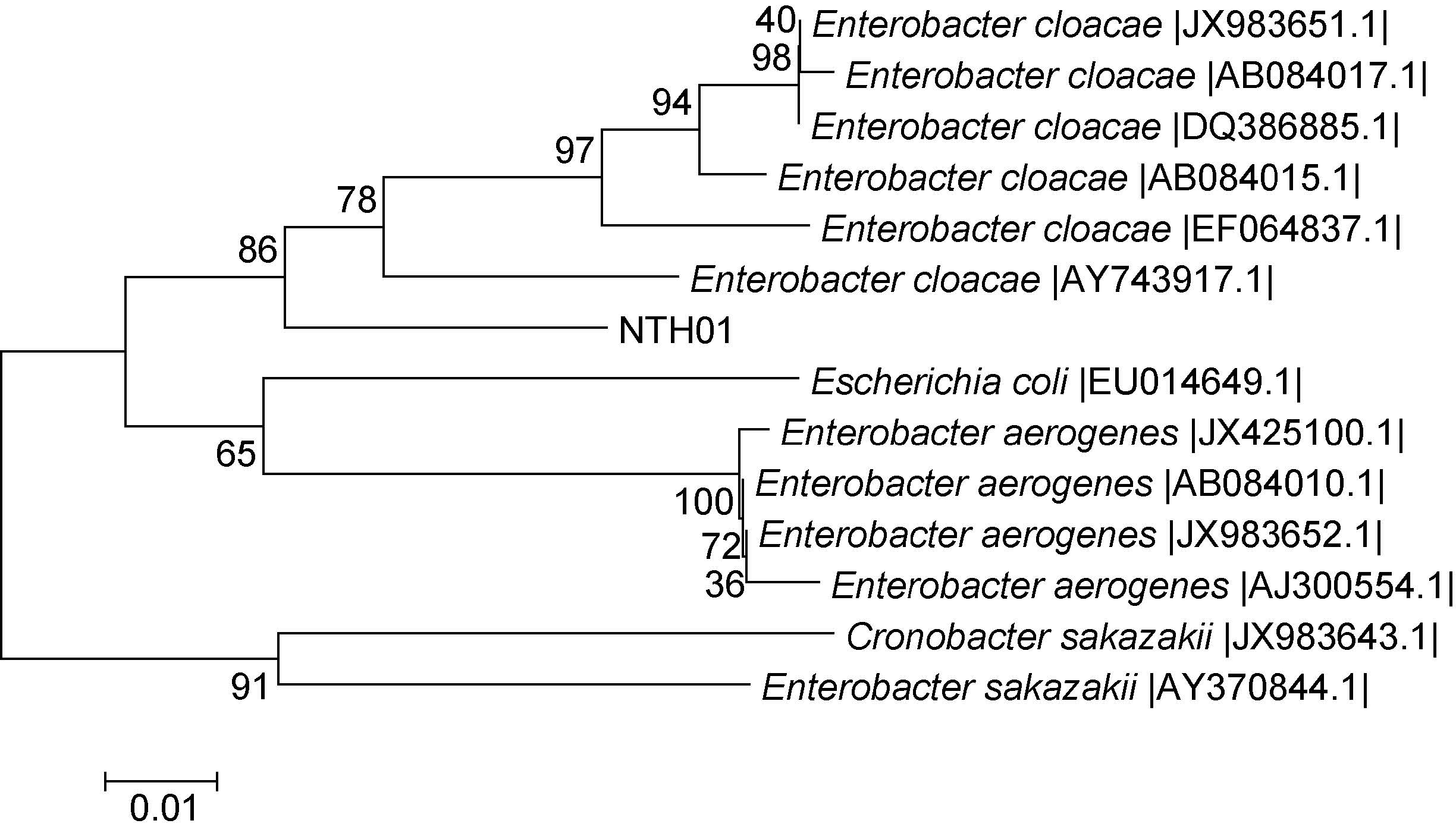
|
| 图 5 gyrB 基因序列分析聚类图 Fig. 5 Dendrogram of gyrB gene sequences |
引物OF 与OR 扩增序列长度为385bp(图 6),PCR 产物序列经NCBI 数据库 BLAST 检索,与阴沟肠杆菌OmpA 基因序列同源性 99%。用该对引物对本实验室保存的菌株NTH01、产气肠杆菌、大肠杆菌、坂崎肠杆菌、弗氏柠檬酸杆菌、 粘质沙雷菌、嗜水气单胞菌、温和气单胞菌、腐败希瓦氏菌进行PCR 扩增,结果除菌株NTH01 外,其余菌株无扩增条带(图 7)。该结果表明,病原菌NTH01 为阴沟肠杆菌。

|
| 图 6 菌株NTH01 PCR 扩增产物测序结果 Fig. 6 Sequence of PCR product for NTH 01 |
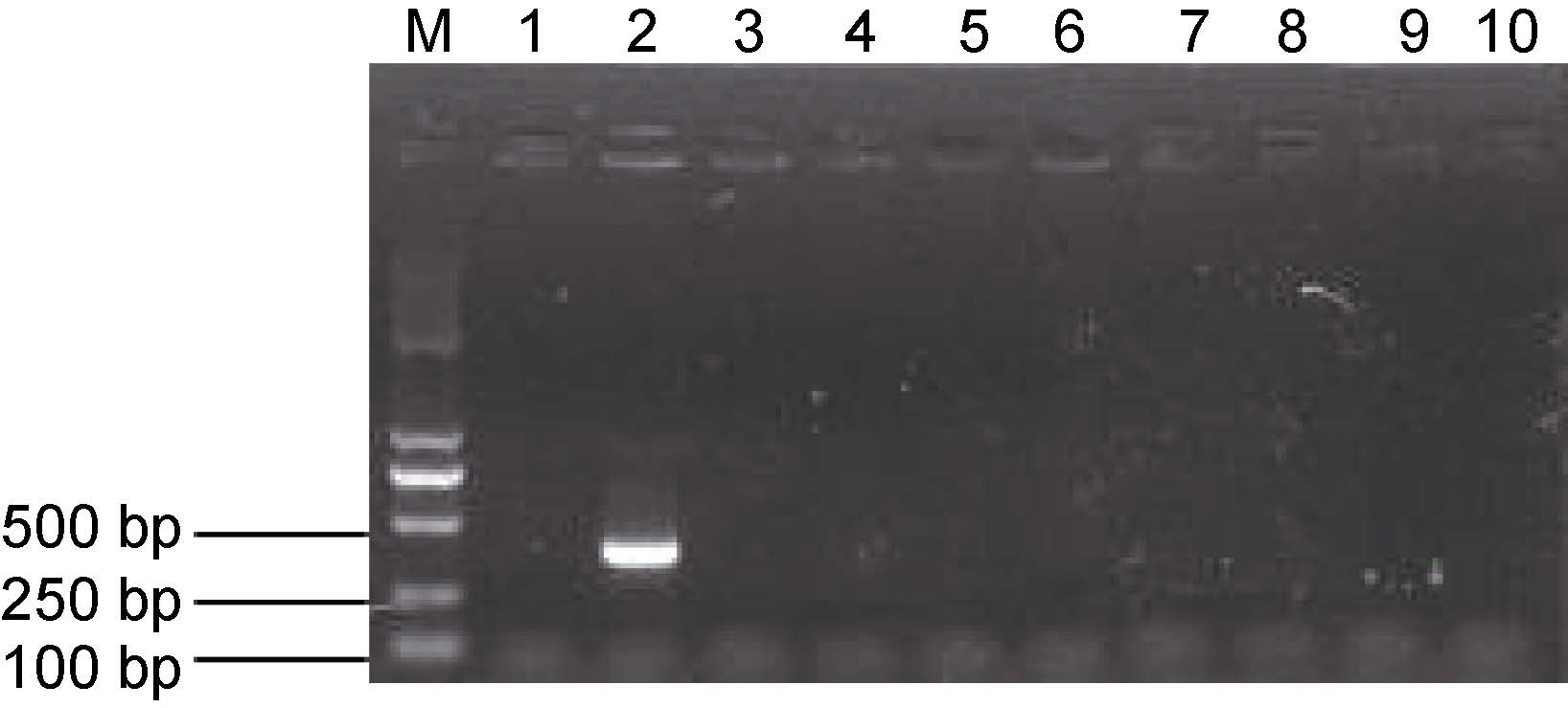
|
|
图 7 阴沟肠杆菌引物特异性试验检测结果
Fig. 7 The results of the specificity assay on E. cloacae primers
M: DNA marker; 1: 阴性对照; 2: 阴沟肠杆菌; 3: 产气肠杆菌; 4:
大肠杆菌; 5: 阪崎肠杆菌; 6: 弗氏柠檬酸杆菌; 7: 粘质沙雷菌; 8:
嗜水气单胞菌; 9: 温和气单胞菌; 10: 腐败希瓦氏菌 M: DNA maker; 1: negative control; 2: E. cloacae; 3: E. aerogenes; 4: E. coli; 5: E. Sakazakii; 6: C. freundii; 7: S. marcescens; 8: A. hydrophila; 9: A. sobria; 10: S. putrefaciens |
运用建立的检测方法,对从发病育苗池分离到的菌株NTH02、 NTH03、316D、316X、316C 进行检测,结果如图 8,该 5 株优势生长菌扩增出与NTH01 株一致大小的目的片段。

|
|
图 8 发病幼体细菌分离株检测结果
Fig. 8 Detection of bacteria isolated from diseased larvae
M: DNA marker; 1: 阴性对照; 2: 菌株NTH01; 3: 菌株NTH02; 4:
菌株NTH03; 5: 菌株316D; 6: 菌株316X; 7: 菌株316C M: DNA maker; 1: negative control; 2: NTH01 strain; 3: NTH02 strain; 4: NTH03 strain; 5: 316D strain; 6: 316X strain; 7: 316C strain |
攻毒后,发病罗氏沼虾幼体匀浆液涂布得到大量优势生长菌落(图 9),从平板上随机挑取10 株细菌进行了PCR 检测,10 株细菌都扩增得到385bp 的目的条带(图 10),这表明在感染死亡的幼体中再次分离到原感染菌,且病原菌已经成为绝对优势种。
|
| 图 9 攻毒发病幼体细菌分离结果 Fig. 9 Isolation of bacteria from diseased larvae in artificial infection |
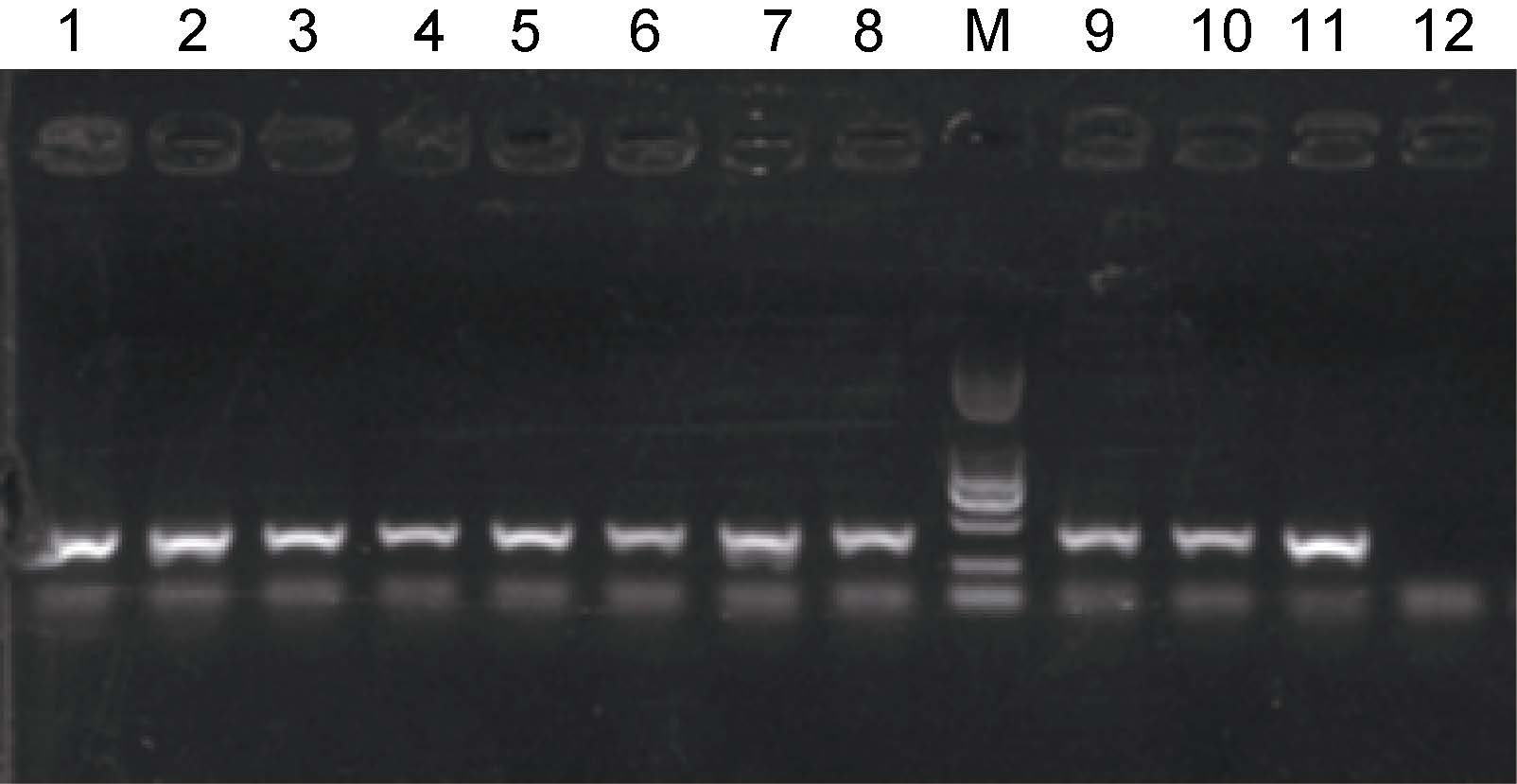
|
| 图 10 攻毒发病幼体分离细菌的鉴定 Fig. 10 Identification of bacteria isolated from diseased larvae in artificial infection M: DNA marker; 1—10: 菌株GD1-GD10; 11: 菌株NTH01; 12: 阴性对照 |
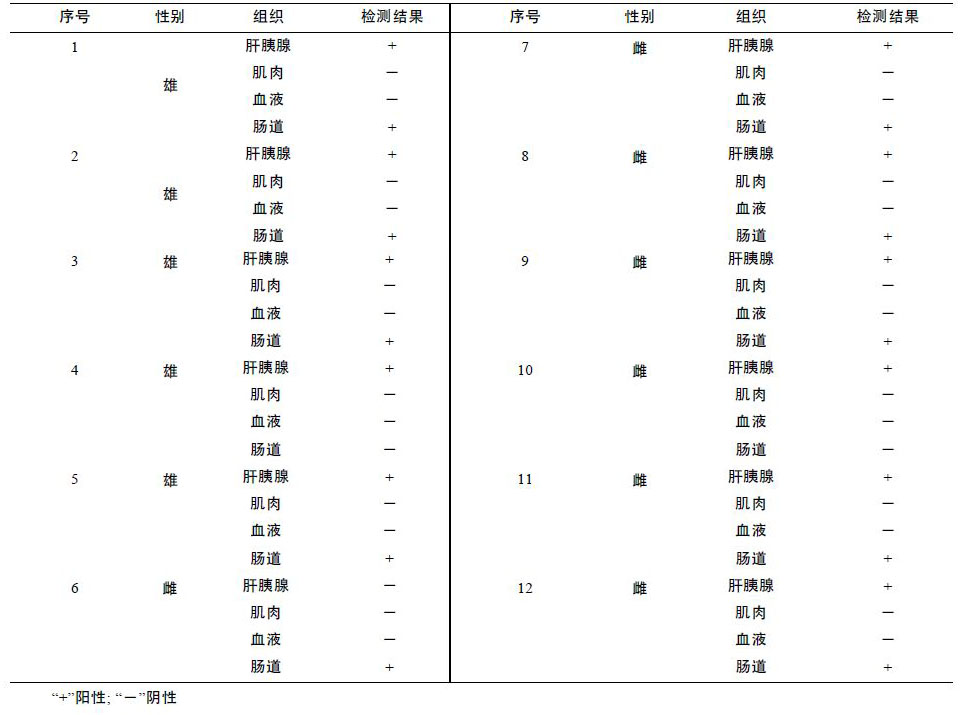
2011 年,采用该检测方法对4 个育苗不顺利的育苗场的发病幼体进行了检测,发病幼体细菌分离平板上菌落较单一,挑取优势菌,检测结果皆为阴沟肠杆菌(表 3),正常健康幼体与受精卵中未检测到阴沟肠杆菌。此外,对发病严重的苗场A,随机选取了该场的12 尾育苗用亲虾(雄虾5 尾,雌虾7 尾),对每尾亲虾的肝胰脏、 血液、肌肉、肠道等4 个组织部位进行了阴沟肠杆菌检测,结果肝胰脏与肠道中能够检测到该菌的存在,而肌肉与血液中未检测到该菌,肝胰脏中的检出率为91.7%,肠道中的检出率为75%(表 4)。
选取30 种抗生素,采用常规琼脂扩散法(K-B)对病原菌进行了耐药性试验,结果表明分离菌NTH01 对供试的恩诺沙星、氧氟沙星、庆大霉素等6 种抗生素敏感,而对头孢西丁、头孢孟多、头孢吡肟等19 种抗生素耐药(表 5)。采用筛选得到的药物对发病幼体进行治疗,其效果明显,这也从另一方面说明了阴沟肠杆菌是罗氏沼虾幼体的致病病原。
由于此次幼体暴发病范围广、危害大,以及产业需要恢复的迫切性,学者们陆续开展了未知病原的分离、鉴定工作。刘杰(2012)在电镜下没有观察到幼体中大量的病毒粒子,观察到500—1000nm 左右的细菌样结构,组织切片结果呈现出疑似细菌感染的嗜碱性染色质,通过随机克隆技术,对罗氏沼虾幼体可疑病毒基因鉴定分析,获得了两条可疑病毒序列,但没有进行人工回感实验,未能确定幼体致病病原是病毒。刘杜鹃(2013)报道了在发病幼体中检测到双顺反子病毒(dicistrovirs),同样在该研究中也没有进行人工回感实验,不能确定病原。本实验通过人工回感,复原了幼体发病时的症状表现,从发病感染的幼体中分离到大量生长的优势菌株,随机挑取10 株菌株进行检测,结果都是阴沟肠杆菌,这表明,阴沟肠杆菌在幼体体内进行了大量增殖,成为绝对优势种,进而导致幼体感染死亡。本研究对丰富罗氏沼虾病害学具有重要意义。
阴沟肠杆菌为革兰氏阴性菌,广泛存在于自然界中,在人和动物粪便、土壤、植物、昆虫中均可检出,它是人和动物肠道正常菌种之一,但它也是一种重要的条件致病菌。目前,对该菌的研究主要集中在该菌对人类与动物的致病性以及该菌耐药机制上(Zhou et al,2012)。耐药菌株日益增多,使得该菌成为重要的医院感染病原菌,其引起的细菌感染性疾病常累及多个器官,包括皮肤软组织感染、泌尿系统感染、呼吸道感染以及败血症等。有关该菌对水产动物的致病性报道还非常少,仅见Seker等(2008)报道了阴沟肠杆菌对健康鲻鱼(Mugil cephalus)具有较强的致病性,鲻鱼感染该菌会造成大量死亡。通过本文及以往的研究结果,表明阴沟肠杆菌感染可能会成为潜在的“人-兽-鱼”共患病,临床上应引起高度重视。
3.2 病原菌鉴定病原菌精准鉴定,是病害防控的重要前提。长期以来,对病原菌的传统分类鉴定主要采用分离培养、 形态特征、生化反应和免疫学等方法,但这些方法均存在耗时长、特异性差、敏感度低等问题,难以满足现代细菌学发展要求。随着分子生物学技术的发展,应用分子手段进行菌种鉴定,已成为当前细菌鉴定的主流技术。16S rRNA 基因序列因其具有恒定区序列保守、可变区序列因细菌不同而异、细菌中普遍存在等特性,使其逐渐成为微生物检测和分类鉴定的一种强有力分子工具,被誉为细菌分类和鉴定的“金标准”(Cohan,2001),但越来越多的研究表明,16S rRNA 基因序列因其具有高度保守性,对同一属内近缘种的区分精准程度往往不及那些进化稍快的基因(如gry B、rpo B等基因)(Watanabe et al,1998)。本实验中病原菌NTH01 的16S rRNA 基因序列经Blast 同源比较,与阴沟肠杆菌、产气肠杆菌、阪崎肠杆菌的同源性都达到了99%,且基于16S rRNA 基因序列构建的系统发育关系中,病原菌NTH01 同时与阴沟肠杆菌、产气肠杆菌聚在一起; 而病原菌NTH01 的gry B 基因序列经Blast 同源比较,仅与阴沟肠杆菌的同源性达到99%,系统发育关系显示,病原菌NTH01 与阴沟肠杆菌聚类一起,与产气肠杆菌明显分开。本实验再次表明,16S rRNA 基因序列在鉴定近缘种上存在弊端,但在16S rRNA 基因序列的基础上,再结合其它的靶基因以及形态学、生理生化特性,得到的鉴定结果更可靠、精确。
此外,本实验基于阴沟肠杆菌omp A 基因序列设计的引物,在对几种细菌的扩增中,仅有病原菌 NTH01 扩增出了目的片段,该结果可作为将病原菌 NTH01 鉴定为阴沟肠杆菌的佐证,同时该引物也可作为今后罗氏沼虾幼体阴沟肠杆菌病原快速筛查的特异引物,为病原的快速诊断提供了方便。
本研究在无发病育苗场的幼体与受精卵中未检测到阴沟肠杆菌,该结果也表明了阴沟肠杆菌是幼体致病病原,该病原不通过遗传垂直传播。通过对发病育苗场内亲虾的检测结果表明,该菌主要存在于亲虾消化系统内(肝胰腺与肠道),但亲虾并未表现出任何病症。罗氏沼虾亲虾交配受精后,雌虾抱卵,开始胚胎发育,直至孵出幼体。生产中将孵化池内幼体捞出,移到育苗池培育,该过程可能使得刚出膜的幼体感染亲虾携带的病原,进而导致在幼体培育期间,随着病原数量的扩增,导致发病。这也提示我们,在罗氏沼虾育苗生产的病害防治中,相比于用抗生素控制病害而带来的诸如耐药性、病情反复等不利后果,培育无特定病原(Specific Pathogen Free,SPF)亲虾可能是切断病原传播途径,防控病害的有效手段。
3.4 罗氏沼虾阴沟肠杆菌耐药性及防控已有研究表明,阴沟肠杆菌耐药可由染色体、质粒与整合子介导,耐药机制主要是产EABLs和AmpC 酶以及捕获耐药基因(Robicsek et al,2006),其中质粒与整合子介导的耐药性由于携带多种多样的耐药基因,因而传播扩散快,耐药性变化快,给防治带来一定难度。本实验选取30 种抗生素对病原菌 NTH01 进行了药物敏感测试,结果NTH01 仅对6 种药物敏感,表现出一定的多重耐药性,NTH01 菌株耐药主要机制及耐药基因携带情况有待进一步的研究。 筛选的药物用于实际育苗生产上,取得明显的效果,这个结果也表明阴沟肠杆菌是导致幼体发病的致病病原,但目前大多数的育苗单位存在滥用药物的现象,不但未能抑制病原菌,反而使得细菌的耐药性增强,病害得不到控制,愈演愈烈,因此必须加强药敏监测,进行合理用药,以免锻炼出多重耐药菌株。然而,通过抗生素来控制病害,会带来水体污染、药物残留、细菌耐药性增强等不良后果,尤其是具有多种耐药机制的细菌。因此,作者认为通过营造无特定病原环境及益生菌占位的方法,可能是防控病原菌的合理、有效手段。
3.3 罗氏沼虾阴沟肠杆菌检测与感染途径病原的早期诊断是病害防控的关键,因此建立快速的病原检测方法,对实现病原的早期确诊、提前防控、阻断病原传播途径具有重要意义。随着分子生物学的发展,各种水产养殖动物致病菌的分子检测方法已经广泛建立,Schikorski等(2013)对养殖疣鲍(Haliotis tuberculata)病原哈维氏弧菌(Vibrio harveyi)建立了real-time PCR 检测方法,监测养殖过程中的毒力菌株。Valle等(2002)通过构建RAPD 指纹图谱,筛选出特异条带,进而建立了鱼类出血病病原杀鱼巴斯德氏菌(Pasteurella piscicida)PCR 检测方法。Shi等(2012)通过基因芯片(DNA microarray)技术建立了水产养殖主要病原菌,如哈维氏弧菌、溶藻弧菌(V. alginolyticus)、嗜水气单胞菌等的检测方法。本实验建立了罗氏沼虾阴沟肠杆菌特异性PCR 检测方法,对发病幼体内优势菌检测,检测结果与实际发病情况一至,表明本检测方法对病原的快速、精确诊断具有实际意义,该方法能否在不培养细菌的情况下,直接对样品检测,进一步缩短检测时间,有待继续研究。
| 于巍, 祝令香, 刘伟丰等. 2003. 一株神经节苷脂内切糖苷酶产生菌的分离、鉴定及系统发育分析. 微生物学报,43(2): 151-155 |
| 叶星, 祁宝伦, 潘德博. 1998. 广东罗氏沼虾育苗中幼体大量死亡原因初探. 中国水产科学, 5(3): 119-121 |
| 刘杰. 2012. 患病罗氏沼虾幼体可疑病原核酸随机克隆技术的探索. 上海: 上海海洋大学硕士学位论文 |
| 刘杜鹃. 2013. 生物絮团对罗氏沼虾幼体养殖水体的改良作用及罗氏沼虾双顺反子病毒ELISA 检测. 温州: 温州医学院硕士学位论文 |
| 陈雪峰, 杨国梁, 孔杰等. 2012. 人工养殖与选育对罗氏沼虾遗传多样性的影响. 水生生物学报, 36(5): 866-873 |
| 储从家, 孔繁林, 管新龙等. 2004. 62 株阴沟肠杆菌的生化特性和药敏结果. 中国微生态学杂志, 16(5): 299-300 |
| 樊星, 赵笑笑, 李阳阳等. 2011. 罗氏沼虾仔虾病原菌的分离鉴定及耐药性试验. 湖北农业科学, 50(5): 1008-1011 |
| Chen S C, Lin Y D, Liaw L L et al. 2001. Lactococcus garvieaeinfection in the giant freshwater prawn Macrobrachiumrosenbergii confirmed by polymerase chain reaction and 16SrDNA sequencing. Diseases of Aquatic Organisms, 45(1):45-52 |
| Cheng W, Chen J C. 1998. Isolation and characterization of anEnterococcus-like bacterium causing muscle necrosis andmortality in Macrobrachium rosenbergii in Taiwan. Diseasesof Aquatic Organisms, 34(2): 93-101 |
| Cohan F M. 2001. Bacterial species and speciation. SystemsBiology, 50(4): 513-524 |
| Holt J G, Krieg N R, Sneath P H A et al. 1994. Bergey's Manualof Determinative Bacteriology Ninth Edition. Maryland:Williams & Wilkins, 204-207 |
| Liang T M, Li X L, Du J et al. 2011. Identification and isolationof a spiroplasma pathogen from diseased freshwater prawns,Macrobrachium rosenbergii, in China: A new freshwatercrustacean host. Aquaculture, 318(1-2): 1-6 |
| Qian D, Liu W, Wu J X et al. 2006. Preparation of monoclonalantibody against Macrobrachium rosenbergii Nodavirus andapplication of TAS-ELISA for virus diagnosis in post-larvaehatcheries in east China during 2000-2004. Aquaculture,261(4): 1144-1150 |
| Qian D, Shi Z L, Zhang S et al. 2003. Extra small virus-likeparticles (XSV) and nodavirus associated with whitish muscledisease in the giant freshwater prawn, Macrobrachiumrosenbergii. Journal of Fish Diseases, 26(9): 521-527 |
| Robicsek A, Jacoby G A, Hooper D C. 2006. The worldwideemergence of plasmid-mediated quinolone resistance. TheLancet Infectious Diseases, 6(10): 629-640 |
| Schikorski D, Renault T, Paillard C et al. 2013. Development ofTaqMan real-time PCR assays for monitoring Vibrio harveyiinfection and a plasmid harbored by virulent strains in Europeanabalone Haliotis tuberculata aquaculture. Aquaculture, 392-395: 106-112 |
| Seker V T, Santiago T C, Vijayan K K et al. 2008. Involvementof Enterobacter cloacae in the mortality of the fish, Mugilcephalus. Letters in Applied Microbiology, 46(6): 667-672 |
| Shi Y H, Chen J, Li C H et al. 2012. Detection of bacterialpathogens in aquaculture samples by DNA microarrayanalysis. Aquaculture, 338-341: 29-35 |
| Tamura K, Dudley J, Nei M et al. 2007. MEGA4: Molecularevolutionary genetics analysis (MEGA) software version 4.0.Molecular Biology and Evolution, 24(8): 1596-1599 |
| Tonguthai K. 1997. Diseases of the freshwater prawn, Macrobrachiumrosenbergii. AAHRI Newsletter Article, 4(2): 1-4 |
| Valle L D, Zanella L, Belvedere P et al. 2002. Use of randomamplification to develop a PCR detection method for thecausative agent of fish pasteurellosis, Photobacteriumdamselae subsp. piscicida (Vibrionaceae). Aquaculture,207(3-4): 187-202 |
| Watanabe K, Yamamoto S, Hino S et al. 1998. Populationdynamics of phenol-degrading bacteria in activated sludgedetermined by gyrB-targeted quantitative PCR. Applied andEnvironmental Microbiology, 64(4): 1203-1209 |
| Yang G L, Finsko M, Chen X F et al. 2012. Current status of thegiant freshwater prawn (Macrobrachium rosenbergii) industryin China, with special reference to live transportation.Aquaculture Research, 43(7): 1049-1055 |
| Zhou Q, Zhang M, Wang A L et al. 2012. Eight-year surveillanceof antimicrobial resistance among Enterobacter cloacaeisolated in the first Bethune hospital. Physics Procedia, 33:1194-1196 |
 2015, Vol. 46
2015, Vol. 46