中国海洋湖沼学会主办。
文章信息
- 马爱军, 王新安. 2015.
- MA Ai-Jun, WANG Xin-An. 2015.
- 大菱鲆(Scophthalmus maximus)种业发展及相关前沿技术应用
- DEVELOPMENT OF TURBOT SCOPHTHALMUS MAXIMUS SEED INDUSTRY AND APPLICATION OF ADVANCED TECHNOLOGY
- 海洋与湖沼, 46(6): 1461-1466
- Oceanologia et Limnologia Sinica, 46(6): 1461-1466.
- http://dx.doi.org/10.11693/hyhz20150400109
-
文章历史
- 收稿日期:2015-04-10
- 改回日期:2015-07-29
2. 青岛海洋科学与技术国家实验室海洋生物学与生物技术功能实验室 青岛 266071
2. Laboratory for Marine Biology and Biotechnology, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071, China
苗种是水产增养殖产业的源头和必要的物质基础,种质苗种是海洋养殖业的核心问题(相建海,2013)。一个优质良种的出现,可以很快形成新产业并带动形成新产业群。大菱鲆(Scophthalmus maximus)是原产于欧洲的重要的特有名贵鱼类之一,具有生长速度快和低温耐受力强等特点,是世界上养成范围最广、产量最大的鲆鲽类养殖良种(雷霁霖等,2012)。在国外,20 世纪90 年代,随着大菱鲆苗种培育技术的进一步完善,大菱鲆养殖业在西班牙、法国、葡萄牙等欧洲各国得到迅猛的发展(Pierrick et al,2008),成为欧洲非常重要的专业化海水鱼类养殖良种(马爱军等,2003)。1992 年,大菱鲆成功引入中国,在突破苗种繁育关键技术后,带动了鲆鲽类养殖业的蓬勃发展,成为我国海水鱼类的支柱产业(雷霁霖等,2012),对推动我国海水养殖“第四次浪潮”的形成和发展做出了重要贡献。鉴于大菱鲆在欧洲和中国渔业经济中的重要地位,本文系统综述了国内外大菱鲆种业发展的历程及现状,以及大菱鲆种业发展的前沿技术及应用,以期为获得大菱鲆的优质苗种提供基础资料。
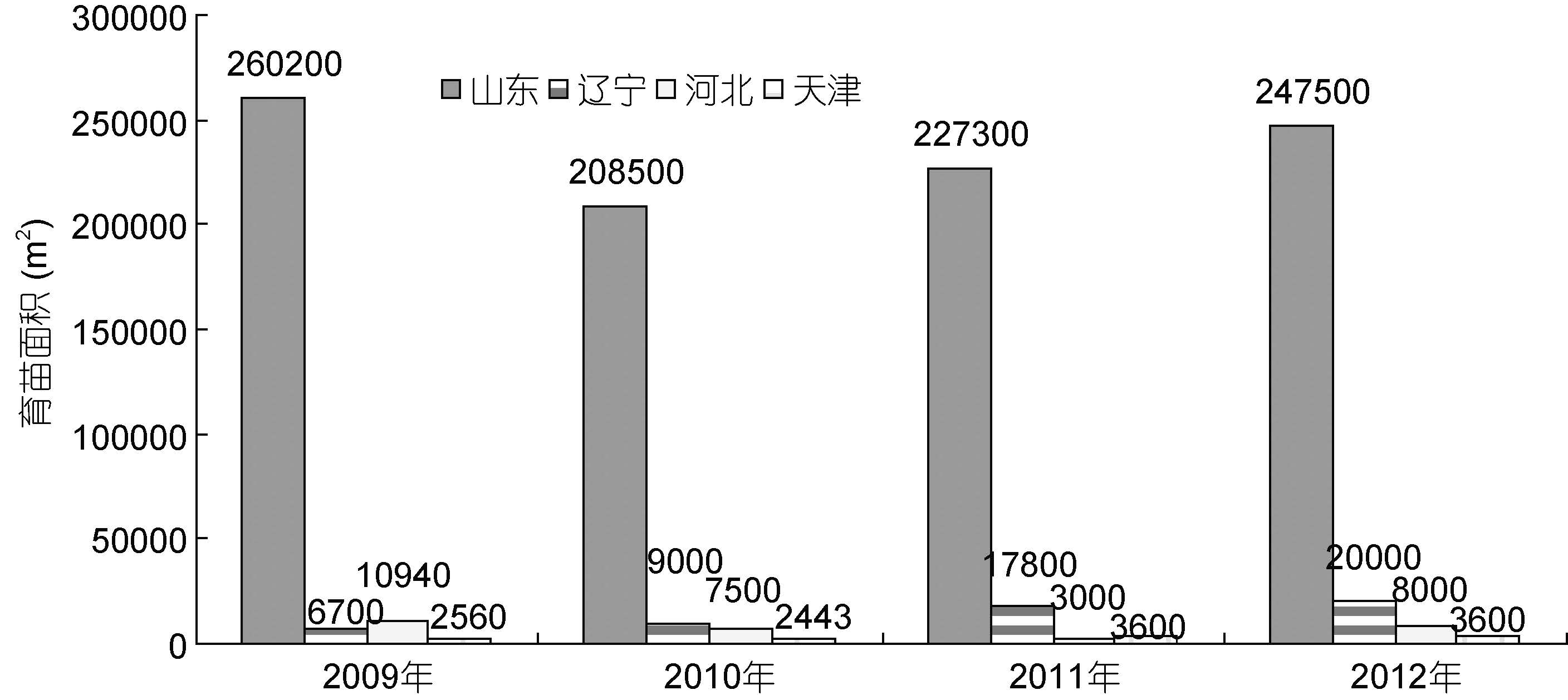
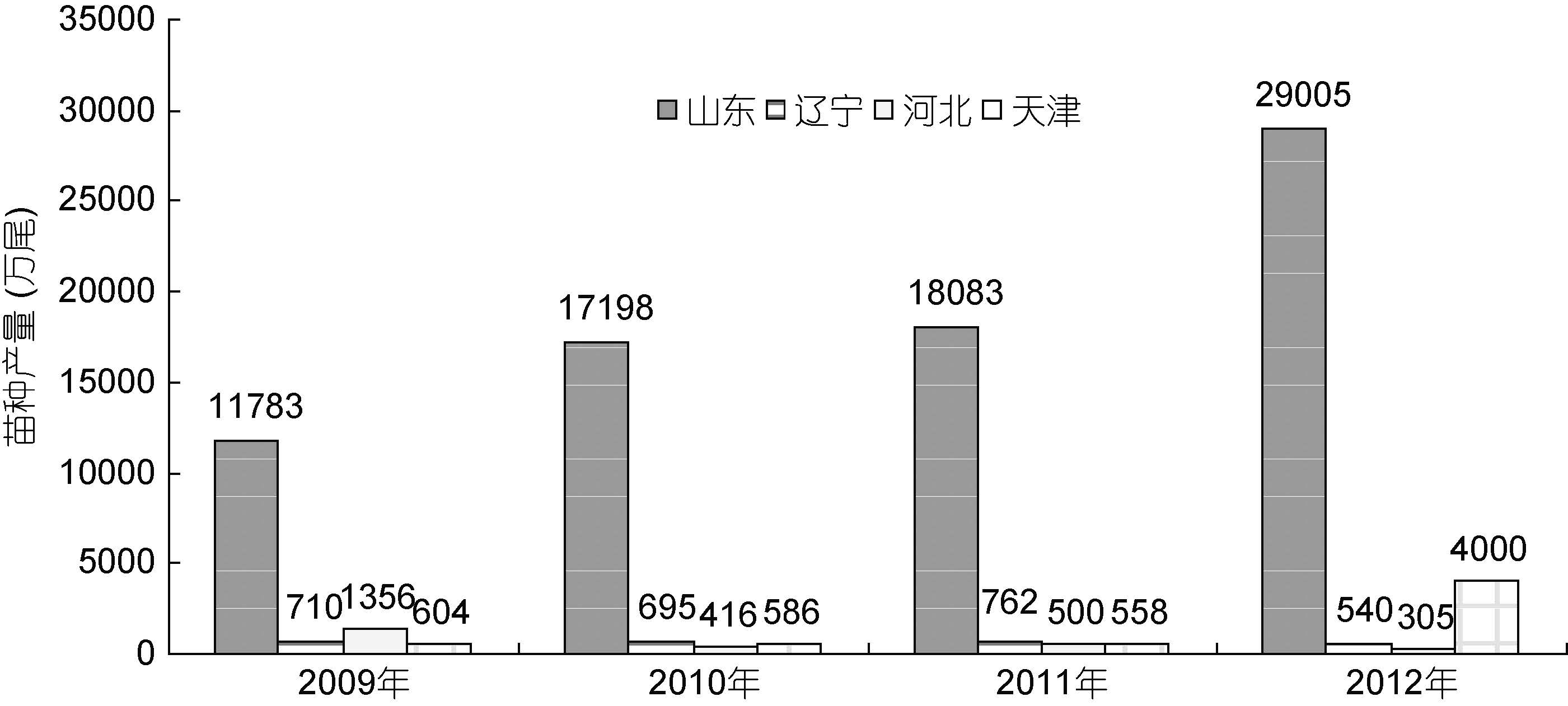
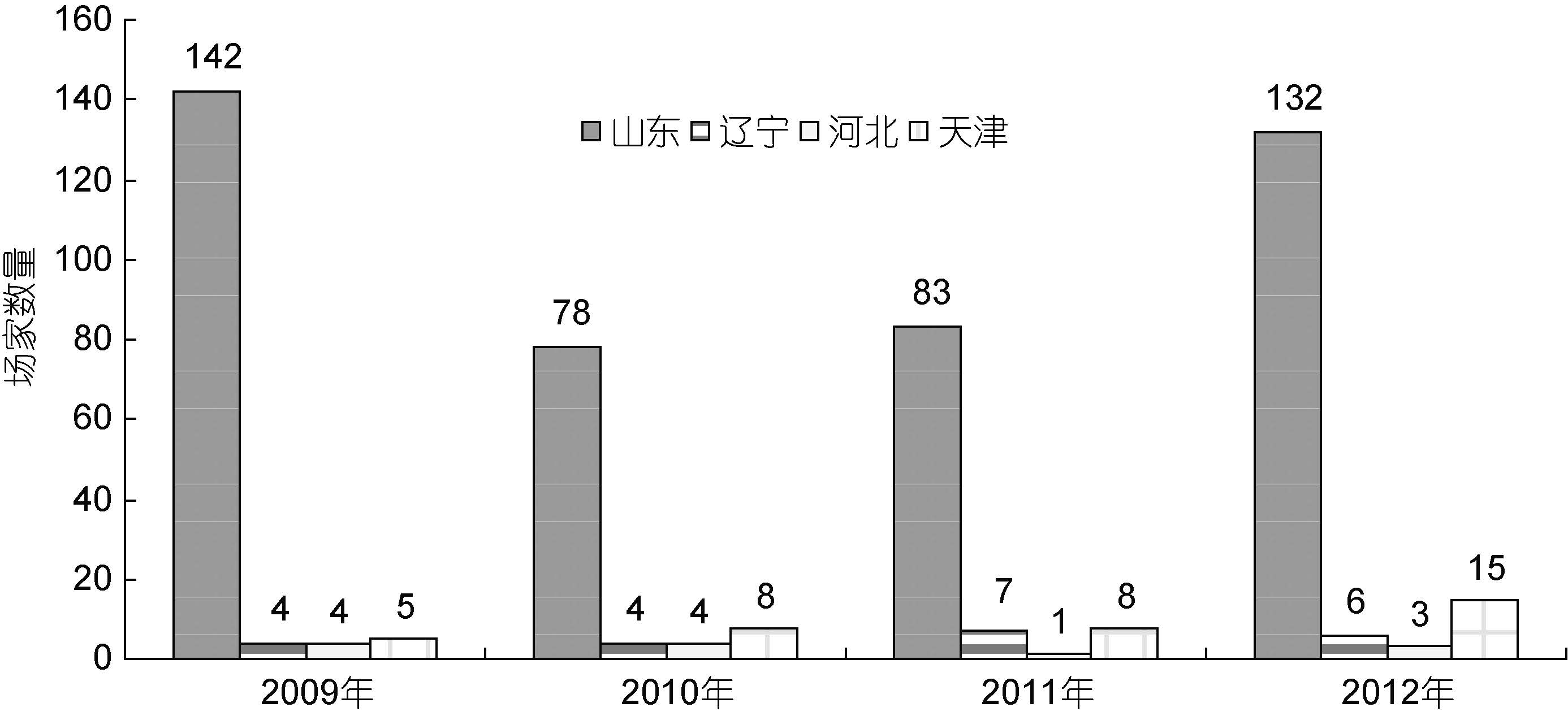
1 中国大菱鲆种业发展的历程及现状大菱鲆原产于大西洋东北沿岸,是世界性鲆鲽类主养品种之一,养殖范围遍布亚洲、欧洲和南美洲的十几个国家,2010 年养殖总产量达到68890 t(雷霁霖等,2012)。雷霁霖院士于1992 年将大菱鲆引入中国,启动与企业合作的育苗计划。虽然大菱鲆的繁育技术难度较大,又有欧洲专利的封锁,但雷霁霖院士坚持走自力更生的道路,到1999 年,经过7 年科技攻关,在亲鱼强化培育、控温控光和人工采卵技术三方面取得了重大突破,并进一步建立起包括亲鱼训化培育、繁殖调控、生物饵料高密度培养、营养强化和早期仔稚鱼培育等一整套工厂化育苗技术体系(雷霁霖等,2012),实现了苗种的大规模生产(马爱军等,2010),使鲆鲽类养殖业开始蓬勃发展。从1998 年下半年开始,山东沿海地区应用这项技术进行苗种繁育,苗种年产量超过100 万尾,但随着大菱鲆产业的迅猛发展,对苗种的需求急剧增加,2000—2004 年每年还需要从英国、法国等国家进口约300—400 万尾苗种。至2004 年底,国内大菱鲆苗种总产量已达到3500 万尾以上,其中山东约占91.0%,辽宁占7.1%,其它各地约占1.9%左右(雷霁霖等,2005)。到了2005 年以后,随着国内苗种培育技术的普及以及育苗企业的进一步增多,国产苗种年产量已经猛增至6000 万尾以上,基本满足了国内大菱鲆养殖业的需求(雷霁霖等,2012),丰富的苗源稳定地支撑着我国北方沿海大菱鲆工厂化养殖大产业的发展。由于亲鱼饲养期和苗种培育前期实施了良好的营养强化,国产苗的正常体色率与白化苗之比由开始时白化率占40%— 50%,下降至30%左右,少数优良企业可降至10%以下(雷霁霖等,2005),显示出国内的育苗整体技术水平有了明显的提高。此后,大菱鲆苗种生产与养殖业同步进入到平稳发展阶段。目前年产量接近2 亿尾,产地主要集中在山东省,占全国苗种生产总量的 90%以上(雷霁霖等,2012)。近年来,根据大菱鲆主产区山东、辽宁、河北、天津从事大菱鲆苗种生产的场家数量(图 1)、育苗面积(图 2)、苗种产量(图 3)的统计显示,苗种生产的总场家数量从2009 年到2012 年基本持平,2012年仅比2009 年多出1 家; 总育苗面积从2009 年到2012 年稍微下降,2012 年比2009 年少1300m2; 尽管苗种生产的总场家数量几乎没有变化,总育苗面积甚至下降,但苗种产量始终呈持续上升趋势,从2009 到2012 年,4 年苗种产量依次为1443、 18895、19903、33850 万尾,特别是从2011 年到2012 年,苗种产量增加了13947 万尾。这种变化,清晰地表明了大菱鲆苗种培育技术的日臻完善。
|
| 图 1 2009—2012 年大菱鲆主产区苗种生产场家数量 Fig. 1 The number turbot-breeding farms in China from 2009 to 2012 |
大菱鲆属于引进种,由于引进原种数量较少,群体种类相对单一,并且育种过程中采用的亲鱼未经过专门选优处理,加之累代养殖和近亲交配,以致造成种质退化现象。因此,我国于“十一五计划”初期启动了大菱鲆的遗传改良工作。中国水产科学研究院黄海水产研究所主要基于电子标记的大规模家系选育、杂交育种、分子辅助育种、雌核发育技术,以快速生长(马爱军等,2009,2012a; Liang et al,2012)、高成活率(Wang et al,2010)和耐高温(马爱军等,2012b)为改良目标,开展大菱鲆的遗传改良。目前,基于电子标记的大规模家系选育技术已选育出大菱鲆快速生长新品系、高成活率新品系、耐高温新品系(马爱军等,2012b; Liang et al,2012),其中快速生长品系的生长率比对照系提高了20.31%,比普通养殖群体提高了31.44%; 在3—6、6—9、 9—12、12—15、15—18 月龄,高成活率品系比同期对照系分别提高了53.69%、20.62%、11.92%、6.14%、 8.05%,比同期普通养殖系分别提高了68.45% 、 21.97%、19.38%、9.43%、10.22%; 耐高温品系的耐温性能比选育一代提高了1—2°C。大菱鲆快速生长品系、高成活率品系和耐高温品系的获得,为选育出具有优良性状的大菱鲆新品种奠定了基础。同时,在大菱鲆的选育过程中,还对选育出的优质亲鱼和苗种进行推广示范,取得了较明显的养殖效果。利用大规模家系选育培育出的快速生长品系和高成活率品
2 世界大菱鲆种业发展的历程及现状20 世纪70 年代,在苏格兰率先开展了大菱鲆养殖实验研究。20 世纪90 年代,随着大菱鲆苗种培育技术的发展,大菱鲆养殖业在西班牙、法国、葡萄牙等欧洲各国得到迅猛的发展。到2008 年,大菱鲆在欧洲的年产量约为5000 t(Pierrick et al,2008)。大菱鲆苗种的主要生产国是法国、西班牙和丹麦(杜佳垠,2001)。其中,成立于1987 年的法国大菱鲆公司是欧洲早期大菱鲆苗种的最大生产企业,目前年产150 万尾大菱鲆鱼苗,早期欧洲各大菱鲆养殖企业均用该公司所生产的苗种。中国从欧洲购买的大菱鲆亲鱼和种苗主要来自该公司。挪威的斯托尔特海水养殖公司是全球著名的大菱鲆养殖企业,同时公司本身也是大菱鲆苗种生产企业,其放养的大菱鲆苗种近半数可自给自足,1997年所需近140 万尾苗种中,80—90 万尾由公司自身生产。1996 年,所属该公司设在西班牙的1 家育苗场生产近50 万尾大菱鲆苗种(杜佳垠,2001)。 1999 年,智利中北区2 家大菱鲆育苗企业每年可生产约45 万尾大菱鲆苗种(6—8g)(杜佳垠,2001)。所属西班牙Pescafresca 公司的大菱鲆Mougua 育苗场,年产 600 万尾大菱鲆幼鱼,为世界上最大的大菱鲆养殖场西班牙Pescafresca 公司的Mira 养殖场(2009 年新建投产)和所属Pescafresca 公司的另一家年产3000t 大菱鲆成鱼的养殖场(2003 年收购)提供苗种。
世界大菱鲆主产国在进一步加强繁育技术研究的同时,还大力开展选育优良品系(品种)工作。在苗种繁育研究方面,随着对重要鲆鲽鱼类苗种人工繁育技术流程的熟化,通过加强基础研究细化当前养殖条件下最适繁育参数的手段来优化和提升苗种繁育产业技术体系,成为当前国际鲆鲽类苗种繁育产业技术研发的一个的重要趋势。在良种选育方面,国外对大菱鲆的遗传改良工作开展较早。由于大菱鲆在欧洲渔业经济中的重要地位,对其进行的选育研究较为深入。法国和西班牙Stolt Sea Farm 分别从1993 年及1995—1996 年开始实施大菱鲆亲鱼管理计划,并利用选择育种方法对大菱鲆快速生长性状进行遗传改良,经过3 代选择,平均每代可取得约10%— 15%的遗传进展。经过十余年选育,目前法国和西班牙各自选出1 个大菱鲆新品种(Danancher et al,2007)。此外,国外也开展了人工诱导大菱鲆雌核发育研究和运用多倍体技术对大菱鲆进行遗传改良(王新安等,2010),尽管这两项研究都取得了一定的进展,但两种技术在大菱鲆种业上的实际应用尚未见有报道。目前,国外对大菱鲆的遗传改良主要集中于西班牙,有关大学及科研院所通过分子生物学的技术手段对其进行研究。
3 大菱鲆种业发展的前沿技术及应用目前,国际上为了获得大菱鲆的优质苗种,主要从加强人工繁育技术研究和深入开展良种选育研究两个方向入手。目前国际上关于大菱鲆苗种繁育,主要是通过加强基础研究,细化当前养殖条件下最适繁育参数的手段来优化和提升苗种繁育技术体系,这也是当前国际鲆鲽鱼类(包括大菱鲆)苗种繁育产业技术研发的一个重要趋势。在亲鱼培育、性腺发育诱导以及早期发育方面都开展了较为深入的研究,为大菱鲆亲鱼培育和苗种培育过程中的水环境控制等提供了理论依据。关于大菱鲆遗传改良研究,大多利用基于电子标记的大规模家系选育技术和分子辅助育种技术(molecular marker assisted selection,MAS)相结合以及雌核发育技术对鲆鲽类的重要经济性状进行遗传操作,力求选育出尽可能优良的优质新品种(新品系),为鲆鲽类养殖业培育优质苗种提供保障。
对于大菱鲆的大规模家系选育技术,中国水产科学研究院黄海水产研究所基于数量遗传学原理和大菱鲆养殖的实际情况,对家系的构建和标准化培育、选育性状的遗传评定(马爱军等,2009)、配种方案的制定、选择进展的预测和评估(马爱军等,2012a)等大规模家系选育的核心技术进行了系统研究。此外,在大规模家系选育技术的基础上,黄海水产研究所还开展了“水产动物多性状复合育种技术”研究。这套技术可同时改良多个性状,累代选择时无种质退化,制定了“多系配套制种”的良种生产、扩繁模式,创建了群组育种模式(栾生等,2008)。 目前,该技术也被应用到大菱鲆的遗传育种中。多性状育种方法的选择首先要考虑所选性状之间的遗传相关,显然,当被改良的多个性状之间存在正遗传相关时,可采用多性状复合育种技术进行遗传改良。性状间正遗传相关越高,选育的效果越显著; 而当选育性状间存在负遗传相关时,由于性状间存在拮抗作用,应采用通过建立配套系,利用系间杂交育种的方法进行选育(Perry et al,2005)。研究表明,对于同一属性内性状,往往存在正遗传相关,而对于不同属性间性状(如数量性状和阈性状),通常存在极低的负相关(Perry et al,2005)。
随着分子生物学技术的迅猛发展,相关研究也被应用到水产动物遗传育种领域。尤其是分子标记辅助育种更是受到人们的重视。对于大菱鲆分子标记辅助育种,国内外开展了较为系统的研究。中国水产科学研究院黄海水产研究所开展了大菱鲆微卫星标记的筛选与应用研究,分析了微卫星位点与大菱鲆生长性状和耐高温性状的相关性(马爱军等,2009,2011),发现了5 个与生长速度相关和3 个与耐温性状相关的微卫星标记,构建了大菱鲆遗传连锁图谱并对相关生长性状进行了QTL 分析。国外对大菱鲆分子辅助育种的研究主要是西班牙。西班牙马德里康奈尔大学开展了大菱鲆生长相关的QTL 检测研究,定位了与体重、体长和富尔顿条件因素相关的 QTL 位点(Sánchez-Molano et al,2011)。西班牙圣地亚哥-德孔波斯特拉大学开展了大菱鲆表达序列标签(EST)资源的研究,获得基因丰富的高密度图谱为开展QTL 定位,位点克隆以及将来染色体组装奠定基础(Bouza et al,2012)。格拉纳达大学和圣地亚哥-德孔波斯特拉大学联合开展了大菱鲆中与免疫相关的表达序列标签(EST)的微卫星标记研究,这些微卫星的保存为锚定不同物种的遗传图谱,并确定特定性状的基因组区域铺平了道路(Navajas-Pérez et al,2012)。 西班牙维戈大学开展了大菱鲆抗病性QTL 定位研究(Rodríguez-Ramilo et al,2013)。维戈大学还开展了通过扫描基因组来检测影响大菱鲆对病毒性出血性败血症(VHS)有抗性并存活相关的数量性状座位(QTL),这一信息将应用于大菱鲆标记辅助选育和抗病相关候选基因的发掘,进而促进大菱鲆的生产(Rodríguez-Ramilo et al,2014)。西班牙国家研究委员会(ICM-CSIC)海洋科学研究所开展了对大菱鲆产业有益的标记辅助选育工程,首次鉴别出参与大菱鲆性别分化和成熟的关键基因(Laia et al,2013)。西班牙国家农业与食品技术研究院(INIA)和圣地亚哥-德孔波斯特拉大学的整合所有之前报道的图谱资源,获得了密集一致的遗传图谱,为大菱鲆进化研究和支撑持续的标记辅助育种提供了有用的工具。圣地亚哥-德孔波斯代拉大学和格拉纳达大学为了识别和验证适于大菱鲆遗传连锁图谱的构建和群体分析的SNP 标记,对来源于大菱鲆免疫组织的表达序列标签数据库加以追踪研究,这些SNP 标记为大菱鲆遗传连锁图谱的构建和QTL 鉴别以及群体结构和亲缘关系分析提供了一种新的遗传工具(Vera et al,2011)。西班牙卢赫罗纳大学和圣地亚哥- 德孔波斯特拉大学利用高通量基因分型技术开展了从两个454 构建的大菱鲆转录组中开发和验证单核苷酸多态性(SNPs)研究(Vera et al,2013)。上述研究为大菱鲆今后的分子标记辅助育种工作提供了参考和理论依据。
对于雌核发育技术,由于大菱鲆的生长优势明显,养殖全雌苗种可以大幅度缩短养殖周期和提高养殖效率,全雌苗种培育也成为培育大菱鲆良种的一个重要手段。近年来,国内外对大菱鲆全雌苗种培育技术的研究进展较为缓慢,至今性别决定机制尚不明确,目前,仅黄海水产研究所成功获得雌核发育苗种并培育至性成熟,为今后大菱鲆性别决定机制的明确和全雌苗种的培育奠定了基础(雷霁霖等,2012)。
全基因组选择是当前水产动物遗传改良的热点和前沿技术。全基因组选择即全基因组范围内的标记辅助选择,该方法的具体思路是利用覆盖整个基因组的标记将染色体分成若干个片段,即每相邻的两个标记就是一个染色体片段,然后通过标记基因型结合表型性状以及系谱信息分别估计每个染色体片段的效应,最后利用个体多携带的标记信息对其未知的表型信息进行预测,即将个体携带的各染色体片段效应累加起来,进而估计基因组育种值并进行选择。由此可见,全基因组选择是在传统MAS 基础上的创新和改进,是用覆盖全基因组的标记进行的辅助育种。近几年来,全基因组选择也逐渐被应用于部分水产动物的选育研究,但目前全基因组选择的技术成果距离实际应用还有很长的路要走,尚未真正应用到动物遗传育种中,利用全基因组选择对大菱鲆进行遗传改良也尚未见有报道。理论上,由于全基因组选择育种具有增加选择的准确性、 提高选择的效率、缩短育种周期、降低生产成本等优势,因此,基于全基因组育种技术对大菱鲆进行遗传改良是未来的发展方向。但从目前大菱鲆良种选育技术的实际应用效果上看,较为成熟的大规模家系选育技术仍然是未来几年大菱鲆等鱼类遗传改良的主要手段。
| 马爱军, 王新安, 雷霁霖. 2009. 大菱鲆(Scophthalmus maximus)不同生长阶段体重的遗传参数和育种值估计. 海洋与湖沼, 40(2): 187-194 |
| 马爱军, 许 可, 黄智慧等. 2011. 大菱鲆与耐高温性状相关的微卫星标记筛选. 海洋科学进展, 29(3): 370-378 |
| 马爱军, 王新安, 黄智慧等. 2012a. 大菱鲆(Scophthalmus maximus)家系选育F2 早期选择反应和现实遗传力估计. 海洋与湖沼, 43(1): 57-61 |
| 马爱军, 黄智慧, 王新安等. 2012b. 大菱鲆(Scophthalmus maximus)耐高温品系选育及耐温性能评估. 海洋与湖沼, 43(4):797-804 |
| 马爱军, 雷霁霖, 陈四清等. 2003. 大菱鲆营养需求与饲料研究进展. 海洋与湖沼, 34(4): 450-459 |
| 王新安, 马爱军, 黄智慧等. 2010. 鲆鲽鱼类品种遗传改良的研究进展. 海洋科学, 34(7): 100-105 |
| 石 峰, 张劲松, 赵兰英等. 2014. 大菱鲆“丹法鲆”与普通大菱鲆养殖效果对比试验. 中国水产, (4): 60-61 |
| 许 可, 马爱军, 王新安等. 2009. 大菱鲆(Scophthalmus maximus)生长性状相关的微卫星标记筛选. 海洋与湖沼, 40(5):577-583 |
| 杜佳垠. 2001. 世界大菱鲆Scophthalmus maximus (Linnaeus)养殖现状. 现代渔业信息, 16(2): 9-11 |
| 国家鲆鲽类产业技术研发中心. 2013. 国家鲆鲽类产业技术体系报告(2012)青岛: 中国海洋大学出版社. |
| 相建海. 2013. 中国水产种业发展过程回顾、现状与展望. 中国农业科技导报, 15(6): 1-7 |
| 栾 生, 孔 杰, 王清印等. 2008. 水产动物育种分析与管理系统的开发和应用. 海洋水产研究, 29(3): 92-100 |
| 雷霁霖, 马爱军, 陈 超等. 2005. 大菱鲆(Scophthalmus maximusL)养殖现状与可持续发展. 中国工程科学, 7(5): 30-34 |
| 雷霁霖, 刘新富, 关长涛. 2012. 中国大菱鲆养殖20 年成就和展望--庆祝大菱鲆引进中国20 周年. 渔业科学进展,33(4): 123-130 |
| Bouza C, Hermida M, Pardo B G et al. 2012.An ExpressedSequence Tag (EST)-enriched genetic map of turbot(Scophthalmus maximus): a useful framework for comparativegenomics across model and farmed teleosts. BMC Genetics,13: 54. |
| Danancher D, Garcia-Vazquez E. 2007. Genetic effects ofdomestication, culture and breeding of fish and shell shellfish,and their impacts on wild populations: Turbot Scophthalmusmaximus. In: Svåsand T, Crosetti D, García-Vázquez E,Verspoor E eds. Genetic Impact of Aquaculture Activities onNative Populations. Genimpact Final Scientific Report(EUcontract no. RICA-CT-2005-022802). 176p |
| Laia R, Pardo B G, Fernández C et al. 2013. A combined strategyinvolving Sanger and 454 pyrosequencing increases genomicresources to aid in the management of reproduction, diseasecontrol and genetic selection in the turbot (Scophthalmusmaximus). BMC Genomics, 14: 180 |
| Liang X M, Ma A J, Wang X A et al. 2012. Morphologicalcomparison between a selected fast-growing strain and thecommon cultured strain of turbot Scophthalmus maximus.Chinese Journal of Oceanology and Limnology, 30(4):563-568 |
| Navajas-Pérez R, Robles F, Molina-Luzón M J et al. 2012.Exploitation of a turbot (Scophthalmus maximus L.)immune-related expressed sequence tag (EST) database formicrosatellite screening and validation. Molecular EcologyResources, 12(4): 706-716 |
| Perry G M L, Martyniuk C M, Ferguson M M et al. 2005. Geneticparameters for upper thermal tolerance and growth-relatedtraits in rainbow trout (Oncorhynchus mykiss). Aquaculture,250(1-2): 120-128 |
| Pierrick H, Paulino M. 2008. Review on breeding and reproductionof European aquaculture species. Aquabreeding, 1-12 |
| Rodríguez-Ramilo S T, De La Herrán R, Ruiz-Rejón C et al,2014. Identification of quantitative trait loci associated withresistance to viral haemorrhagic Septicaemia (VHS) in turbot(Scophthalmus maximus): A comparison between bacterium,parasite and virus diseases. Marine Biotechnology, 16(3):265-276 |
| Rodríguez-Ramilo S T, Fernández J, Toro M A et al. 2013.Uncovering QTL for resistance and survival time toPhilasterides dicentrarchi in turbot (Scophthalmus maximus).Animal Genetics, 44(2): 149-157 |
| Sánchez-Molano E, Cerna A, Toro M A et al. 2011. Detection ofgrowth-related QTL in turbot (Scophthalmus maximus)BMC Genomics, 12: 473. |
| Svåsand T, Crosetti D, García-Vázquez E, Verspoor E. 2007.Genetic Impact of Aquaculture Activities on NativePopulations: Genimpact Final Scientific Report. Spain:University of Oviedo, 55-61 |
| Vera M, Álvarez-Dios J A, Millán A et al. 2011. Validation ofsingle nucleotide polymorphism (SNP) markers from animmune Expressed Sequence Tag (EST) turbot, Scophthalmusmaximus, database. Aquaculture, 313(1-4): 31-41 |
| Vera M, Alvarez-Dios J-A, Fernandez C et al. 2013. Developmentand validation of single nucleotide polymorphisms (SNPs)markers from two transcriptome 454-Runs of turbot(Scophthalmus maximus) using high-throughput genotyping.Int J Mol Sci, 14(3): 5694-5711 |
| Wang X A, Ma A J, Huang Z H et al. 2010. Heritability andgenetic correlation of survival in turbot (Scophthalmusmaximus). Chinese Journal of Oceanology and Limnology,26(8): 1200-1205 |
 2015, Vol. 46
2015, Vol. 46