中国海洋湖沼学会主办。
文章信息
- 袁瑞鹏, 刘建勇, 胡志国, 张嘉晨. 2015.
- YUAN Rui-Peng, LIU Jian-Yong, HU Zhi-Guo, ZHANG Jia-Chen. 2015.
- 凡纳滨对虾(Litopenaeus vannamei)不同生长阶段体质量的遗传变化
- GENETIC VARIATION IN BODY WEIGHT OF LITOPENAEUS VANNAMEI IN DIFFERENT GROWTH STAGES
- 海洋与湖沼, 46(5): 1160-1165
- Oceanologia et Limnologia Sinica, 46(5): 1160-1165.
- http://dx.doi.org/10.11693/hyhz20150700178
-
文章历史
- 收稿日期: 2015-07-03
- 收修改稿日期: 2015-07-21
体质量是凡纳滨对虾(Litopenaeus vannamei)重要经济性状之一,属于受多基因控制的复杂数量性状。生物数量性状的时空动态变化遗传机制较为复杂,备受研究学者重视(叶子弘等,2001)。有研究表明,生物体在不同的发育阶段,基因按一定的时间和空秩序选择性的表达,调控数量性状的遗传机制在整个个体发育过程中会发生显著变化(Atchley et al,1997),因此数量性状也会随之发生相应的时空动态变化(Atchley et al,1994)。发育数量遗传学动态研究在陆生动物(Atchley et al,1991; Cowley et al,1992)和植物(Fan et al,2000)方面报道较多,随着研究的深入,数量性状的发育遗传模型得到广泛应用,其中包括直接效应模型(Falconer et al,1996)、包含渐成效应的渐成模型(Wagner et al,1989),以及反映动态发育过程的生长轨迹模型(Kirkpatrick et al,1996)。但在水产经济动物中相关报道较为少见,马爱军等(2014)分析了大菱鲆体重性状不同生长期的基因遗传效应,Wang等(2006a,b)进行了红鲤体质量和形态特征的发育数量遗传动态分析。
凡纳滨对虾是我国最主要的对虾养殖品种,有必要对其展开各方面的研究。在凡纳滨对虾遗传育种方面,有关数量性状的遗传分析报道很多(Li et al,2015; Caballero-Zamora et al,2014)。这些研究多以收获时的目标性状为基础,通过对收获时产量性状表型值的统计分析估计综合遗传效应,但对于整个发育过程中的多基因时空表达的遗传效应动态变化很少涉及(Wang et al,2006; Gjerde et al,1997)。本研究基于条件数量性状加性-显性遗传模型(AD),分析凡纳滨对虾不同生长阶段体质量性状的动态遗传效应,以期评估凡纳滨对虾体质量性状的各种遗传效应时空表达顺序,为凡纳滨对虾遗传改良工作提供指导。
1 材料与方法 1.1 实验材料实验所用3个凡纳滨对虾亲本群体均为进口亲虾,分别为美国迈阿密SIS群体(M)、美国夏威夷SIS群体(H)和泰国正大群体(T)。2013年5月,采用自然交配与人工受精相结合的方法[人工授精按照赖秋明等(2005)报道的方法],构建杂交群体如表 1所示,共计9个交配组合,128个全同胞家系。
| 引进群体(♀) | 引进群体(♂) | ||
| 迈阿密(M) | 夏威夷(H) | 正大(Z) | |
| 迈阿密(M) | 9 | 16 | 11 |
| 夏威夷(H) | 13 | 15 | 21 |
| 正大(Z) | 18 | 10 | 15 |
| 合计 | 128 | ||
待各群体成功孵化后,将9个群体分别在9个18m2的育苗池中进行标准化幼体培育。当幼体发育至仔虾后,从每个群体随机取4000尾放入10m2的育苗池中继续单独培养。为消除环境差异,保持整个培育过程中条件尽量一致,主要包括培育过程中水的盐度、水温、幼体密度、饵料及充气等条件。为区分不同的群体,幼体生长至3—4cm,各交配组合群体随机选取300尾个体,在第5腹节和第6腹节处,进行可视嵌入性荧光标记(visible implant elastomer)注射。待标记稳定后,所有亲本与其杂交组合各100尾同池放养,每池900尾,设3个重复。供试水泥池3个,各10m2,养殖密度为90尾/m2其它水质调控、饵料投喂和日常管理等均按照标准化程序进行。
1.3 数据统计和测量分别于仔虾阶段、幼虾阶段、成虾阶段和留种阶段测量凡纳滨对虾体质量。各生长发育阶段个各水泥池中,每个群体随机选取30尾,使用电子天平测量体质量。
1.4 数据处理与分析Yij(t-1)利用Excel软件对体质量数据进行初步整理后,采用数量性状的加性-显性遗传模型、发育遗传模型及其统计分析方法(朱军,1997),估算不同发育时期凡纳滨对虾体质量性状的的非条件遗传效应和条件遗传效应。试验数据用QGAStation1.0 版软件进行数据分析。非条件遗传效应指(0-t)全部遗传效应表达的累积总量,统计模型为:
Yij(t) = u(t)+Ai(t)+Aj(t)+Dij(t)+eij(t)
式中,Yij(t)为t时刻测定的第i母本与第j个父本后代个体非条件表型观测值; u(t)为t时刻总体均值,Ai(t)为t时刻母本的非条件加性效应Ai(t)~(0,σ2Ai(t)); Aj(t)为t时刻父本的非条件加性效应Aj(t)~(0,σ2Aj(t)); Dij(t)为t时刻累加的显性效应Dij(t)~(0,σ2D(t)); eij(t)为t时刻非条件残差eij(t)~(0,σ2e(t))。
根据估计方差组分,通过Vp=Va+Vd+Ve可以获得表型方差。方差组分(加性Va(t)和显性Vd(t))采用采用最小范数二阶无偏估计法-MINQUE(1)法[minimumnorm quadratic unbiased estimation by setting 1 for all prior values,MINQUE(1)]估算,将之前的值设为1,MINQUE(1)。采用Jackknifing方法估算估计方差组分的标准差。然后使用t检验每个估计值的显著性。
条件遗传效应指(t-1-t)这一特定阶段净遗传效应的表达量。根据发育特征,t时刻的基因效应分为(t-1)时刻的累加基因效应和(t-1)到t期间内的额外基因效应。在(t-1)时刻测量的表型值条件上测量t时刻的表型值。因此,条件表型值的基因模型可以表示为:
Yij(t/t-1) = u(t/t-1)+Ai(t/t-1)+Aj(t/t-1)+Dij(t/t-1)+eij(t/t-1)
式中,Yij(t/t-1)为t时刻测定的第i母本与第j个父本后代个体条件表型观测值; u为t时刻总体均值,Ai(t/t-1)为t时刻母本的条件加性效应Ai(t/t-1)~(0,σ2Ai(t/t-1)); Aj(t/t-1)为t时刻父本的条件加性效应 Aj(t/t-1)~(0,σ2Aj(t/t-1)); Dij(t/t-1)为t时刻累加的显性效应Dij(t/t-1)~(0,σ2D(t/t-1)); eij(t/t-1)为t时刻条件残差eij(t/t-1)~(0,σ2e(t/t-1))。
条件方差组分(条件加性Va(t/t-1)和条件显性Vd(t/t-1))及它们的标准差估算方法如前面所述。
2 结果与分析 2.1 不同发育时刻体质量的描述性统计3个引进群体完全双列杂交获得的9个交配组合,包括6个杂交组合和3个自交组合,仔虾阶段(2013.07.24)、幼虾阶段(2013.08.27)、成虾阶段(2013.10.9)以及亲虾阶段(2014.03.08)体质量实测值的描述性统计见表 2。凡纳滨对虾各阶段体质量的中位数、最大值、最小值、第一四分位数、第三四分位数及异常值如图 1所示。凡纳滨对虾的仔虾阶段、幼虾阶段、成虾阶段以及亲虾阶段体质量均值和标准差(M±SD)分别为(1.3881±0.4589)g、(9.9270±2.4726)g、(21.3493± 4.1510)g和(44.2787±6.9392)g; 变异系数分别为0.3306、0.2491、0.1944、0.1567。凡纳滨对虾体质量由生物发育过程中多基因的表达、调控及相互作用决定。较高的变异系数说明,凡纳滨对虾个体间体质量差异明显。不同发育时刻的表现型差异表明,不同发育时期是呈动态变化过程的,且随着发育进程凡纳滨对虾体质量明显增加。
| 发育阶段 | 样本数 | 均值 | 最小值 | 最大值 | 标准差 | 变异系数 |
| 仔虾阶段S1 | 270 | 1.3881 | 0.40 | 3.80 | 0.4589 | 0.3306 |
| 幼虾阶段S2 | 270 | 9.9270 | 3.30 | 25.00 | 2.4726 | 0.2491 |
| 成虾阶段S3 | 270 | 21.3493 | 8.70 | 41.70 | 4.1510 | 0.1944 |
| 亲虾阶段S4 | 117 | 44.2787 | 27.50 | 74.00 | 6.9392 | 0.1567 |
 |
| 图 1 凡纳滨对虾不同发育阶段体质量性状箱线图 Fig. 1 Box plot of body weight of L. vannamei in different growth stages |
凡纳滨对虾仔虾、幼虾、成虾和亲虾4个发育时期体质量的非条件方差分量如图 2所示。仔虾阶段和幼虾阶段体质量非条件加性方差分量几乎为0,随着生长发育有增加趋势,成虾阶段和亲虾阶段分别8.856和24.114。不同发育时期凡纳滨对虾体质量非条件显性方差分量与非条件加性方差分量相比,呈现出不同的遗传表现。体质量在仔虾、幼虾、成虾阶段成递增趋势,亲虾阶段有所下降。体质量非条件加性方差分量和显性方差分量占表型方差的比例如图 3所示。在凡纳滨对虾体质量发育过程中,非条件加性方差分别为同一阶段表型方差总量的8.062%、0.9765%、11.308%和24.636%。仔虾、幼虾、成虾阶段控制凡纳滨对虾体质量的累加基因效应中显性效应分别占88.666%、98.664%、0.85050%,亲虾阶段控制凡纳滨对虾体质量表现的累加基因效应中加性效应占遗传方差总量的60.438%,表明控制凡纳滨对虾体质量表达的累加效应是以基因的显性效应为主,特别是早期生长发育阶段。
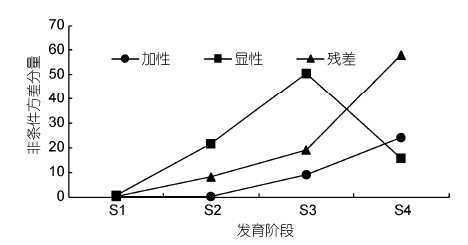 |
| 图 2 凡纳滨对虾不同发育阶段体质量性状非条件方差分量 Fig. 2 Unconditional variance components for body weight of L. vannamei in different growth stages |
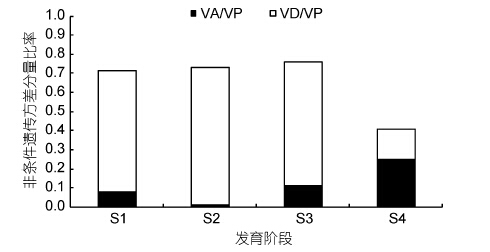 |
| 图 3 凡纳滨对虾不同发育阶段体质量性状非条件遗传方差分量比率 Fig. 3 Proportion of unconditional variance component for body weight of L. vannamei in different growth stages |
凡纳滨对虾不同发育时期体质量的条件遗传效应分析结果如表 4所示,4个发育时期或多或少均可发现有新的遗传效应表达。由表 4可知,0|S1、S2|S1、S3|S2和S4|S3 四个生长发育时间区间内新表达的净加性效应呈增高趋势,体质量性状条件加性方差分量估计值分别为0.075676±0.0101、0.270944± 0.0342、14.013±0.4847、25.68467±1.3631,均达到极显著水平(P<0.01)。而各时间区间内新表达的基因效应中的净显性效应则波动不定,其中S2|S1期间净显性效应表达最为活跃,效应估计值为14.4198± 0.9616。体质量非条件加性方差分量和显性方差分量占表型方差的比例如图 4所示,在凡纳滨对虾体质量发育过程中,显性方差分别为同一阶段表型方差的63.070%、64.038%、15.198%和3.820%,其中条件加性方差分别为同一阶段表型方差的8.132%、1.203%、36.122%和29.581%。0|S1和S2|S1期间控制凡纳滨对虾体质量表现的基因效应是以净显性效应为主,分别占同一阶段遗传方差总量88.666%和98.156%; S2|S3和S3|S4发育时间区间内均以净加性效应为主,分别占同一阶段遗传方差总量的70.386%和88.565%。
| 发育时期 | 加性方差 | 显性方差 | 残差 | |||
| 估计值 | 标准误 | 估计值 | 标准误 | 估计值 | 标准误 | |
| 0|S1 | 0.075676 ** | 0.0101 | 0.592021 ** | 0.0225 | 0.270983 ** | 0.0152 |
| S2|S1 | 0.270944 ** | 0.0342 | 14.4198 ** | 0.9616 | 7.82665 ** | 0.8749 |
| S3|S2 | 14.013 ** | 0.4847 | 5.89562 ** | 0.6721 | 18.8849 ** | 0.8386 |
| S4|S3 | 25.68467 ** | 1.3631 | 3.3163 ** | 0.2696 | 57.8287 ** | 6.0755 |
| **表示显著达到 0.01 水准 | ||||||
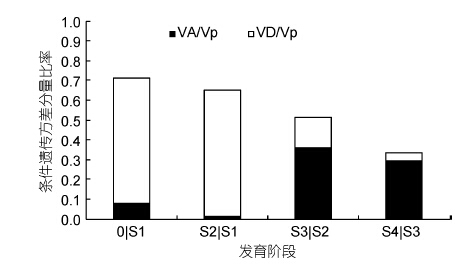 |
| 图 4 凡纳滨对虾不同发育阶段体质量性状条件遗传方差分量比率 Fig. 4 Proportion of conditional variance component for body weight of L. vannamei in different growth stages |
凡纳滨对虾体质量作为重要的经济性状直接影响着对虾养殖产量,明确体质量性状的动态发育规律可以有效地指导凡纳滨对虾遗传育种。凡纳滨对虾体质量性状遗传基础复杂,其发育受众多基因的控制,且在生物体的不同发育时期,遗传机制呈动态变化(陈幼玉等,2005)。在个体发育过程中,不同的基因会在特定发育阶段表达,一些基因关闭,而另外一些基因则在特定发育时期表达(Shi et al,2001)。朱军(1997)提出了基于混合线性模型的条件数量性状遗传分析方法,可以更好地阐明特定发育阶段的遗传效应。Henderson(1988)最早将这种条件分析方法应用于动物育种中基础群体的遗传方差估算。此方法不仅可以获得两时刻之间的净遗传效应,而且可将净遗传效应进一步分解为加性、显性等遗传分量,可了解各遗传效应在特定时间段的相对贡献。基于加性-显性遗传模型的遗传分析方法在陆生动植物(Atchley et al,1991)中应用广泛,在水生动物的遗传分析上,近年来逐渐被学者接受(Tian et al,2011; Wang et al,2015)。本研究基于加性-显性遗传模型,利用条件和非条件分析方法,对凡纳滨对虾不同发育时期体质量性状分析表明,发基因在不同发育时期表达上存在着的明显差异,条件与非条件方差分量结果显示,凡纳滨对虾养殖的早期主要以显性效应表达为主,随着对虾生长发育进行控制体质量性状的加性效应表达呈增加趋势,每一时期均有新的基因表达。
3.2 显性遗传效应显性效应是基因位点内等位基因之间的互作效应,为可以遗传但不能固定的遗传因素,是产生杂种优势的主要部分(贺竹梅,2002)。一些研究已经表明,显性遗传效应和共同环境等非加性效应是虾类(Hung et al,2014; Li et al,2015)、鱼类(Gjerde et al,1994; Wang et al, 2006a,b)数量性状的总表型变异中的一个重要组成部分。虹鳟(Pante et al,2002)收获时体质量的显性遗传方差占表型方差的0.22; 大西洋鲑鱼(Rye et al,1998)收获时体质量显性方差分量在0.08到0.27之间; 罗氏沼虾(Luan et al,2012)收获时体质量存在显著的共同环境效应(0.013—0.053),间接证明了显性效应的存在。凡纳滨对虾(Li et al,2015)体质量性状共同环境效应估计值为0.028,暗示了非加性方差(显性遗传效应)的重要性。本研究通过对凡纳滨对虾体质量非条件遗传分析,结果表明,在凡纳滨对虾的养成阶段,显性遗传效应占总遗传变异的主要部分,表明可以采用选育性杂交育种改良其生长性状,同时也暗示本研究凡纳滨对虾群体有较高杂种优势、丰富的遗传多样性以及遗传变异的不稳定性。因此对于本研究利用收集的亲本群体构建凡纳滨对虾选育基础群体是可行的,且有必要进行下一代选育已达到基因的纯化和固定。
3.3 加性遗传效应本研究中,不同时期凡纳滨对虾体质量性状的加性遗传效应表达存在2个特征。其一,与较高的显性效应相比,不同时期凡纳滨对虾体质量性状的加性遗传效应相对较低,而且与其他学者报道的凡纳滨对虾加性遗传方差分量相比,也是偏低的。栾生等(2013)使用个体动物模型估计凡纳滨对虾收获时体质量的加性遗传方差分量为0.49; Gitterle等(2005)估计凡纳滨对虾收获时体质量的加性遗传方差分量高达0.54; 笔者认为造成差异的原因除选育群体不同、养殖环境不同外,还应包括数据统计分析模型的差异。Rye等(1998)和Pante等(2002)研究表明在个体动物模型中,拟合加入非加性效应,特别是显性遗传效应,会导致估计的遗传力显著降低,而残余方差保持不变或略有增加。因此,如果显性遗传方差不包括在动物模型中预测的遗传反应可能偏高。其二,在凡纳滨对虾仔虾期、幼虾期加性遗传效应的表达量低于0.1,成虾期以后才有较高表达,即亲虾期(S4)的累积加性效应(图 3)主要是由S2|S3和S3|S4期的净加性效应(图 4)组成。
| 马爱军,王新安,. 2014.大菱鲆体重性状不同生长期的遗传分析.中国水产科学, 21(2):244-249 |
| 叶子弘,朱军,. 2001.数量性状发育遗传模型及其分析方法的研究进展.遗传, 23(1):65-68 |
| 朱军,. 1997.加性-显性遗传模型分析.见:中华人民共和国农业部教育司主编.遗传模型分析方法.北京:中国农业出版社, 55-60 |
| 陈幼玉,祁建民,林荔辉等,. 2005.红麻株高与茎粗性状的动态发育遗传分析.应用生态学报, 16(6):1011-1016 |
| 贺竹梅,. 2002.数量性状与多基因遗传.见:贺竹梅主编.现代遗传学教程.广州:中山大学出版社, 287-301 |
| 栾生,罗坤,阮晓红等,. 2013.凡纳滨对虾(Litopenaeus vannamei)体重、存活性状的遗传参数和基因型与环境互作效应.海洋与湖沼, 44(2):445-452 |
| 赖秋明,王海石,符孔忠,. 2005.凡纳滨对虾人工授精的初步研究.海洋科学, 29(10):19-22 |
| 樊龙江,石春海,吴建国等,. 2000.籼稻糙米厚度的发育遗传研究.遗传学报, 27(10):870-877 |
| Atchley W R, Hall B K,. 1991. A model for development and evolution of complex morphological structures. Biological Reviews, 66(2):101-157 |
| Atchley W R, Xu S Z, Vogl C,. 1994. Developmental quantitative genetic models of evolutionary change. Developmental Genetics, 15(1):92-103 |
| Atchley W R, Zhu J,. 1997. Developmental quantitative genetics, conditional epigenetic variability and growth in mice. Genetics, 147(2):765-776 |
| Caballero-Zamora A, Montaldo H H, Campos-Montes et al,. 2014. Genetic parameters for body weight and survival in the Pacific White Shrimp Penaeus(Litopenaeus) vannamei affected by a White Spot Syndrome Virus(WSSV) natural outbreak. Aquaculture,(http://dx.doi.org/10.1016/j.aquaculture.2014.08.028) |
| Cowley D E, Atchley W R,. 1992. Quantitative genetic models for development, epigenetic selection, and phenotypic evolution. Evolution, 46(2):495-518 |
| Falconer D S, Mackay T F,. 1996. Introduction to Quantitative Genetics(4th ed). London:Benjamin Cummings |
| Gitterle T, Rye M, Salte R et al,. 2005. Genetic(co) variation in harvest body weight and survival in Penaeus(Litopenaeus) vannamei under standard commercial conditions. Aquaculture, 243(1-4):83-92 |
| Gjerde B, Roer J E, Lein I et al,. 1997. Heritability for body weight in farmed turbot. Aquaculture International:Journal of the European Aquaculture Society, 5(2):175-178 |
| Gjerde B, Simianer H, Refstie T,. 1994. Estimates of genetic and phenotypic parameters for body weight, growth rate and sexual maturity in Atlantic salmon. Livestock Production Science, 38(2):133-143 |
| Henderson C R,. 1988. A simple method to account for selected base populations. Journal of Dairy Science, 71(12):3399-3404 |
| Hung D, Nguyen N H, Hurwood D A et al,. 2014. Quantitative genetic parameters for body traits at different ages in a cultured stock of giant freshwater prawn(Macrobrachium rosenbergii) selected for fast growth. Marine and Freshwater Research, 65(3):198-205 |
| Kirkpatrick M, Lofsvold D, Bulmer M,. 1990. Analysis of the inheritance, selection and evolution of growth trajectories. Genetics, 124(4):979-993 |
| Li W J, Luan S, Luo K et al,. 2015. Genetic parameters and genotype by environment interaction for cold tolerance, body weight and survival of the Pacific white shrimp Penaeus vannamei at different temperatures. Aquaculture, 441:8-15 |
| Luan S, Yang G L, Wang J Y et al,. 2012. Genetic parameters and response to selection for harvest body weight of the giant freshwater prawn Macrobrachium rosenbergii. Aquaculture, 362-363:88-96 |
| Pante M J R, Gjerde B, McMillan I et al,. 2002. Estimation of additive and dominance genetic variances for body weight at harvest in rainbow trout, Oncorhynchus mykiss. Aquaculture, 204(3-4):383-392 |
| Rye M, Mao I L,. 1998. Nonadditive genetic effects and inbreeding depression for body weight in Atlantic salmon(Salmo salar L.). Livestock Production Science, 57(1):15-22 |
| Shi C H, Wu J G, Fan L J et al,. 2001. Developmental genetic analysis of brown rice weight under different environmental conditions in indica rice. Acta Botanica Sinica, 43(6):603-609 |
| Tian Y S, Xu T J, Liang Y et al,. 2011. Estimates of genetic and phenotypic parameters for weight and length in Paralichthys olivaceus(Temminck et Schlegel). Acta Oceanologica Sinica, 30(6):58-64 |
| Wagner G P,. 1989. Multivariate mutation-selection balance with constrained pleiotropic effects. Genetics, 122(1):223-234 |
| Wang C H, Li S F, Liu Z G et al,. 2006a. Developmental quantitative genetic analysis of body weight and morphological traits in red common carp, Cyprinus carpio L. Aquaculture, 251(2-4):219-230 |
| Wang C H, Li S F, Xiang S P et al,. 2006b. Additive, dominance genetic effects for growth-related traits in common carp, Cyprinus carpio L. Aquaculture Research, 37(14):1481-1486 |
| Wang X A, Ma A J, Ma D Y,. 2015. Developmental quantitative genetic analysis of body weights and morphological traits in the turbot, Scophthalmus maximus. Acta Oceanologica Sinica, 34(2):55-62 |
 2015, Vol. 46
2015, Vol. 46


