中国海洋湖沼学会主办。
文章信息
- 范东东, 魏永伟, 苗亮, 陈炯. 2015.
- FAN Dong-Dong, WEI Yong-Wei, MIAO Liang, CHEN Jiong. 2015.
- 罗氏沼虾(Macrobrachium rosenbergii)传染性皮下和造血器官坏死病毒(IHHNV)的流行病学调查
- EPIDEMIOLOGY OF INFECTIOUS HYPODERMAL AND HEMATOPOIETIC NECROSIS VIRUS IN MACROBRACHIUM ROSENBERGII
- 海洋与湖沼, 46(5): 1153-1159
- Oceanologia et Limnologia Sinica, 46(5): 1153-1159.
- http://dx.doi.org/10.11693/hyhz20150600168
-
文章历史
- 收稿日期: 2015-06-23
- 收修改稿日期: 2015-07-16
传染性皮下和造血器官坏死病毒(infectious hypodermal and hematopoietic necrosis virus,IHHNV)在世界范围内广泛分布,是目前危害对虾养殖的主要病害之一(Kim et al,2012; Rai et al,2012; Macías- Rodríguez et al,2014)。IHHNV主要感染凡纳滨对虾(Litopenaeus vannamei)、斑节对虾(Penaeus monodon)和细角滨对虾(Litopenaeus stylirostris)。IHHNV感染凡纳滨对虾和斑节对虾(Rai et al,2009; Saksmerprome et al,2010)后引起患病对虾生长缓慢,生长畸形,导致慢性矮小残缺综合症(runt deformity syndrome,RDS),被感染虾群30%—90%出现生长滞缓; IHHNV感染细角滨对虾后死亡率高达90%(Bell et al,1984)。IHHNV给对虾养殖带来极大危害,国际兽疫局(Office International des Epizooties)将该病划为必须向其申报的甲壳类重要疾病(Rai et al,2012)。IHHNV已广泛流行于世界各地,包括美国(Lightner,2011)、墨西哥(Macías-Rodríguez et al,2014)、厄瓜多尔(Tang et al,2003)、巴西(Silva et al,2014)、韩国(Flegel,2012)、印度(Otta et al,2014)、越南(Tang et al,2003)、泰国(Flegel,1997)、菲律宾等国家。近年来,IHHNV在国内对虾养殖中也广泛流行,施慧等(2013)对2009— 2010年间浙江地区近22家对虾苗种生产场的对虾苗种携带IHHNV情况进行调查,阳性率达38.98%。林开等(2013)对浙江省6个主要南美白对虾养殖地区进行调查,结果显示IHHNV阳性率高达100%。袁颜颜等(2015)用OIE公布的4对不同引物在中国(华南,华北,华东)的凡纳滨对虾、斑节对虾、中国明对虾(Fenneropenaeus chinensis)和宽沟对虾(Peanaeus latisulcatus)中均检测到了IHHNV。这些研究说明IHHNV 在国内养殖对虾中已较普遍地感染,且在华东和华南地区形成了一定的流行趋势。
IHHNV除了感染南美白对虾、斑节对虾和细角滨对虾外,亦可感染日本囊对虾(Marsupenaeus japonicus)、加州对虾(Farfantepenaeus californiensis)和短沟对虾(Penaeus semisulcatus)等(杨冰等,2005; 白丽蓉等,2012)。国外及中国的台湾地区曾有报道IHHNV可感染罗氏沼虾(Macrobrachium rosenbergii)(Hsieh et al,2006)。2009年在马来西亚的野生罗氏沼虾中也检测到了IHHNV,阳性率为20%(Hazreen Nita et al,2012),检测阳性的亲虾并未发病。罗氏沼虾又名马来西亚大虾,是一种大型淡水虾,原产厄瓜多尔沿岸,是世界上养殖量最高的三大虾种之一,它具有生长快、食性广、肉质营养成分好、养殖周期短等优点(Tidwell et al,2000)。截止到2012年,中国罗氏沼虾养殖面积迅速增长至13000 hm2,在我国10余个省市自治区均有养殖,主要集中在长江三角洲和珠江三角洲,年总产量可达130000吨,经济效益显著(Zhang et al,2015)。我国已成为罗氏沼虾的重要养殖大国,但IHHNV在中国大陆地区罗氏沼虾感染情况目前尚未见报道。本研究在中国大陆地区首次开展了IHHNV感染罗氏沼虾状况调查。研究发现,IHHNV在我国华东和华南地区的罗氏沼虾养殖区已广泛流行,但感染病毒的罗氏沼虾并没有表现出显著的临床及病理症状,仅表现为IHHNV携带。
1 材料与方法 1.1 样品采集待检样品均为罗氏沼虾成虾,2013—2014年间,随机采集于主要养殖区华东(宁波、杭州、温州)和华南(深圳、佛山、增城、湛江)地区的多个罗氏沼虾养殖场,样品用于基因组DNA提取和组织切片处理,剩余样品保存于-80°C备用。
1.2 基因组DNA的提取剪取每尾活体虾的前肠和尾部肌肉组织(Hsieh et al,2006; Rai et al,2012)共50 mg,按照Genomic DNA Extraction Kit Ver.5.0(TaKaRa,中国大连)说明书提取基因组DNA,保存于-20°C备用。
1.3 PCR 检测使用国际兽疫局(OIE)推荐的IHHNV标准检测引物(引物序列389F: 5’-CGGAACACAACCCGAC TTTA-3’和389R: 5’-GGCCAAGACCAAAATACGAA-3’),对各地沼虾样品进行检测。PCR反应体系(25 μL): 去离子无菌水17.25 μL、10×Buffer 2.5 μL、dNTP(2.5 mmol/L)2 μL,上下游引物(10 μmol/L)各1 μL,rTaq DNA聚合酶0.25 μL,进行充分混匀,再加1 μL模板。扩增反应在Mastercycler pro梯度PCR仪(德国eppendorf公司)上进行,PCR反应条件为: 94°C预变性5 min; 94°C变性30 s、55°C退火30 s、72°C延伸30 s,共35个循环,最后72°C延伸10 min,6°C保存。PCR扩增产物通过2%的琼脂糖凝胶电泳后,经E.B染色后,在紫外成像仪下拍照观察。不同地区样品分别取三个目的条带用Gel Extraction Kit(OMEGA,美国)切胶回收,克隆到pMD19-T-simple(TaKaRa,中国大连)载体后测序证实。
1.4 序列分析利用DNASTAR、BLAST、BioEdit对测序结果进行核苷酸和氨基酸序列同源性分析。从GenBank中选取已知核酸序列作为参考毒株,用MEGA5.0构建进化树(the Neighbor-Joining method)。采用DNASP 5.0(Rozas et al,2003)确定序列多态性位点数(number of segregating(polymorphic)sites,S)、同义突变位点数(number of synonymous substitutions sites,NSS)、非同义突变为点数(number of nonsynonymous substitutions sites,NNS)、核苷酸多态度(nucleotide diversity,Pi)、单倍型数(number of haplotypes,H)、单倍型多样度(haplotype(gene)diversity,Hd)以及样本中所有单倍型对两两的平均核苷酸差异数(average number of nucleotide differences,K)。
1.5 组织切片观察无菌条件下,取PCR检测为阳性罗氏沼虾样品(同时设阴性样品为对照)的前肠和肝胰腺组织,置于4%福尔马林中固定24h,石蜡包埋,制备病理切片,HE染色,显微镜下观察阳性样品组织病理变化。
2 结果 2.1 PCR检测不同区域罗氏沼虾IHHNV感染情况将采自华东和华南不同地区的待检罗氏沼虾样品,以提取的基因组DNA为模板,389F/R为引物进行PCR扩增,产物经2%的琼脂糖凝胶电泳分析,多数样品成功扩增出大小约390 bp的特异性目的条带,与预计大小一致,阴性对照无条带。图 1示例宁波地区样品检测结果。7个地区分别取三个独立克隆,克隆到pMD19-T-simple载体后测序,经BLAST比对证实扩增的特异性序列为IHHNV非结构蛋白-1(NS-1)基因部分序列,长度为389 bp。
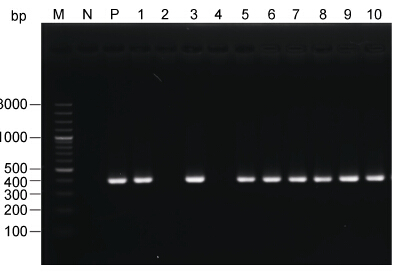 |
| 图 1 IHHNV-389F/R检测宁波罗氏沼虾样品中的IHHNV Fig. 1 PCR detection of IHHNV using primers IHHNV-389F/R in the DNA extracted from M. rosenbergii sampled from Ningbo M: 100 bp DNA maker; N: 阴性对照; P: 阳性对照; 1—10: 采集的宁波罗氏沼虾样品 |
华东和华南不同地区罗氏沼虾成虾样品IHHNV PCR检测结果如表 1所示,各地区均检出了较高的阳性率,总阳性率为90%(99/110)。其中华东地区(宁波、温州、杭州)阳性率为83.3%,华南地区(湛江、增城、佛山、深圳)阳性率为92.5%,华南地区IHHNV阳性率高出华东地区9.2%。
| 样品采集地点 | ||||||||
| 宁波 | 温州 | 杭州 | 湛江 | 增城 | 佛山 | 深圳 | 总计 | |
| 阳性尾数/总检测数 | 8/10 | 9/10 | 8/10 | 16/20 | 18/20 | 20/20 | 20/20 | 99/110 |
| 阳性率(%) | 80 | 90 | 80 | 80 | 90 | 100 | 100 | 90 |
将本研究克隆的7个不同地区的罗氏沼虾IHHNV基因组片段,分别进行测序,并将基因序列分别登录到GenBank数据库,序列号分别为: KR364607(Ningbo A株)、KR364608(Wenzhou株)、KR364609(Hangzhou株)、KR364610(Shenzhen株)、KR364611(Zengcheng株)、KR364612(Zhanjiang株)、KR364613(Foshan株)。选取本研究克隆的7个不同地区的罗氏沼虾IHHNV序列与GenBank中不同国家和地区的15株IHHNV毒株序列,基于IHHNV非结构蛋白-1(NS-1)基因部分序列进行分析。采用MEGA5.0软件构建进化树。如图 2,华东地区杭州株、宁波株、温州株构成一簇,在进化关系上较近,属于IHHNV基因Ⅱ型,同时与2011年分离于越南斑节对虾的毒株JN616415以及来自于印度、泰国,以及中国台湾地区等其它东南亚地区感染性分离株(均分离于斑节对虾)的亲缘关系较近。华南地区的佛山株、增城株、深圳株和湛江株均属于IHHNV基因Ⅰ型,其中佛山株和增城株与2006年首次从台湾罗氏沼虾分离的毒株DQ057983以及2009年马来西亚罗氏沼虾分离株HM536212亲缘关系较近。
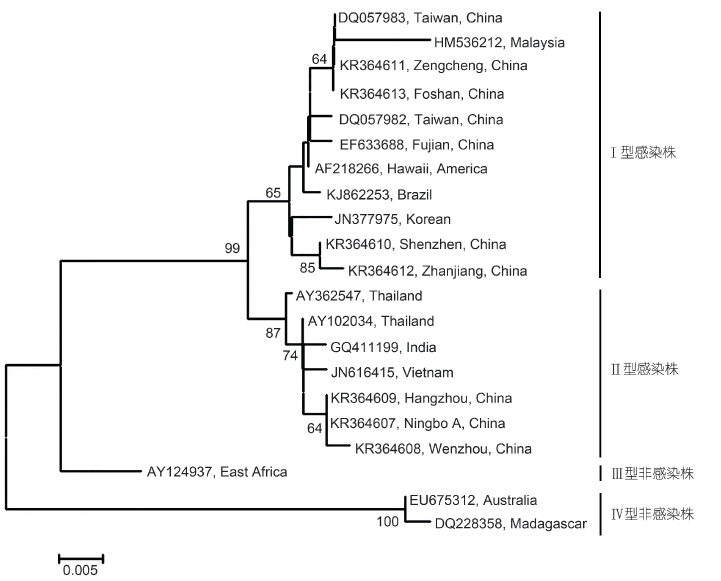 |
| 图 2 基于IHHNV非结构蛋白-1基因部分序列(389bp)的系统进化树分析 Fig. 2 Phylogenetic tree of partial nucleotide sequence(389 bp)of IHHNV non-structural protein 1 gene using the neighbor-joining method 分叉处数值表示1000次重复抽样所得到的置信度,只显示置信度60%以上的数值; 标尺长度表明每个碱基发生0.005次置换 |
应用BioEdit进行核酸和氨基酸序列同源性分析显示(表 2),新分离株与Ⅰ型感染株的核苷酸同源性在96.9%—100%之间,氨基酸同源性在94.5%—100%之间,与Ⅱ型感染株核苷酸同源性在98.2%—99.7%之间,氨基酸同源性在96.1%—99.2%之间; 与非感染型毒株Ⅲ型和Ⅳ型IHHNV相同源性较低,核酸同源性在91.7%—95.8%之间,氨基酸同源性在88.3%— 93.7%之间。其中增城株和佛山株与2006年分离于台湾罗氏沼虾的高致死性毒株(DQ057983)核酸和氨基酸序列同源性均高达100%; 新分离的各地理毒株与最早分离的高致死性IHHNV夏威夷株(AF218266)核酸同源性在98.2%—99.7%之间,氨基酸同源性在96.7%—99.2%之间。
| IHHNV分型* | WZ | HZ | SZ | ZC | ZJ | FS | Ⅰ型 | Ⅱ型 | Ⅲ型 | Ⅳ型 | |
| 宁波株(NB) | nt | 99.7 | 100 | 98.4 | 98.2 | 98.2 | 98.2 | 96.9—98.4 | 99.4—99.7 | 96.6 | 92.0—92.2 |
| aa | 99.2 | 100 | 96.1 | 96.1 | 96.1 | 96.1 | 95.3—96.8 | 98.4—99.2 | 93.7 | 88.3—89.7 | |
| 温州株(WZ) | nt | 99.7 | 98.2 | 97.9 | 97.9 | 97.9 | 96.6—98.2 | 99.2—99.4 | 96.4 | 91.7—92.2 | |
| aa | 99.2 | 95.3 | 95.3 | 95.3 | 95.3 | 94.5—96.1 | 97.6—98.4 | 93.0 | 88.3—87.5 | ||
| 杭州(HZ) | nt | 98.4 | 98.2 | 98.2 | 98.2 | 96.9—98.4 | 98.4—98.7 | 96.6 | 92.0—92.2 | ||
| aa | 96.1 | 96.1 | 96.1 | 96.1 | 95.3—96.8 | 98.4—99.2 | 93.7 | 88.3—89.1 | |||
| 深圳(SZ) | nt | 99.2 | 99.7 | 99.2 | 97.9—99.4 | 98.4—98.7 | 96.1 | 92.0—92.2 | |||
| aa | 98.4 | 100 | 98.4 | 97.6—99.2 | 96.1—96.8 | 93.0 | 88.3—89.1 | ||||
| 增城(ZC) | nt | 98.9 | 100 | 98.7—100 | 98.2—98.7 | 95.8 | 92.2—92.5 | ||||
| aa | 98.4 | 100 | 98.4—100 | 96.1—96.8 | 93.0 | 88.3—89.1 | |||||
| 湛江(ZJ) | nt | 98.9 | 97.6—99.2 | 98.2—98.4 | 95.8 | 91.7—92.0 | |||||
| aa | 98.4 | 97.6—99.2 | 96.1—96.8 | 93.0 | 88.3—89.1 | ||||||
| 佛山(FS) | nt | 98.7—100 | 98.2—98.7 | 95.8 | 92.2—92.5 | ||||||
| aa | 98.4—100 | 96.1—96.8 | 93.0 | 88.3—89.1 | |||||||
| Ⅰ型 | nt | 97.6—99.7 | 96.9—98.9 | 94.6—96.4 | 91.0—93.0 | ||||||
| aa | 97.6—99.7 | 95.3—97.6 | 92.2—93.7 | 88.3—90.6 | |||||||
| Ⅱ型 | nt | 99.4—99.7 | 96.6—96.9 | 92.0—92.8 | |||||||
| aa | 99.2—100 | 93.7—94.5 | 88.3—89.9 | ||||||||
| Ⅲ型 | nt | — | 94.0—94.3 | ||||||||
| aa | — | 91.4—92.2 | |||||||||
| Ⅳ型 | nt | 99.7 | |||||||||
| aa | 99.2 | ||||||||||
| *IHHNV 分型参考图 2. Ⅰ型: AF218266、KJ862253、JN377975、EF633688、DQ057983、DQ057982, HM536212; Ⅱ型: AY102034, GQ411199,AY362547; Ⅲ型: AY124937; Ⅳ型: EU675312, DQ228358 | |||||||||||
应用DNAsp 5.10.01对GenBank中所有IHHNV NS-1基因部分序列(共37条)以及本实验从罗氏沼虾中新得到的7条IHHNV序列,进行核苷酸多样性和单倍型多样性分析显示如表 3所示,从罗氏沼虾中分离的IHHNV毒株有10个多态性位点数(3个同义突变; 7个非同义突变),有转换和颠换,没有缺失插入突变; 有5个单倍型; 核苷酸多样性为0.0125,单倍型多样度为0.905; 罗氏沼虾分离株使IHHNV总的核酸多态性位点数增加了5个,总的单倍型数增加了4个,总的核苷酸多样度变化不大,而总的单倍型多样度比原来升高了0.012。
| 病毒序列来源* | 核苷酸多样性 | 单倍型多样性 | |||||
| 多态性位点数 S | 同义突变位点数NSS | 非同义突变位点数NNS | 核苷酸多样度 P i | 单倍型数 H | 单倍型多样度 H d | 平均核苷酸差异数 K | |
| 中国罗氏沼虾分离株 | 10 | 3 | 7 | 0.0125 | 5 | 0.905 | 4.857 |
| GenBank-IHHNV序列 | 52 | 18 | 34 | 0.0187 | 21 | 0.926 | 7.252 |
| 总计 | 57 | 20 | 37 | 0.0179 | 25 | 0.942 | 6.949 |
通常情况下,IHHNV感染对虾会引起对虾外胚层和中胚层起源的组织细胞内出现典型的细胞核内Cowry A型包涵体,包涵体嗜伊红色,细胞核肥大,细胞质分布于细胞膜周围(Lightner et al,1983; Rai et al,2012)。本研究中,分别解剖IHHNV PCR检测为阳性和阴性的罗氏沼虾,观察各器官病理变化情况。选取肝胰腺和前肠,制备组织切片,经H.E染色后,结果发现各地区阳性样品均未观察到核内包涵体和显著的上述病理学变化,与对照组(PCR检测阴性样品)组织情况相近(图 3)。
 |
|
图 3 IHHNV感染(a,c)和健康(b,d)的罗氏沼虾肝胰腺和前肠组织切片(×400)
Fig. 3 Histopathological section of hepatopancreas and fore gut of M. rosenbergii
标尺长度=100 μm。a: IHHNV PCR阳性罗氏沼虾肝胰腺; b: IHHNV PCR阴性罗氏沼虾肝胰腺; c: IHHNV PCR阳性罗氏沼虾前肠; d: IHHNV PCR阴性罗氏沼虾前肠 |
IHHNV是危害对虾养殖的重要病害之一,主要感染南美白对虾、细角滨对虾和斑节对虾。早期国外调查显示IHHNV在野生和养殖的细角滨对虾、南美白对虾、斑节对虾等对虾中广泛存在,并且该病造成夏威夷一些养殖区的细角滨对虾死亡率达90%(Lightner et al,1983; Lightner,1996)。目前,国际上有关罗氏沼虾感染IHHNV仅有2例报道。其中一例发生在我国台湾省,2006年台湾东南部的罗氏沼虾幼体和仔虾感染了IHHNV,并导致80%的致死率(Hsieh et al,2006); 另一例发生在马来西亚,2012年马来西亚野生和养殖罗氏沼虾中检测到IHHNV,阳性率为20%,但阳性沼虾没有任何患病迹象(Hazreen Nita et al,2012),这与Zhang 等(2007)在凡纳滨对虾中调查的情况十分相似,检测阳性的凡纳滨对虾无病症,仅表现为携带病毒。在本研究中,我们首次在中国大陆地区罗氏沼虾中检测到IHHNV,并在此基础上开展了IHHNV在罗氏沼虾中的流行情况研究,发现在我国华东和华南地区的罗氏沼虾养殖区,IHHNV阳性率高达90%,但检测阳性罗氏沼虾均未表现病症,仅携带病毒。
系统进化树分析揭示,本研究报道的各地新分离株均起源于感染型IHHNV毒株(图 2)。前期研究报道表明,IHHNV亚洲分离株之间有很大差异,而美洲分离株之间几乎没有差异(Tang et al, 2002,2003),可将不同地区IHHNV分为4种基因型:Ⅰ型,主要分离自美洲和南亚(主要是菲律宾); Ⅱ型,主要分离自东南亚; Ⅲ型(亦称之A型),主要分离自马达加斯加、印度、毛里求斯,和澳大利亚; Ⅳ型(亦称之B型),主要分离自东非、莫桑比克,和坦桑尼亚(Winton et al,2010)。Ⅰ型和Ⅱ型为感染型(Lightner et al,1983),Ⅲ型和Ⅳ型为非感染型(Tang et al,2003; Krabsetsve et al,2004; Tang et al,2006)。在本研究中,我们检测到的华南地区毒株中佛山株和增城株与2006年首次从台湾罗氏沼虾分离的毒株(DQ057983)以及2009年马来西亚罗氏沼虾分离株(HM536212)亲缘关系较近,属于Ⅰ型感染株,可能来源于菲律宾(Tang et al,2002); 华东地区毒株与2011年分离于越南斑节对虾的毒株(JN616415)以及来自于印度、泰国,还有中国台湾等其它东南亚地区感染性分离株(均分离于斑节对虾)的亲缘关系较近,属于Ⅱ型感染株,可能来源于东南亚(Tang et al,2003)。根据序列同源性分析,新分离株与感染型参考株的核苷酸同源性在98.2%— 100%之间,氨基酸同源性在94.5%—100%之间; 而与非感染性参考株马达加斯加分离株(DQ228358)和澳大利亚株(EU675312)相似性较低,核酸同源性在91.7%—92.5%之间,氨基酸同源性在88.3%—89.1%,证明新分离的毒株均属于感染型IHHNV,同时这些不同地区间毒株序列的差异很有可能与地理起源有关(Tang et al,2002)。
Robles-Sikisaka等(2010)通过比较不同地理位置的细角滨对虾和斑节对虾中分离的14株病毒序列,分析得到高的核苷酸替代率(1.39×10-4/位点/年),表明IHHNV核苷酸多态性比之前报道的要高得多,并且不同地区和宿主,遗传多态性也不一样。本研究揭示,中国大陆地区罗氏沼虾IHHNV分离株核苷酸多样度为0.0125,单倍型多样度为0.905,平均核苷酸差异数为4.857,显示了罗氏沼虾新分离株遗传多样性水平较高,丰富了IHHNV的遗传多样性; 而高的单倍型多样度Hd值,低的核苷酸多样度Pi值,这与Robles-Sikisaka等(2010)的IHHNV多样性研究结果类似,表明尽管该病毒变异导致单倍型的多态性的积累,但核苷酸序列的多样化还未能积累。
早期病理学研究发现,IHHNV感染对虾会引起对虾外胚层和中胚层起源的组织细胞内出现典型的细胞核内Cowry A型包涵体,包涵体嗜伊红色,细胞核肥大,细胞质分布于细胞膜周围(Lightner et al,1983)。在2006年中国台湾地区报道的IHHNV感染幼年罗氏沼虾肝胰腺管状上皮细胞中,同时出现了Cowry A型和B型包涵体(Hsieh et al,2006)。本研究中感染IHHNV的成年罗氏沼虾肝胰腺和前肠组织切片中均未出现明显的病理变化,推测与马来西亚罗氏沼虾IHHNV感染情况相似( Hazreen Nita et al,2012),仅为IHHNV病毒的携带体,并未导致发病,是否有潜在的发病可能性尚不清楚。
4 结论本研究首次在中国大陆地区的罗氏沼虾中检测到IHHNV,同时流行病学检测发现IHHNV在我国的华东和华南地区的罗氏沼虾养殖区广泛分布,但病毒在成年罗氏沼虾内仅表现为携带者,并未表现出临床症状和病理变化,然而已有报道显示IHHNV可引起罗氏沼虾幼虾发病,所以应引起罗氏沼虾养殖的高度重视,以提前做好IHHNV的防控工作。
| 白丽蓉,赵志英,. 2012.对虾传染性皮下与造血组织坏死病毒(IHHNV)的研究进展.中国农学通报, 28(14):114-119 |
| 杨冰,宋晓玲,黄倢等,. 2005.对虾传染性皮下及造血组织坏死病毒(IHHNV)的流行病学与检测技术研究进展.中国水产科学, 12(4):519-524 |
| 林开,侯崇林,谢荣辉等,. 2013.三种对虾病毒在浙江省凡纳滨对虾中的流行性调查研究.水产科学, 32(3):161-164 |
| 施慧,谢建军,许文军等,. 2013.浙江地区凡纳滨对虾苗3种对虾病毒携带情况研究.浙江海洋学院学报(自然科学版), 32(1):25-30 |
| 袁颜颜,杨冰,万晓媛等,. 2015.采用OIE标准检测养殖对虾中传染性皮下及造血组织坏死病毒(IHHNV)的PCR检出类型.渔业科学进展, 36(1):67-73 |
| Bell T A, Lightner D V,. 1984. IHHN virus:infectivity and pathogenicity studies in Penaeus stylirostris and Penaeus vannamei. Aquaculture, 38(3):185-194 |
| Flegel T W,. 1997. Major viral diseases of the black tiger prawn(Penaeus monodon) in Thailand. World Journal of Microbiology and Biotechnology, 13(4):433-442 |
| Flegel T W,. 2012. Historic emergence, impact and current status of shrimp pathogens in Asia. Journal of Invertebrate Pathology, 110(2):166-173 |
| Hazreen Nita M K, Kua B C, Bhassu S et al,. 2012. Detection and genetic profiling of infectious hypodermal and haematopoietic necrosis virus(IHHNV) infections in wild berried freshwater prawn, Macrobrachium rosenbergii collected for hatchery production. Molecular Biology Reports, 39(4):3785-3790 |
| Hsieh C Y, Chuang P C, Chen L C et al,. 2006. Infectious hypodermal and haematopoietic necrosis virus(IHHNV) infections in giant freshwater prawn, Macrobrachium rosenbergii. Aquaculture, 258(1-4):73-79 |
| Kim J H, Kim H K, Nguyen V G et al,. 2012. Genomic sequence of infectious hypodermal and hematopoietic necrosis virus(IHHNV) KLV-2010-01 originating from the first Korean outbreak in cultured Litopenaeus vannamei. Archives of Virology, 157(2):369-373 |
| Krabsetsve K, Cullen B R, Owens L,. 2004. Rediscovery of the Australian strain of infectious hypodermal and haematopoietic necrosis virus. Diseases of Aquatic Organisms, 61(1-2):153-158 |
| Lightner D V,. 1996. Epizootiology, distribution and the impact on international trade of two penaeid shrimp viruses in the Americas. Revue Scientifique et Technique(International Office of Epizootics), 15(2):579-601 |
| Lightner D V,. 2011. Virus diseases of farmed shrimp in the Western Hemisphere(the Americas):a review. Journal of Invertebrate Pathology, 106(1):110-130 |
| Lightner D V, Redman R M, Bell T A,. 1983. Infectious hypodermal and hematopoietic necrosis, a newly recognized virus disease of penaeid shrimp. Journal of Invertebrate Pathology, 42(1):62-70 |
| Macías-Rodríguez N A, Mañón-Ríos N, Romero-Romero J L et al,. 2014. Prevalence of viral pathogens WSSV and IHHNV in wild organisms at the Pacific coast of Mexico. Journal of Invertebrate Pathology, 116:8-12 |
| Otta S K, Arulraj R, Praveena P E et al,. 2014. Association of dual viral infection with mortality of Pacific white shrimp(Litopenaeus vannamei) in culture ponds in India. Virus Disease, 25(1):63-68 |
| Rai P, Pradeep B, Karunasagar I et al,. 2009. Detection of viruses in Penaeus monodon from India showing signs of slow growth syndrome. Aquaculture, 289(3-4):231-235 |
| Rai P, Safeena M P, Krabsetsve K et al,. 2012. Genomics, molecular epidemiology and diagnostics of infectious hypodermal and hematopoietic necrosis virus. Indian Journal of Virology, 23(2):203-214 |
| Robles-Sikisaka R, Bohonak A J, McClenaghan Jr L R et al,. 2010. Genetic signature of rapid IHHNV(infectious hypodermal and hematopoietic necrosis virus) expansion in wild Penaeus shrimp populations. PLoS One, 5(7):e11799 |
| Rozas J, Sánchez-DelBarrio J C, Messeguer X et al,. 2003. DnaSP, DNA polymorphism analyses by the coalescent and other methods. Bioinformatics, 19(18):2496-2497 |
| Saksmerprome V, Puiprom O, Noonin C et al,. 2010. Detection of infectious hypodermal and haematopoietic necrosis virus(IHHNV) in farmed Australian Penaeus monodon by PCR analysis and DNA sequencing. Aquaculture, 298(3):190-193 |
| Silva D C D, Nunes A R D, Teixeira D I A et al,. 2014. Infectious hypodermal and hematopoietic necrosis virus from Brazil:Sequencing, comparative analysis and PCR detection. Virus Research, 189:136-146 |
| Tang K F J, Lightner D V,. 2002. Low sequence variation among isolates of infectious hypodermal and hematopoietic necrosis virus(IHHNV) originating from Hawaii and the Americas. Diseases of Aquatic Organisms, 49(2):93-97 |
| Tang K F J, Lightner D V,. 2006. Infectious hypodermal and hematopoietic necrosis virus(IHHNV)-related sequences in the genome of the black tiger prawn Penaeus monodon from Africa and Australia. Virus Research, 118(1-2):185-191 |
| Tang K F J, Poulos B T, Wang J et al,. 2003. Geographic variations among infectious hypodermal and hematopoietic necrosis virus(IHHNV) isolates and characteristics of their infection. Diseases of Aquatic Organisms, 53(2):91-99 |
| Tidwell J H, Coyle S, Van Arnum A et al,. 2000. Production response of freshwater prawns Macrobrachium rosenbergii to increasing amounts of artificial substrate in ponds. Journal of the World Aquaculture Society, 31(3):452-458 |
| Winton J R, Walker P J,. 2010. Emerging viral diseases of fish and shrimp. Veterinary Research, 41(6):51-75 |
| Zhang C, Yuan J F, Shi Z L,. 2007. Molecular epidemiological investigation of infectious hypodermal and hematopoietic necrosis virus and Taura syndrome virus in Penaeus vannamei cultured in China. Virologica Sinica, 22(5):380-388 |
| Zhang Y F, Ye C X, Wang A L et al,. 2015. Isolated and combined exposure to ammonia and nitrite in giant freshwater pawn(Macrobrachium rosenbergii):effects on the oxidative stress, antioxidant enzymatic activities and apoptosis in haemocytes. Ecotoxicology, 1-10 |
 2015, Vol. 46
2015, Vol. 46


