中国海洋湖沼学会主办。
文章信息
- 杨筱珍, 李彤, 李萌, 张佳鑫, 黄坚, 徐泽文, 何杰, 杨志刚, 王春, 成永旭. 2015.
- YANG Xiao-Zhen, LI Tong, LI Meng, ZHANG Jia-Xin, HUANG Jian, XU Ze-Wen, HE Jie, YANG Zhi-Gang, WANG Chun, CHENG Yong-Xu. 2015.
- 中华绒螯蟹(Eriocheir sinensis)肠道和肝胰腺5-羟色胺(5-HT)和5-羟色胺受体2(5-HTR2)的定位研究
- 5-HT AND 5-HTR2-LIKE IMMUNOREACTIVE CELLS IN INTESTINE AND HEPATOPANCREAS OF CHINESE MITTEN CRAB ERIOCHEIR SINENSIS
- 海洋与湖沼, 46(5): 1139-1145
- Oceanologia et Limnologia Sinica, 46(5): 1139-1145.
- http://dx.doi.org/10.11693/hyhz20150100029
-
文章历史
- 收稿日期: 2015-01-27
- 收修改稿日期: 2015-04-26
健康的消化道生理是动物正常生长繁殖的基础,因此,对此方面的基础研究被广泛重视。在甲壳动物中,此类研究多见对肝胰腺的研究,而少见对其肠道功能的研究(Nunesa et al,2014)。在PNAS杂志上发表的一篇论文曾提出蟹肠道中所含的激素与其蜕壳息息相关,同时,甲壳动物后肠与肠道收缩也密切相关(Chung et al,1999; Musolf et al,2009)。5-羟色胺(5-hydroxytryptamine,5-HT)是肠道中重要的神经递质。哺乳动物的5-HT 95%来源于肠道,主要是黏膜层的肠嗜铬细胞。此外,少数也来源于肠神经元。研究已证实,5-HT是胃肠道收缩和肠道免疫过程中的重要递质(Li et al,2011)。相似的消化道功能在水产动物消化道也已被发现,如在龙虾和鱼(Scophthalmus maximus)(Bermúdez et al,2007; Musolf et al,2009)。除此之外,分布于甲壳动物所有主要神经系统的5-HT,可刺激高血糖激素、色素分布激素、蜕壳抑制激素和性腺刺激激素的释放,进而调节着甲壳动物生长、性腺发育、体色变化和行为(王琼等,2006; Tangvuthipong et al,2006)。因此,近年来有关5-HT在甲壳动物生理过程中作用的研究倍受关注。2014年国际知名期刊“Science”就发表了5-HT对龙虾行为影响的研究成果(Fossat et al,2014)。已有研究表明,适量给予5-HT 能促进中华绒螯蟹(又称河蟹,Eriocheir sinensis)和罗氏沼虾(Macrobrachium rosenbergii)的生长,但其机理并不明晰(Tangvuthipong et al,2006; 梁攀等,2011)。5-HT在不同物种肠道中及同一个体不同肠段中的分布存在着明显差异,了解5-HT在消化道中的分布规律有助于阐明其在各种动物消化生理中的作用(黄辉洋等,2001; 林树根等,2005; 阚延胜,2007; He et al,2009; 陈洪洪等,2010)。
甲壳动物肝胰腺作为消化腺与肠道和性腺发育及功能密切相关,其内分布着雌激素受体、甲状腺素和5-HT等活性物质(杨丽丽等,2011; Yang et al,2012; Zara et al,2013; Iromo et al,2014)。Kuo等(2009)发现在5-HT促进罗氏沼虾卵黄合成的过程中,肝胰腺是提供卵黄蛋白原的主要来源,此外,肝胰腺中的胺氧化酶参与了5-HT的脱胺过程(Nicotra et al,1994)。本课题组通过免疫组化方法已弄清了日本新糠虾(Neomysis japonica)肝胰腺中5-HT的分布及其与性腺发育的关系和5-HT合成的关键酶色胺酸羟化酶(Tryptophan hydroxylase,TPH1)在中华绒螯蟹在肠道中的分布规律(杨丽丽等,2011; 李萌等,2014)。但目前有关5-HT在中华绒螯蟹肠道和肝胰腺中分布的研究尚未见有报道。
5-HT需要与其受体结合后才能发挥生理功能。现已证明,根据分子结构、作用机制及不同功能,5-HT受体家族包括7个成员(5-HT1-5-HT7),是神经递质受体中最复杂的家族之一(Li et al,2011)。其中六类是G-蛋白偶联受体(5-HT1,5-HT2,5-HT4,5-HT5,5-HT6,5-HT7),另外一类(5-HT3)是配体门控离子通道。现已发现5-HT2(5-HT受体2)参与了自闭症儿童的肠道应激综合征中的肠收缩异常过程,并介导着IP3激活Ca2+信号途径,其在哺乳动的疼痛行为及免疫过程中的作用(Hagberg et al,1998; Nishiyama,2005; Ahern,2011; Abdelrahman et al,2015)也已被发现。目前,有研究报道了5-HT受体2在龙虾神经肌肉接点的分布,并可调节着其后肠肠道的收缩过程(Tabor et al,2002; Musolf et al,2009),本课题组现已从中华绒螯蟹肠道成功克隆到5-HT受体2片段(徐泽文等,2015)。此外,甲壳动物肠道收缩直接与肠道排空时间有关,这也是饵料投喂频率理论依据(Smith et al,2009)。
中华绒螯蟹的肠道主要分为三个部分,它们分别为中肠、肠球和后肠,此三个部分均具有较为独特的组织结构(李萌等,2014)。本文利用免疫组织化学技术对5-HT和5-HT受体2在中华绒螯蟹肠道和肝胰腺进行定位,为进一步研究此类物质在甲壳动物消化生理中的作用奠定基础。
1 材料与方法 1.1 实验材料30只中华绒螯蟹,购自上海市崇明岛绿华中华绒螯蟹养殖基地,体重为(82.12±10.35)g,暂养7d,饥饿48h后取样。测量各个体体长,解剖并分离出肠道和肝胰腺,以肠球为界线将肠道分为中肠、肠球和后肠三个部分,分别测量中肠长度、后肠长度和肠道全长(从中肠前端至后肠末端的长度)。新鲜中肠、肠球、后肠和肝胰腺样品放入Bouin’s液中固定48h,并采集成年兔小肠作为阳性对照组织,梯度酒精脱水,石蜡包埋,常规切片厚度5—7µm,40°C烘片机烘干备用。
1.2 免疫组织化学将中肠、肠球、后肠和肝胰腺的石蜡切片经梯度酒精脱蜡至水,滴加3% H2O2,室温孵育20min,以灭活内源性过氧化物酶,PBS缓冲液(0.01mol/L,pH 7.2—7.6)冲洗5min×3次,枸橼酸盐缓冲液(pH 6.0)进行抗原热修复,水浴加热94°C,40min,PBS冲洗5min×3次,滴加5% BSA封闭非特异性抗原,室温孵育30min,倾去血清,滴加兔抗5-HT(北京中山金桥有限公司)或5-HT受体2抗体(武汉博士德公司)(工作浓度1︰50),4°C过夜。次日,PBS冲洗5min×3次,滴加二抗,37°C恒温箱孵育80min,PBS冲洗5min×3次,DAB显色,自来水冲洗,梯度酒精脱水,二甲苯透明,中性树脂封片。阳性对照片为成年兔子小肠切片。阴性对照用PBS代替一抗,其余步骤同上,Olympus-2显微镜观察拍照。
1.3 苏木精-伊红染色(H.E染色)石蜡切片经梯度酒精脱蜡至水,浸入苏木精染色25min,盐酸酒精分色10s,自来水流水冲洗30min进行返蓝,80%酒精5min,90%酒精5min,浸入伊红染色1min,经梯度酒精脱水,二甲苯透明,中性树脂封片,Olympus-2显微镜观察拍照。
1.4 数据分析用Spot软件(Scion Corporation,USA),对中华绒螯蟹每50×103 μm2中肠和后肠面积中5-HT和5- HT受体2的阳性免疫细胞数进行统计(n=4)。采用SPSSV11.5软件的Independent-sample T test进行统计学分析,实验结果用均数±标准差,P<0.05为差异显著。采用Kolmogorov-Smirnov法对将进行相关性分析的数据进行正态分布检验,当满足正态度分布时,采用Pearson法相关性检验进行相关性分析,最后在Excel上绘制相关图表。
2 结果 2.1 中华绒螯蟹肠道长与体长相关性分析对体长范围为(5.4±0.21)cm的成年中华绒螯蟹进行解剖后发现: 其肠道主要包括中肠、肠球和后肠,此三部分全长约为(5.7±0.53)cm。肠道的长度与体长度接近,略大于体长。对肠道长度与体长进行相关性分析后发现,肠道长与体长呈正相关,并有极显著相关性(P<0.01)(图 1)。中华绒螯蟹肠道解剖外观如图 2所示。开口于中肠前端向头端延伸,有一对前盲囊。开口肠球向尾延伸,有一根后盲囊。肠球位于中肠和后肠之间,呈膨大的球状,后肠开口于肠球下方直至肛门处。中肠和后肠长度见表 1。其中,后肠长度约为中肠的两倍,占全肠道比例为62%±4%,而中肠占全肠道的比例仅为29%±3.5%。
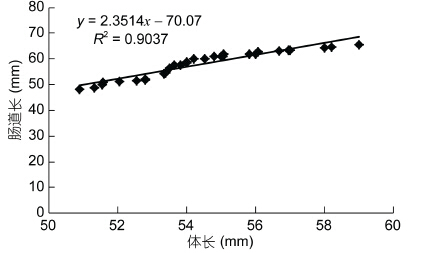 |
| 图 1 中华绒螯蟹肠道长与体长相关性分析 Fig. 1 The correlation of body length and intestine length of E. sinensis |
 |
| 图 2 中华绒螯蟹肠道组织解剖图 Fig. 2 The anatomy of intestine tissue structure of E. sinensis |
| 项目 | 中肠 | 后肠 |
| 长度(cm)( n=30) | 1.6±0.2 | 3.6±0.4 |
| 5-HT阳性细胞数(个/50×10 3 μm 2)( n=4) | 66.1±2.3 a | 61.1±1.1 a |
| 5-HT受体2阳性细胞数(个/50×10 3 μm 2)( n=4) | 70.0±1.2 a | 72.3±3.1 a |
| 同行中不同字母代表差异显著(P < 0.05) | ||
中华绒螯蟹的中肠、肠球和后肠组织结构有明显的差异(图 3a,b,c所示)。经免疫组化染色后发现5-HT和5-HT受体2在中华绒螯蟹中肠,肠球和后肠组织中均有分布,免疫阳性物质均呈棕褐色,两物质在中肠和后肠组织中的分布特点较为一致。在中肠,5-HT和5-HT受体2免疫阳性细胞主要分布黏膜上皮细胞间(图 3d和图 3g细箭头所示)和肌层与外膜交界处(图 3d和图 3g粗箭头所示),阳性细胞为胞核着色; 在肠球组织中,5-HT和5-HT受体2免疫活性细胞匀均分布在肠球外周发达结缔组织中,为胞核着色(图 3e和图 3h“*”号所示),在其内侧的中肠和后肠中,分布规律同其在中肠和后肠的分布; 在后肠,5-HT和5-HT受体2免疫阳性细胞主要分布在黏膜上皮细胞细胞间(图 3f和图 3i细箭头所示)和黏膜下层与肌层(图 3i小框内细箭头所示)及肌层与外膜交界处(图 3f和图 3i小框内粗箭头所示),均为胞核着染,在固有膜部分细胞胞核中也有分布(图 3i“*”号所示)。成年兔子小肠阳性对照片呈现明显的阳性反应,阳性细胞主要分布在黏膜上皮间(图 3j细箭头所示)和肌层间(图 3j和图 3k粗箭头所示),用PBS代替一抗均呈阴性反应(图 3l所示)。对中华绒螯蟹中肠和后肠内5-HT和5-HT受体2阳性细胞进行统计后发现两物质在中肠和后肠中的分布数量相似,均约为61—72个/50×103 μm2(表 1)。
 |
| 图 3 中华绒螯蟹肠道和肝胰腺5-羟色胺(5-HT)和5-羟色胺受体2(5-HTR2)的定位 Fig. 3 The location of 5-HT and 5-HTR2-like immunoreactive cells in intestine and hepatopancreas of E. sinensis a—c,m分别表示中华绒螯蟹中肠、肠球,后肠和肝胰腺的组织结构(H.E染色)。d和g分别表示5-HT和5-羟色胺受体2在中肠中的定位。细箭头表示分布于黏膜细胞间; 粗箭头表示分布于肌层与外膜交界处。e和h分别表示5-HT和5-羟色胺受体2在肠球中的定位。“*”号表示分布于肠球结缔组织中。f和i分别表示5-HT和5-羟色胺受体2在后肠中的定位。细箭头表示分布于黏膜细胞间; 粗箭头表示分布于肌层与外膜交界span>; 小框内显示分布于黏膜下层与肌层间(细箭头)和肌层与外膜交界处(粗箭头); “*”号表示分布于固有膜中。j显示5-HT在兔子小肠中的阳性对照。细箭头表示分布于黏膜细胞间; 粗箭头表示分布于肌层间。k显示5-羟色胺受体2在兔子小肠中的阳性对照。粗箭头表示分布于肌层间。l为中华绒螯蟹后肠阴性对 照。n和o分别显示5-HT和5-羟色胺受体2在肝胰腺中的定位 |
中华绒螯蟹肝胰腺主要由四种细胞组成,它们分别是胚细胞(E-cells,embryonic cells)、泡状细胞(B-cells,blisterlike cells)、吸收细胞(R-cells,resorptive cells)和纤维细胞(F-cells,fibrillar cells)(图 3m所示)。5-HT和5-HT受体2免疫阳性物质主要分布在这四类细胞的胞核,在F细胞的细胞质中也有阳性表达(图 3n和图 3o所示)。
3 讨论本研究发现,中华绒螯蟹肠道长与体长有明显的正相关,且与体长长度相近。这与许多动物肠道盘绕于体内,其长度远远大于体长完全不同。本课题组前期已对中华绒螯蟹的肠道组织结构进行了详尽的描述,并发现后肠与中肠有明显的组织结构区别,如黏膜表面有角质层,有明显的固有膜和肌层,有肠腺的分布等(李萌等,2014)。本研究发现中华绒螯蟹的后肠大部分位于中华绒螯蟹腹脐内更易于外环境接触,其占据了肠道的大部分,约占肠道比例为60%。现已有研究发现蟹肠道所含的高血糖激素与蜕壳密切相关,5-HT参与了后肠的收缩调节(Chung et al,1999; Musolf et al,2009)。McGaw等(2013)研究了食物的不同大小与动物个体的不同大小在甲壳动物不同肠道段的推进差别(McGaw et al,2013)。综上,我们认为对中华绒螯蟹消化生理的研究,有必要对肠道分段进行研究,此外,后肠生理功能的研究应更加重视。
已有研究表明,水体中适量的5-HT能够促进中华绒螯蟹仔蟹的生长,因此,Tangvuthipong等曾建议,将5-HT作为罗氏沼虾(Macrobrachium rosenbergii)幼体饲料添加成分,以促进其生长(Tangvuthipong et al,2006; 梁攀等,2011),而其作用机理尚不明晰。5-HT是调节胃肠运动的一种重要介质,在不同动物消化道组织中5-HT免疫活性细胞的分布情况差异较大,如在锯缘青蟹(Scylla serrata)主要分布于肠道的黏膜层和黏膜下层,中肠多于后肠; 而在中国对虾(Penaeus chinensis)和日本沼虾(Macrobrachium nipponense),主要分布于中肠和后肠的结缔组织中,且在中肠和后肠数量相近; 在大黄鱼(Pseudosciaena crocea)和罗非鱼(Tilapia mossamblca),主要分布在黏膜上皮间,少量分布于固有膜,在大黄鱼后肠较中肠多,而在罗非鱼中肠高于后肠; 在鲶鱼(Ictalurus punctatus),5-HT免疫活性细胞主要分布于肠道的黏膜上皮层和肌肉与外膜交界的肌肉层,且在中肠的数量高于后肠(黄辉洋等,2001; 林树根等,2005; 阚延胜,2007; He et al,2009; 陈洪洪等,2010)。本研究首次发现 5-HT活性细胞在中华绒螯蟹肠道中也有广泛分布,其在中肠和后肠的分布规律基本一致。5-HT阳性细胞主要分布在肠道的黏膜上皮层和外膜与肌层的交界处。这与在鲶鱼(Ictalurus punctatus)中的报道相似(He et al,2009)。中华绒螯蟹的中肠缺乏固有膜,这也是中华绒螯蟹肠道的一个特点,本研究发现在中华绒螯蟹后肠固有膜和黏膜下层与肌肉层的交界处中也有5-HT阳性细胞的分布,这与锯缘青蟹(Scylla serrata)5-HT免疫活性物质还分布于黏膜下层相同(黄辉洋等,2001)。但上述的文献资料中均未提及5-HT阳性细胞与肌细细胞毗邻的现象。5-HT参与了后肠肌细胞收缩,在龙虾中已有报道(Musolf et al,2009)。我们推测在肌肉层较发达的中华绒螯蟹后肠,5-HT和5-HT受体2分布于黏膜下层与肌层及肌层与外膜交界处,这样分布的现象可能与5-HT参与肠道收缩有关,本课题近期对中华绒螯蟹肠道铺片的研究也发现在中华绒螯蟹后肠黏膜下层中有大量内分泌细胞分布,通过电镜观察在固有膜和肌细胞间均有类似的内分泌细胞分布(结果待发表)。外源给予5-HT能促进甲壳动物生长是否与其能促进肠道收缩,进而促进摄食有关,还有待于进一步证实。本课题组先前也已证实5-HT生物合成中的关键酶TPH1在中华绒螯蟹中肠和肠球黏膜上皮细胞胞核和后肠黏膜上皮细胞浆中有分布(李萌等,2014)。综合上述研究,我们认为中华绒螯蟹肠道中有大量5-HT的分布,其分布位置主要在肠黏膜上皮层、肠固有膜、黏膜下层与肌肉层的交界处和外膜与肌层的交界处。
与鱼类的肝胰腺不同,中华绒螯蟹的肝胰腺主要由四种不同类型细胞组成,各类型细胞功能也不同,已有研究表明,肝胰腺的B/R细胞有进入肠道参与消化吸收的过程,我们在实际解剖的过程中也常看到肠腔内有类似于肝胰腺的组织出现(Smith et al,2009)。而F细胞能合成大量消化酶,胰蛋白酶、糖酶、酯酶等,还能储藏大量的钙,其在甲壳动物蜕皮和饥饿等生理过程中扮演着重要角色(Nunesa et al,2014)。除此之外,肝胰腺还参与了甲壳动物的性腺发育的调控,本课题组先前的研究已发现5-HT在日本新糠虾(Neomysis japonica)不同卵巢发育期肝胰腺各类型细胞胞核中的分布(杨丽丽等,2011; Zara et al,2013)。本研究也再次证明,肝胰腺各类型细胞的胞核是5-HT分布的主要部位。而F细胞或其它类型肝胰腺细胞在中华绒螯蟹消化道生理或免疫中的作用,还需要更深入的研究。
众所周知,5-HT功能的发挥,需要与其相应的受体结合。本研究发现5-HT和5-HT受体2在中华绒螯蟹肠道和肝胰腺组织中的分布规律一致,表明中华绒螯蟹消化道5-HT发挥生理功能可能与5-HT受体2有关。已有研究发现5-HT受体2参与了肠道平滑肌收缩的过程,并在颗粒细胞和巨噬细胞中有表达,而参与免疫过程(Ahern,2011; Abdelrahman et al,2015)。它与肠道的黏膜免疫密切相关。本课题组新近的研究已发现中华绒螯蟹肠道中有嗜酸性的肥大细胞分布(赵柳兰等,2014)。此外,中华绒螯蟹存在着肠道免疫过程,生物胺能够影响中华绒螯蟹的免疫功能,但有关5-HT在肠道免疫中的作用还有待于进一步探究(Zhao et al,2012)。
4 结论本文首次对中华绒螯蟹肠道与体长相关性进行分析,并统计了中肠和后肠肠段所占比例。为进一步分段研究肠道功能奠定理论基础。本研究发现在中华绒螯蟹中肠、肠球、后肠和肝胰腺中均有5-HT和5-HTR2的分布。结合前期研究已从肠道组织成功获得5-HTR2核心片段。我们认为5-HT参与了中华绒螯蟹肠道的生理过程。虽然,5-HT和5-HTR2在中肠和后肠中定位与数量基本相似,但由于后肠结构的差异和解剖位置(大部分位于腹脐部),我们还在后肠固有膜和发达肌层内和外侧有大量发现。因此,今后对中华绒螯蟹消化道功能研究中,应更加关注后肠的生理功能,如其在肠道收缩和免疫中的作用。有关中华绒螯蟹肠道收缩的研究在应用方面可以通过获得中华绒螯蟹肠道排空时间,进而指导中华绒螯蟹的科学投喂频率。
| 王琼,黄辉洋,叶海辉等,. 2006.日本囊对虾(Marsupenaeus japonicus)视神经节、脑和胸神经节5-羟色胺的定位研究.海洋与湖沼, 37(5):412-416 |
| 李萌,杨筱珍,成永旭等,. 2014.色氨酸羟化酶在中华绒螯蟹中肠、肠球和后肠组织中的分布和定位.上海海洋大学学报, 23(2):179-185 |
| 杨丽丽,杨筱珍,成永旭等,. 2011.日本新糠虾卵巢和肝胰腺主要细胞内5-HT的免疫组织化学定位.水产学报, 35(2):208-213 |
| 陈洪洪,朱联九,潘洪珍等,. 2010.中国对虾和日本沼虾胃肠道内分泌细胞的鉴别与比较.水生生物学报, 34(3):642-646 |
| 林树根,王全溪,王寿昆,. 2005.大黄鱼消化道内分泌细胞免疫组织化学的定位.福建农业学报, 20(4):238-242 |
| 赵柳兰,杨筱珍,成永旭等,. 2014.中华绒螯蟹肠道肥大细胞的组织化学研究.中国组织化学与细胞化学杂志, 23(4):303-307 |
| 徐泽文,杨筱珍,黄坚等,. 2015. CODEHOP法设计引物克隆中华绒螯蟹5-ht1和5-ht2受体基因片段及序列分析.生物学杂志, 32(1):1-5 |
| 黄辉洋,李少菁,王桂忠等,. 2001.锯缘青蟹消化系统5-羟色胺免疫组织化学的研究.厦门大学学报(自然科学版), 40(3):789-792 |
| 梁攀,杨筱珍,成永旭等,. 2011.水体中5-HT对仔蟹生长以及内源5-HT水平的影响.复旦学报(自然科学版), 50(5):640-644, 652 |
| 阚延胜,. 2007.罗非鱼消化道5-HT内分泌细胞的免疫组织化学研究.安徽农学通报, 13(17):27-28, 97 |
| Abdelrahman H M, Sherief L M, Alghobashy A A et al,. 2015. Association of 5-HT2A receptor gene polymorphisms with gastrointestinal disorders in Egyptian children with autistic disorder. Research in Developmental Disabilities, 36:485-490 |
| Ahern G P,. 2011. 5-HT and the immune system. Current Opinion in Pharmacology, 11(1):29-33 |
| Bermúdez R, Vigliano F, Quiroga M I et al,. 2007. Immunohistochemical study on the neuroendocrine system of the digestive tract of turbot, Scophthalmus maximus(L.), infected by Enteromyxum scophthalmi(Myxozoa). Fish & Shellfish Immunology, 22(3):252-263 |
| Chung J S, Dircksen H, Webster S G,. 1999. A remarkable, precisely timed release of hyperglycemic hormone from endocrine cells in the gut is associated with ecdysis in the crab Carcinus maenas, Proceedings of the National Academy of Sciences of the United States of America, 96(23):13103-13107 |
| Fossat P, Bacqué-Cazenave J, De Deurwaerdère P D et al,. 2014. Anxiety-like behavior in crayfish is controlled by serotonin. Science, 344(6189):1293-1297 |
| Hagberg G B, Blomstrand F, Nilsson M et al,. 1998. Stimulation of 5-HT2A receptors on astrocytes in primary culture opens voltage-independent Ca2+ channels. Neurochemistry International, 32(2):153-162 |
| He M, Wang K Y, Zhang Y,. 2009. Immunocytochemical identification and localization of diffuse neuroendocrine system(DNES) cells in gastrointestinal tract of channel Catfish(Ictalurus punctatus). Agricultural Sciences in China, 8(2):238-243 |
| Iromo H, Zairin M, Suprayudi M A et al,. 2014. Thyroxine distribution in the hemolymph, hepatopancreas, ovary, sponge, and larvae of female mud crabs(Scylla serrata) during ovarian maturation. Journal of Crustacean Biology, 34(6):760-763 Kuo C M, Chen Y N, Fan H F et al,. 2009. Enhancement of vitellogenin synthesis by serotonin in the giant freshwater prawn Macrobrachium rosenbergii(de Man). Zoological Studies, 48(5):597-606 |
| Li Z S, Chalazonitis A, Huang Y Y et al,. 2011. Essential roles of enteric neuronal serotonin in gastrointestinal motility and the development/survival of enteric dopaminergic neurons. The Journal of Neuroscience, 31(24):8998-9009 |
| McGaw I J, Curtis D L,. 2013. Effect of meal size and body size on specific dynamic action and gastric processing in decapod crustaceans. Comparative Biochemistry and Physiology, Part A:Molecular & Integrative Physiolgy, 166(3):414-425 |
| Musolf B E, Spitzer N, Antonsen B et al,. 2009. Serotonergic modulation of crayfish hindgut. Biological Bulletin, 217(1):50-64 |
| Nicotra A, Santangelo G, Senatori O,. 1994. Serotonin and β-phenylethylamine deamination by semicarbazide-sensitive amine oxidase from Callista chione hepatopancreas. Comparative Biochemistry and Physiology Part C:Pharmacology, Toxicology and Endocrinology, 107(1):143-147 |
| Nishiyama T,. 2005. Effects of a 5-HT2A receptor antagonist, sarpogrelate on thermal or inflammatory pain. European Journal of Pharmacology, 516(1):18-22 |
| Nunesa E T, Bragaa A A, Camargo-Mathias M I,. 2014. Histochemical study of the hepatopancreas in adult females of the pink-shrimp Farfantepenaeus brasiliensis Latreille,. 1817. Acta Histochemica, 116(1):243-251 |
| Smith G G, Hall M W, Salmon M,. 2009. Use of microspheres, fresh and microbound diets to ascertain dietary path, component size, and digestive gland functioning in phyllosoma of the spiny lobster Panulirus ornatus. New Zealand Journal of Marine and Freshwater Research, 43(1):205-215 |
| Tabor J N, Cooper R L,. 2002. Physiologically identified 5-HT2-like receptors at the crayfish neuromuscular junction. Brain Research, 932(1-2):91-98 |
| Tangvuthipong P, Damrongphol P,. 2006. 5-Hydroxytryptamine enhances larval development of the giant freshwater prawn, Macrobrachium rosenbergii. Aquaculture, 252(2-4):567-572 |
| Yang X Z, Zhao L L, Cheng Y X et al,. 2012. Immunolocalization of estrogen receptor α in Neomysis japonica oocytes and follicle cells during ovarian development. Tissue and Cell, 44(2):95-100 |
| Zara F J, Gaeta H H, Costa T M et al,. 2013. The ovarian cycle histochemistry and its relationship with hepatopancreas weight in the blue crab Callinectes danae(Crustacea:Portunidae). Acta Zoologica, 94(2):134-146 |
| Zhao L L, Yang X Z, Cheng Y X et al,. 2012. Effects of histamine on survival and immune parameters of the Chinese mitten crab, Eriocheir sinensis. Journal of Shellfish Research, 31(3):827-834" |
 2015, Vol. 46
2015, Vol. 46


