中国海洋湖沼学会主办。
文章信息
- 王重彬, 邹同雷, 孙雪, 汪芳俊, 徐年军. 2015.
- WANG Chong-Bin, ZOU Tong-Lei, SUN Xue, WANG Fang-Jun, XU Nian-Jun. 2015.
- 水杨酸和茉莉酸甲酯对高温龙须菜(Gracilariopsis lemaneiformis)理化及基因表达的影响
- EFFECTS OF SALICYLIC ACID AND METHYL JASMONATE ON PHYSICOCHEMICAL PROPERTY AND GENE EXPRESSION OF GRACILARIOPSIS LEMANEIFORMIS UNDER HEAT STRESS
- 海洋与湖沼, 46(5): 1132-1138
- Oceanologia et Limnologia Sinica, 46(5): 1132-1138.
- http://dx.doi.org/10.11693/hyhz20150300081
-
文章历史
- 收稿日期: 2015-03-18
- 收修改稿日期: 2015-06-23
2. 浙江省海洋生物工程重点实验室 宁波 315211
2. Key Laboratory of Marine Biotechnology of Zhejiang Province, Ningbo 315211, China
龙须菜(Gracilariopsis lemaneiformis)为红藻门(Rhodophyta)的一种大型经济海藻,主要用于琼胶提取和鲍鱼养殖,少量用于食用及食品加工。此外,龙须菜还具有净化海洋环境、防止海水富营养化的生态作用(Zou et al,2014)。野生龙须菜原产于山东,后来培育出981抗高温优良品种(张学成等,2009),现在广东、福建、浙江等海域都有龙须菜养殖。但是我国南方夏季水温较高,使得龙须菜的养殖时间有所减少,影响了其产量。
水杨酸(salicylic acid,SA)又名2-羟基苯甲酸,是植物体内的一种酚类植物激素,对植物的生长发育具有重要的调控作用。近年来研究表明水杨酸还可以提高植物抗病虫害等生物胁迫,以及抗重金属、抗盐、抗高低温等非生物胁迫能力(Hayat et al,2010)。高温逆境不仅可以引起植物细胞膜损伤和代谢的变化,而且还可以产生氧化压力。水杨酸可以通过降低热胁迫引起的植物细胞膜损伤,增加蛋白和脯氨酸含量,以及增强过氧化物酶(POX)和抗坏血酸过氧化物酶(APOX)等抗氧化酶活性来对抗热胁迫(Chakraborty et al,2005)。水杨酸还可以通过减轻热诱导的净光合速率的降低来保护高温影响的光合作用(Wang et al,2010)。最近研究表明SA诱导的玉米幼苗的耐热性可以被H2S供体所增强,推测H2S可能是SA诱导耐热性中一种新的下游信号分子(Li et al,2015)。
茉莉酸类物质(jasmonates,JAs)是一种脂肪酸类的植物激素,包括茉莉酸(jasmonic acid,JA)和茉莉酸甲酯(methyl jasmonate,MeJA或MJ)等衍生物。茉莉酸类物质在植物体内普遍存在,可作为内源信号分子来调节植物的生长发育,也可调控植物对各种环境胁迫的响应(Wasternack et al,2002)。在植物抗高温逆境方面,茉莉酸类物质相比水杨酸的报道要少。据报道在诱导蝴蝶兰幼苗耐热性方面,茉莉酸甲酯的作用要强于水杨酸(杨华庚等,2011)。而茉莉酸与水杨酸代谢途径相互协调是增强植物基础耐热性所需要的(Clarke et al,2009)。水杨酸和茉莉酸类物质在提高植物抗逆性方面具有相同或相似的作用,但两者之间的相互作用关系比较复杂。如在调控一些基因表达方面,SA和MeJA存在着单向的、相互对立的和相互协同的3种不同作用方式(Salzman et al,2005)。因此这两种植物激素在信号通路间的相互作用一直是研究的热点。
本文主要从生理生化和基因转录表达两个方面来分析水杨酸和茉莉酸甲酯单独和组合使用对高温胁迫下龙须菜的影响,以探讨两者在龙须菜中抗高温胁迫的作用关系和作用机理,为龙须菜在夏季高温条件下的海区养殖提供参考。
1 材料与方法 1.1 实验材料实验材料为龙须菜981品种,采自浙江温州,实验室23°C暂养1个月。实验时选择生长状态良好的藻体,在33°C的光照培养箱中培养,光强2000—3000 lx,光暗周期L:D(12h:12h),使用Provasoli培养基(Provasoli,1968)。
1.2 实验方法 1.2.1 激素浓度设置水杨酸浓度梯度分别设置为0、50、100、150和200μmol/L,茉莉酸甲酯(下文中将其简写为MJ)浓度组分别为0、25、50、100和150μmol/L,SA/MJ组合使用浓度分别为0、50/25、50/50、100/25和100/50μmol/L。每组3个平行。
1.2.2 龙须菜相对生长速率测定称取500mg龙须菜藻体置于光照培养箱中培养,按照1.2.1中设置的SA、MJ和SA/MJ各5个浓度分别培养,3天后称量藻体吸干水分后的鲜重。按照以下公式计算藻体日相对生长速率: RGR(%/d)= 100% ×(lnWt-lnW0)/t,其中Wt为t时间的鲜质量(简记为FW),W0为开始时的鲜质量,t为实验天数(Abreu et al,2009)。
1.2.3 脯氨酸和丙二醛(MDA)含量测定取1.2.2中对龙须菜生长促进作用最大的3个激素浓度组: SA100(100μmol/L SA)、MJ50(50μmol/L MJ)和SA50/ MJ25(50μmol/L SA + 25μmol/L MJ)进行后续实验,以下相同。脯氨酸含量测定采用磺基水杨酸法,通过标准曲线计算脯氨酸含量(李合生,2000)。MDA含量测定使用硫酸巴比妥法,利用公式CMDA=6.54(A532- A600)-0.56A450计算MDA含量(李合生,2000)。
1.2.4 超氧化物歧化酶(SOD)活性测定使用SOD试剂盒(A001-1,南京建成生物工程研究所)进行SOD活性测定。
1.2.5 碳酸酐酶(CA)活性测定采用pH计法(Moskvin et al,1998),稍有改进。CA活性(WA)计算公式为: WA =(T0/T-1)×10,其中T0和T分别为反应体系中未加和加入藻提取液时pH值下降一个单位所需的时间。
1.2.6 硝酸还原酶(NR)活性测定使用硝酸还原酶试剂盒(IY1-2,苏州科铭生物技术有限公司)进行NR活性测定。记录540nm处的最大吸收峰,再通过标准曲线来计算NR活性。
1.2.7 四条基因的转录表达分析以18S rDNA做内参,热休克蛋白70(HSP70)基因与18S rDNA 的荧光定量PCR引物参考朱招波等(2012),锰超氧化物歧化酶(MnSOD)基因引物序列参考Lu等(2012)。根据已测龙须菜转录组中碳酸酐酶(CA)和硝酸还原酶(NR)序列信息,利用Primer Premier 5.0软件设计CA和NR荧光定量PCR引物,其中CA基因上游引物为5¢-AAGTCTCAAATGTCGCTCGCAA-3¢,下游引物为5¢-TCGGGGAGTGGAAGTGAA CATT-3¢; NR基因上游引物为5¢-AGCCACGGGACTTTCACTGTTA-3¢; 下游引物为5¢-AAGTCTCAAATGTCGCTCGCAA-3'。引物合成和测序均由英潍捷基(上海)贸易有限公司完成。
在激素添加6h后分别提取各组样品的总RNA,反转录成cDNA用做荧光定量PCR的模板。反应体系为2×SYBR Premix Ex Taq 10μL,cDNA 2.0μL,正向和反向引物各0.5μL,RNase-free H2O 7μL。PCR循环参数为: 95°C 2min; 95°C 10s,58°C 15s,72°C 20s; 40个循环。反应结束后进行CT值分析,采用2−ΔΔCT法确定各基因的相对表达量(Livak et al,2001)。
1.2.8 数据处理利用Excel 2007进行作图与数据统计,使用SPSS13.0单因素方差分析进行差异显著性分析,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析 2.1 水杨酸和茉莉酸甲酯对龙须菜生长的影响3组植物激素处理对龙须菜生长的作用不同(图 1)。从图 1A中可见,不同浓度SA添加后龙须菜相对生长速率不同程度升高,但方差分析显示仅100μmol/LSA组与对照组差异显著。100μmol/LSA处理3天后藻的相对生长速率为3.19%,是对照组的1.78倍(P<0.05)。而50、150和200μmol/LSA组与对照组之间,以及4个不同SA浓度处理组之间差异均不显著。
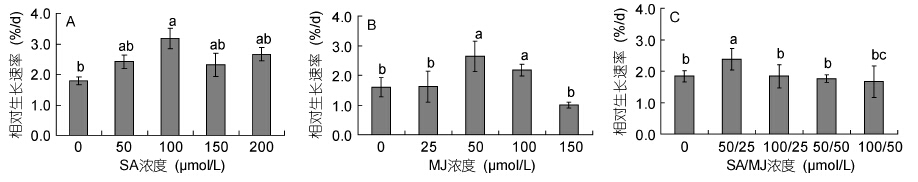 |
| 图 1 水杨酸和茉莉酸甲酯对龙须菜相对生长速率的影响 Fig.1Effects of salicylic acid and methyl jasmonate on the relative growth rate of G. lemaneiformis(mean±SD) 图中的 a、b、c 等字母表示差异显著。下同 |
50和100μmol/L MJ显著促进了龙须菜的生长(图 1B)。其中50μmol/L MJ对藻生长的促进作用最大,其相对生长速率达到2.65%,为对照组的1.65倍; 100μmol/L MJ组藻的相对生长速率为对照组的1.36倍,而25和150μmol/LMJ组与对照组差异不显著。
水杨酸/茉莉酸甲酯组合使用后龙须菜生长状况如图 1C所示。其中,SA/MJ浓度为50/25µmol/L时促进了龙须菜的生长,其相对生长速率最高(2.37%),是对照组的1.29倍(P<0.05)。而其它3个SA/MJ处理组与对照组无显著差异。
2.2 水杨酸和茉莉酸甲酯对龙须菜脯氨酸含量的影响4组龙须菜中脯氨酸含量随时间增加基本呈现先升后降再上升的趋势(图 2)。第3天,除MJ50组外,其它3组脯氨酸含量稍有下降。在第5天,MJ50和SA50/MJ25组的脯氨酸含量达到最高,两组分别比对照组增加了1.22和1.25倍(P<0.05); 在第6天,SA50/MJ25组的脯氨酸含量达到最高,为110.99μg/g,比对照组增加了1.85倍(P<0.05)。总体来看,不同时间处理组中前3天SA100组中藻的脯氨酸含量最高,而后3天SA50/MJ25组脯氨酸含量最高。
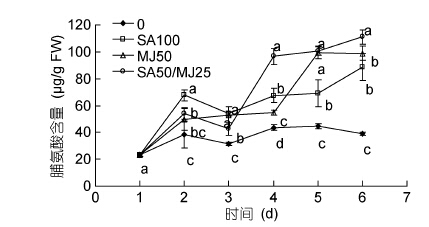 |
| 图 2 水杨酸和茉莉酸甲酯对龙须菜脯氨酸含量的影响 Fig.2 Effects of salicylic acid and methyl jasmonate on the proline content of G. lemaneiformis(mean±SD) |
添加激素的3组龙须菜中MDA含量均低于对照组,且3个处理组与对照组MDA含量变化趋势类似,大致呈现升—降—升的趋势(图 3)。SA100组的MDA含量从第3天到第6天与对照组无显著差异。MJ50组的MDA含量在第2天到第4天显著低于对照组(P<0.05),在第6天达到最高值(0.064μmol/g),与对照组无显著差异。SA50/MJ25组中MDA含量从第2天到第5天均低于对照组(P<0.05),在第5天达到最低值,为对照组的53.4%。可见,3个添加激素组对MDA含量的影响以SA50/MJ25组最大。
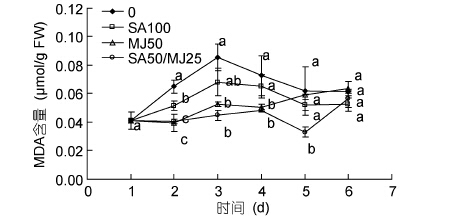 |
| 图 3 水杨酸和茉莉酸甲酯对龙须菜MDA含量的影响 Fig.3 Effects of salicylic acid and methyl jasmonate on the MDA content of G. lemaneiformis(mean±SD) |
龙须菜SOD活性随时间变化大致呈现先略上升后又下降的趋势(图 4)。各组藻的SOD活性在第12h最高,但只有SA100组藻的SOD活性与其它3组差异显著(P<0.05),而MJ50和SA50/MJ25组与对照组无显著差异。在第24h,SA100、MJ50和SA50/MJ25组的SOD活性分别为对照组的119.95%、113.95%和116.90%,与对照组差异均显著。可见,SA100对SOD活性影响最大。
 |
| 图 4 水杨酸和茉莉酸甲酯对龙须菜SOD活性的影响 Fig.4 Effects of salicylic acid and methyl jasmonate on the SOD activity of G. lemaneiformis(mean±SD)/span> |
对照组与3个添加激素组龙须菜的CA活性均随时间增加而升高(如图 5)。在第24h,3个处理组略高于对照组,但与对照组间无显著差异。在第48h,各组藻中CA活性明显升高,对照组、SA100、MJ50、SA50/MJ25组的CA活性分别是各自起始值的2.78倍、3.34倍、2.95倍和3.12倍; 但在48h,仅SA100组藻的CA活性比对照组高19.8%,差异显著(P<0.05),其它两个激素处理组藻的CA活性与对照组差异不显著。
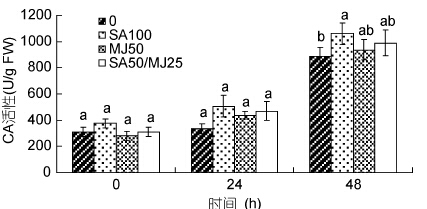 |
| 图 5 水杨酸和茉莉酸甲酯对龙须菜CA活性的影响 Fig. 5 Effects of salicylic acid and methyl jasmonate on CA activity of G. lemaneiformis(mean±SD) |
4组龙须菜中NR活性均随培养时间延长而降低(图 6),这与该酶是诱导酶有关。在第24h,对照组、SA100、MJ50和SA50/MJ25组的NR活性分别降为各自0h酶活性的61.16%、59.72%、56.44%和59.04%; 但4组之间无显著差异。在第48h,各组藻的NR活性继续下降,但与24h相差不大; 并且仅MJ50组藻的NR活性高于对照组,是对照组的1.12倍(P<0.05),其它两个激素处理组与对照差异不显著。
 |
| 图 6 水杨酸和茉莉酸甲酯对龙须菜NR活性的影响 Fig. 6 Effects of salicylic acid and methyl jasmonate on NR activity of G. lemaneiformis(mean±SD) |
3种激素处理6h后龙须菜 HSP70基因表达变化如图 7A所示。SA100、MJ50和SA50/MJ25组藻中HSP70基因表达量分别为对照组的2.04倍、0.81倍和1.54倍。该结果表明SA100和SA50/MJ25都能够促进HSP70基因的表达,其中SA100的促进作用要大于SA50/MJ25,而MJ50组对HSP70基因表达无影响(P>0.05)。
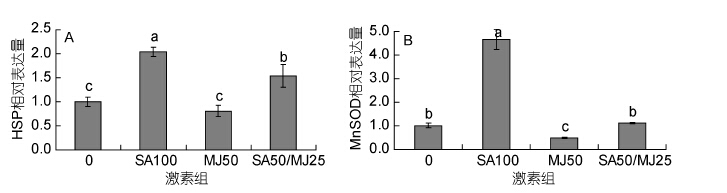 |
| 图 7 水杨酸和茉莉酸甲酯对HSP70和MnSOD基因表达的影响 Fig. 7 Effects of salicylic acid and methyl jasmonate on the expression of HSP70 and MnSOD genes of G. lemaneiformis(mean±SD) |
图 7B所示。SA100、MJ50、SA50/MJ25处理组MnSOD表达量分别为对照组的4.65倍、0.47倍、1.11倍。统计学分析表明SA100组与对照组差异极显著,MJ50组与对照组之间差异显著,而SA50/MJ25组与对照组之间差异不显著。因此,SA100极大地促进了龙须菜MnSOD基因的表达,MJ50抑制了MnSOD基因的表达,而SA50/MJ25对MnSOD基因表达无影响。
2.8 水杨酸和茉莉酸甲酯对CA和NR基因表达的影响3种激素处理6h后龙须菜CA基因表达变化如图 8A所示。SA100、MJ50、SA50/MJ25组中CA表达量分别为对照组的2.15倍、0.50倍、0.61倍。方差分析显示3个处理组与对照组之间差异均显著。该结果表明在高温胁迫下SA100能够促进CA基因的表达,而MJ50与SA50/MJ25抑制了CA基因的表达。
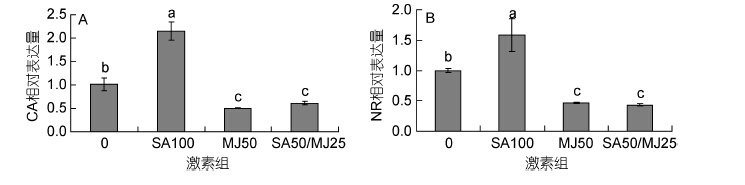 |
| 图 8 水杨酸和茉莉酸甲酯对CA和NR基因表达的影响 Fig. 8 Effects of salicylic acid and methyl jasmonate on the expression of CA and NR genes of G. lemaneiformis(mean±SD) |
3种激素处理6h后龙须菜NR基因表达变化如图 8B所示。SA100、MJ50、SA50/MJ25组中NR表达量分别为对照组的1.58倍、0.46倍、0.43倍,且3个处理组与对照组之间差异显著,而MJ50组与SA50/ MJ25组之间无显著差异。该结果表明在高温胁迫下SA100能够促进NR基因的表达,而MJ50与SA50/ MJ25则抑制了NR基因的表达。三个激素处理组对该藻NR基因表达的影响与其对CA基因表达的影响类似。
3 讨论 3.1 两种植物激素对植物生长的影响水杨酸和茉莉酸类物质作为新型植物激素,在调节植物生长发育和抗逆性中发挥了重要作用。如SA的施加可以正向调控盐度和硼引起的胡萝卜储藏根干重和胡萝卜素含量的降低(Eraslan et al,2007)。激素对植物生长的作用具有浓度依赖性,如10-5mol/L SA对芥菜的作用要优于对照及10-3和10-4mol/L SA(Fariduddin et al,2003)。本实验中100mmol/L SA对龙须菜生长的促进作用最大,与朱招波等(2012)报道的促进龙须菜中最大相对生长速率的10mg/mL水杨酸浓度较接近。本文结果表明SA和MJ单独及组合使用都可以促进高温胁迫龙须菜的生长,三者的最适作用浓度分别是100μmol/L、50μmol/L和50/25μmol/L,在最适作用浓度下龙须菜的相对生长速率比对照组分别提高了0.78、0.65和0.29倍。可见SA和MJ可以促进龙须菜在高温培养条件中的生长,并且作用强弱依次为SA100>MJ50>SA50/ MJ25。
3.2 两种植物激素对植物渗透调节物质、抗氧化物质及抗氧化酶的影响脯氨酸是植物细胞内的一种渗透调节物质,在植物抗热、抗干旱和抗高盐等逆境胁迫中发挥了重要作用。SA能够提高热驯化鹰嘴豆中脯氨酸含量,增强其抗热能力(Chakraborty et al,2005)。据朱招波等(2012)报道,10.0µg/mL SA处理第3天,龙须菜中的脯氨酸含量比对照组增加26%。而本研究结果表明3种激素处理均可以提高龙须菜的脯氨酸含量,在第5和6天脯氨酸含量最高,其中MJ50和SA50/MJ25组的影响要大于SA100组。
丙二醛是细胞膜被破坏后的代谢产物,其含量高低可以反映植物细胞膜的损坏程度。杨华庚等(2011)报道SA、MJ和钙均可以降低高温胁迫下蝴蝶兰幼苗的MDA含量。朱招波等(2012)发现10.0µg/mL SA处理MDA含量比对照低10%。但未见两种激素联合作用对藻类MDA含量影响的报道。本实验中各组藻的MDA含量随时间增加呈现先升后降的趋势,说明高温胁迫已对龙须菜细胞膜造成不利影响。3种处理中以SA50/MJ25对MDA含量降低的作用最大,而SA100对MDA含量无影响。
超氧化物歧化酶(SOD)是一种重要的抗氧化酶,可以清除生物体内过多的氧自由基。外源水杨酸和茉莉酸甲酯能够提高植物SOD酶活性(Wang et al,2006; 杨华庚等,2011)。本实验结果也表明在龙须菜高温胁迫中,SA100可以增强SOD活性。
3.3 植物激素对两种碳氮代谢酶的影响CA为含锌离子的金属酶,能够催化CO2和HCO3-相互转化,参与离子交换、生物合成、呼吸作用等多种生物功能(Smith et al,2000)。研究表明CA活性受植物激素的调节,如油菜素甾醇、赤霉素、生长素、细胞分裂素和脱落酸处理后,芥菜中CA活性出现先升后降的趋势(Hayat et al,2001)。但是10mmol/L茉莉酸甲酯对豌豆幼苗CA活性的影响不显著(Lazova et al,1999)。在本研究中,仅SA100组在处理48h时藻的CA活性升高。
NR是植物硝酸盐代谢的关键酶,可以催化NO3-还原为NO2-的反应。SA可以显著提高芥菜NR活性(Fariduddin et al,2003); SA处理可以提高干旱所引起的番茄中CA和NR活性的降低(Hayat et al,2008)。本实验中仅MJ50组在处理48h时有微弱的升高NR活性的作用,而其它两组处理对NR活性无影响。
3.4 植物激素对相关基因表达的影响HSP70家族作为一种分子伴侣,与植物的正常生理代谢或胁迫响应相关,是抗高温胁迫研究中的一种重要指标。本实验中SA100和SA50/MJ25处理6h后HSP70表达量升高,但MJ50对HSP70表达量无影响。该结果与朱招波等(2012)用的10μg/mL水杨酸处理24h时HSP70表达量下降的报道不同,这可能与高温处理时间不同等因素有关。
MnSOD是SOD酶中含有锰的一种抗氧化酶,该酶在植物的抗氧化研究中报道较多。龙须菜中MnSOD在32°C高温胁迫中表达量升高(Lu et al,2012)。SA能够促进浒苔中MnSOD基因的表达,且在一定范围内SA浓度与MnSOD表达量成正比(范美华等,2014)。本实验中SA100极大地促进了MnSOD基因的表达,而MJ50抑制了MnSOD基因的表达,SA50/ MJ25对MnSOD基因表达无影响。
蛋白核小球藻中CA活性和基因表达受盐度和无机碳浓度等环境因子的影响(王玮蔚等,2014),但植物激素对CA基因表达影响的报道很少。本实验中SA100处理能够促进CA基因表达,MJ50和SA50/ MJ25则抑制CA基因表达。其中SA100对CA基因表达的影响与其对CA活性影响结果一致,即SA100可以增强CA蛋白与转录水平的表达。
NR基因表达及其酶活性受硝酸盐、光照、谷氨酰胺等多种非生物胁迫因子的诱导和调控(Hoff et al,1994)。此外,NLPs、LBD和HY5等转录因子在调控拟南芥NR基因表达中也发挥了重要作用(Yanagisawa,2014)。两种植物激素细胞分裂素和脱落酸在调控NR mRNA水平中起到相互拮抗的作用(Hoff et al,1994)。本研究表明SA100能够促进NR基因表达,MJ50与SA50/MJ25则抑制NR基因表达。相比对NR基因表达的影响,3种激素处理对NR活性的影响不大。
4 结语水杨酸和茉莉酸甲酯是具有明确抗逆作用的植物激素。本文在低等藻类植物龙须菜中的研究再次证明了两者均有促进高温胁迫龙须菜生长的作用。此外,SA和MJ单独或组合使用还可以增强渗透调节物质脯氨酸含量,降低膜损伤代谢物MDA含量,以及增强抗氧化酶SOD活性。而对于碳氮代谢酶,不同激素处理组对于CA活性的增强作用较强,而对NR活性影响不大。再结合3个处理组对4种基因表达的影响,可以推断两种植物激素单独或组合使用均有提高龙须菜抗高温的能力,其中SA100效果最显著,MJ50效果较弱,而SA50和MJ25组合使用效果介于两者之间。
| 王玮蔚,孙雪,王冬梅等,. 2014.盐度和无机碳对蛋白核小球藻生长、胞外碳酸酐酶活性及其基因表达的影响.水产学报, 38(7):920-928 |
| 朱招波,孙雪,徐年军等,. 2012.水杨酸对龙须菜抗高温生理的影响.水产学报, 36(8):1304-1312 |
| 李合生,. 2000.植物生理生化实验原理和技术.北京:高等教育出版社, 258-260 |
| 杨华庚,颜速亮,陈慧娟等,. 2011.高温胁迫下外源茉莉酸甲酯、钙和水杨酸对蝴蝶兰幼苗耐热性的影响.中国农学通报, 27(28):150-157 |
| 张学成,费修绠,王广策等,. 2009.江蓠属海藻龙须菜的基础研究与大规模栽培.中国海洋大学学报, 39(5):947-954 |
| 范美华,孙雪,王日昕等,. 2014.浒苔中MnSOD和CAT基因克隆和表达分析.水产学报, 38(12):1976-1984 |
| Abreu M H, Varela D A, Henríquez L et al,. 2009. Traditional vs. integrated multi-trophic aquaculture of Gracilaria chilensis C. J. Bird, J. McLachlan & E. C. Oliveira:productivity and physiological performance. Aquaculture, 293(3-4):211-220 |
| Chakraborty U, Tongden C,. 2005. Evaluation of heat acclimation and salicylic acid treatments as potent inducers of thermotolerance in Cicer arietinum L. Curr Sci, 89(2):384-389 |
| Clarke S M, Cristescu S M, Miersch O et al,. 2009. Jasmonates act with salicylic acid to confer basal thermotolerance in Arabidopsis thaliana. New Phytol, 182(1):175-187 |
| Eraslan F, Inal A, Gunes A et al,. 2007. Impact of exogenous salicylic acid on the growth, antioxidant activity and physiology of carrot plants subjected to combined salinity and boron toxicity. Scientia Hort, 113(2):120-128 |
| Fariduddin Q, Hayat S, Ahmad A,. 2003. Salicylic acid influences net photosynthetic rate, carboxylation efficiency, nitrate reductase activity, and seed yield in Brassica juncea. Photosynthetica, 41(2):281-284 |
| Hayat Q, Hayat S, Irfan M et al,. 2010. Effect of exogenous salicylic acid under changing environment:A review. Environ Exp Bot, 68(1):14-25 |
| Hayat S, Ahmad A, Mobin M et al,. 2001. Carbonic anhydrase, photosynthesis, and seed yield in mustard plants treated with phytohormones. Photosynthetica, 39(1):111-114 |
| Hayat S, Hasan S A, Fariduddin Q et al,. 2008. Growth of tomato(Lycopersicon esculentum) in response to salicylic acid under water stress. J Plant Int, 3(4):297-304 |
| Hoff T, Truong H-N, Caboche M,. 1994. The use of mutants and transgenic plants to study nitrate assimilation. Plant, Cell & Environmnet, 17(5):489-506 |
| Lazova G N, Kicheva M I, Popova L P,. 1999. The effect of abscisic acid and methyl jasmonate on carbonic anhydrase activity in pea. Photosynthetica, 36(4):631-634 |
| Li Z G, Xie L R, Li X J,. 2015. Hydrogen sulfide acts as a downstream signal molecule in salicylic acid-induced heat tolerance in maize(Zea mays L.) seedlings. J Plant Physiol, 177(1):121-127 |
| Livak K J, Schmittgen T D,. 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method. Methods, 25(4):402-408 |
| Lu N, Zang X N, Zhang X C et al,. 2012. Gene cloning, expression and activity analysis of manganese superoxide dismutase from two strains of Gracilaria lemaneiformis(Gracilariaceae, Rhodophyta) under heat stress. Molecules, 17(4):4522-4532 |
| Moskvin Q V, Razguliayeva A Y, Shutova TV et al,. 1998. Carbonic anhydrase activity of different photosystem II preparations. In:Garab G ed. Photosynthesis:mechanisms and effects. The Netherlands:Kluwer Academic Publishers,. 1201-1204 |
| Provasoli L,. 1968. Media and prospects for the cultivation of marine algae. In:Watarnable A and Hattori R(eds) Culture and collection of algae. Proceedings of the US-Japan Conference, Hakone:Japan Soc Plant Physiol, 63-75 |
| Salzman R A, Brady J A, Finlayson S A et al,. 2005. Transcriptional profiling of Sorghum induced by methyl jasmonate, salicylic acid, and aminocyclopropane carboxylic acid reveals cooperative regulation and novel gene responses. Plant Physiol, 138(1):352-368 |
| Smith K S, Ferry J G,. 2000. Prokaryotic carbonic anhydrases. FEMS Microbiol Rev, 24(4):335-366 |
| Wang L J, Fan L, Loescher W et al,. 2010. Salicylic acid alleviates decreases in photosynthesis under heat stress and accelerates recovery in grapevine leaves. BMC Plant Biol, 10:34 |
| Wang L J, Li S H,. 2006. Salicylic acid-induced heat or cold tolerance in relation to Ca2+ homeostasis and antioxidant systems in young grape plants. Plant Sci, 170(4):685-694 |
| Wasternack C, Hause B,. 2002. Jasmonates and octadecanoids:Signals in plant stress responses and development. Prog Nucleic Acid Res Mol Biol, 72:165-221 |
| Yanagisawa S,. 2014. Transcription factors involved in controlling the expression of nitrate reductase genes in higher plants. Plant Sci, 229:167-171 |
| Zou D H, Gao K S,. 2014. Temperature response of photosynthetic light-and carbon-use characteristics in the red seaweed Gracilariopsis lemaneiformis(Gracilariales, Rhodophyta). J Phycol, 50(2):366-375 |
 2015, Vol. 46
2015, Vol. 46


