中国海洋湖沼学会主办。
文章信息
- 郑利兵, 吴彪, 刘志鸿, 周丽青, 孙秀俊, 田吉腾, 杨爱国, 郑言鑫. 2015.
- ZHENG Li-Bing, WU Biao, LIU Zhi-Hong, ZHOU Li-Qing, SUN Xiu-Jun, TIAN Ji-Teng, YANG Ai-Guo, ZHENG Yan-Xin. 2015.
- 魁蚶(Scapharca broughtonii)半乳糖凝集素(SbGal)基因cDNA的克隆及表达分析
- CLONING AND EXPRESSION ANALYSIS OF GALECTIN FROM SCAPHARCA BROUGHTONII(SbGal)
- 海洋与湖沼, 46(5): 1061-1070
- Oceanologia et Limnologia Sinica, 46(5): 1061-1070.
- http://dx.doi.org/10.11693/hyhz20141100329
-
文章历史
- 收稿日期: 2014-11-21
- 收修改稿日期: 2015-02-19
2. 上海海洋大学水产与生命学院 上海 201306
2. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306, China
凝集素(lectin)是生物体内广泛存在的一类能使细胞发生凝集的糖类结合蛋白。作为软体动物体液免疫的一个重要免疫因子,凝集素在贝类免疫防御中起到异体成分的识别、调理、凝集等作用,是构成机体防御体系的重要组成部分(翟玉梅等,1998; Weiss et al,2000; 孙虎山等,2001; 胥炜等,2005)。
半乳糖凝集素(galectin)是动物凝集素家族的成员之一(Gerardo et al,2009),可特异性识别糖链末端的β-半乳糖苷(贺雪明等,2012),为非膜整合性的可溶性蛋白(Barondes,1984; Drickamer et al,1985)。在贝类等无脊椎动物发生感染时,半乳糖凝集素通过其标志性的糖识别结构域(Carbohydrate Recognition Domain,CRD)特异性结合半乳糖苷来参与对病害的免疫反应(Dumic et al,2006; 陈骋,2013)。例如,菲律宾蛤仔(Ruditapes philippinarum)的半乳糖凝集素可结合派琴虫(Perkinsus)和弧菌(Vibrio)表面的半乳糖和N-乙酰半乳糖胺而进行病原菌的识别(Kim et al,2008); 海鳗的原型galectin参与细胞对寄生虫的包囊作用(Nakamura et al,2012); 大西洋鳕鱼galectin-1能凝集革兰氏阳性和阴性菌,参与其免疫防御过程(Rajan et al,2013)。因此,半乳糖凝集素作为模式识别受体(Pattern Recognition Molecular,PRR)发挥作用的功能得到了广泛研究。
Galectin 家族成员众多,在一种动物中可能含有不同的类型,即使在同一种细胞中也可能会表达出几种不同的galectin(Colnot et al,1996)。近年来,对软体动物半乳糖凝集素的研究中发现一种独特的 quadruple-galectin(Tasumi et al,2007; Song et al,2010; Zhang et al,2011),其对半乳糖凝集素家族的结构是一个新的补充。但有关该类型galectin的报道还很少,第一个被鉴定的quadruple-galectin是来自于美洲牡蛎(Crassostrea viginica),它可以识别并吞噬原生动物鞭孢簇虫(Perkinsus marinus)(Tasumi et al,2007); 之后被鉴定的quadruple-galectin还有PoGal(Zhang et al,2011)、AiGal1(Song et al,2010)和AiGal2(Song et al,2011),经过病原微生物的免疫刺激,这些galectin的表达量都有明显的上调。然而,目前尚未有魁蚶(Scapharca broughtonii)半乳糖凝集素的相关报道。
魁蚶属于双壳纲,蚶目,具有适应性强、生态修复效果显著的特点,但近年来资源量锐减,深入挖掘魁蚶免疫因子对其产业的发展具有重要的理论和现实意义。目前,本课题组已在魁蚶血细胞分类及免疫功能研究(周丽青等, 2013,2014)及种质资源和遗传多样性分析(吴彪等, 2010,2012; 梁超等,2011; 田吉腾,2012; 周丽青等,2012)等方面进行了研究,发现鳗弧菌(Vibrio anguillarum)能够启动魁蚶的免疫防御功能。为进一步明确魁蚶半乳糖凝集素的特征和免疫作用,本研究在魁蚶转录组文库中筛选到的半乳糖凝集素序列的基础上,经过 RACE 扩增得到 cDNA 全长序列,并开展基因表达组织分析和鳗弧菌刺激响应规律的研究,以期为魁蚶分子育种及抗病选育提供依据,为认识魁蚶半乳糖凝集素和对该分子的进化、结构和功能的研究提供资料。
1 材料与方法 1.1 实验材料与来源实验用魁蚶购于青岛台东水产品市场,壳长约55mm左右,个体健康,于20℃充气海水中暂养一周,每天换水两次。期间投喂硅藻,实验处理前两天停止投喂。鳗弧菌为本实验室保存的菌种。
1.2 魁蚶半乳糖凝集素基因的获得 1.2.1 总RNA提取异硫氰酸胍法提取总RNA: 采用Solution D(4mol/L异硫氰酸胍,17mmol/L月桂酰肌苷酸钠,25mmol/L柠檬酸钠)与β-巯基乙醇裂解组织,然后相同体积氯仿/异戊醇(24︰1)和水饱和酚抽提蛋白质,异丙醇与醋酸钠沉淀核酸,75%乙醇洗涤核酸后干燥,用DNase(Progema)来去除基因组DNA,具体步骤参照董迎辉(2012)。1.0%琼脂糖检测RNA完整性,核酸分析仪(Eppendorf)检测其纯度和浓度。
1.2.2 全长cDNA克隆及测序根据获得的魁蚶半乳糖凝集素基因的部分序列,Primer Premier 5.0设计3'RACE和5'RACE特异性引物,利用SMART® RACE Amplication Kit和Advantage 2 PCR Kit用于3'端和5'端的扩增。3'RACE 扩增所用引物为SbGal-3F和通用引物UPM,5'RACE扩增所用引物为SbGal-5R和通用引物UPM(表 1)。具体步骤如下: 扩增体系为50μL,内含3'(5')RACE cDNA模板2.5μL,PCR-Grade water 34.5μL,10× Advantage2 PCR buffer 5.0μL,dNTP Mix(10mmol/L)1.0μL,UPM 5.0μL,SbGal-3F(SbGal-5R)1.0μL; 反应程序为: 94 ℃ 30 s,68 ℃ 30 s,72 ℃ 2 min,25个循环。PCR产物经1.2%琼脂糖凝胶电泳检测、切胶回收,回收产物分别与PMD18-T连接,转化大肠杆菌Top10感受态细胞,并挑阳性克隆进行测序。
| 引物 | 序列5'—3' |
| 10×Universal Primer A Mix (UPM) | Long, 5'-CTAATACGACTCACTATAGGGCAAGCAGTGGTATCAACGCAGAGT-3' Short, 5'-CTAATACGACTCACTATAGGGC-3' |
| SbGal-3F | 5'-TTTGCCTGTGACTGTGAGAACGAGA-3' |
| SbGal-5R | 5'-GCTGATCTCTCTCCTCATCCTGCCA-3' |
| β-actin-F | 5'-GGTTACACTTTCACCACCACAG-3' |
| β-actin-R | 5'-ACCGGAAGTTTCCATACCTAAGA-3' |
| qSbGal-F | 5'-GGATGGCAGGATGAG-3' |
| qSbGal-R | 5'-AAGCACCACCAAAGC-3' |
将筛选到的序列及推测的氨基酸序列与GenBank数据库中的已知序列进行blast比对; DNAStar软件对cDNA序列进行开放阅读框搜索及编码氨基酸预测; 利用ProtParam tool(http: //web.expasy.org/protparam/)对半乳糖凝集素分子量(Mw)及等电点pI进行预测; SignalIP 4.0 Server(http: //www.cbs.dtu.dk/services/SignalP/)查找半乳糖凝集素信号肽; TargetP 1.1(http: //www.cbs.dtu.dk/services/ TargetP/)对半乳糖凝集素进行亚细胞定位; TMHMM Server v.2.0(http: //www.cbs.dtu.dk/services/TMHMM/)预测蛋白质跨膜区域; SMART(http: //www.expasy. ch/SMART)进行蛋白质结构域分析。用NCBI的Blastp(http: //blast.ncbi.nlm.nih.gov/)对序列进行同源检索,取不同分类物种以及不同种类半乳糖凝集素氨基酸序列,用DNA man8.0软件与魁蚶铁蛋白氨基酸序列进行同源性比对分析,在此基础上用MEGA 5.0构建系统发育树。
1.3 半乳糖凝集素组织分布及对细菌刺激的响应模式分析 1.3.1 鳗弧菌刺激实验挑选健康的暂养魁蚶并随机分为对照组和处理组进行鳗弧菌刺激实验。鳗弧菌经2216E培养基扩大培养后离心取沉淀,用PBS调整浓度至OD600=0.4(1OD=5×108 bacteria/mL)。微量注射器向处理组个体前闭壳肌处注射50μL菌悬液后放回原养殖槽内,分别在0h、4h、8h、16h、24h、32h、64h随机选取3个个体活体取血(4℃,800r/min15min收集血细胞沉淀)、外套膜、鳃、闭壳肌、肝胰腺、斧足,用于总RNA的提取。对照组注射同剂量的灭菌PBS(0.1 mol/L,pH 7.4)代替鳗弧菌。
1.3.2 实时荧光定量PCR(qRT-PCR)运用qRT-PCR检测半乳糖凝集素转录本的组织分布情况及对鳗弧菌刺激的反应模式。根据获得的半乳糖凝集素cDNA序列,用Primer Premier 5.0软件设计qRT-PCR引物qSbGal-F、qSbGal-R(引物信息见表 1),选取β-actin基因作为内参基因(Li et al,2012),反应在ABI7500荧光定量PCR仪上完成。利用PrimeScriptTM RT reagent Kit(TaKaRa)试剂盒进行反转录合成模板cDNA,反应体积及反应条件按照说明书进行。反转录产物置于-20℃保存备用。qRT-PCR扩增体系为20μL,包括: SYBR Premix Ex TaqTMⅡ(2×),10μL; PCR Forward Primer(10μmol/L),0.8μL; PCR Reverse Primer(10μmol/L),0.8μL; ROX Reference DyeⅡ(50×),0.4μL; cDNA模板,2.0μL; DEPC水,6.0μL。反应程序为95℃ 30 s; 95℃ 5 s,60℃ 34 s,40 个循环,95℃ 15 s,60℃ 1 min,95℃ 15s。实验设置3个平行组。
1.3.3 数据分析软件获得每个反应的CT,采用2-DDCT方法(Livak et al,2001)进行相对定量分析。根据每个样品的3个平行实验所得的数据计算相对表达量平均值和标准差。
2 结果 2.1 SbGal基因cDNA序列分析3'RACE和5'RACE扩增产物分别测序后与转录组文库中筛选出的序列进行拼接,获得魁蚶半乳糖凝集素全长cDNA序列,命名为SbGal(GenBank登录号为KP123598)。SbGal基因cDNA全长3120bp,包含一个213 bp的5'-端非翻译区(5'-UTR),1342 bp的3'-UTR和1565 bp的开放阅读框(ORF); 其起始密码子为ATG,终止密码子为TGA,Poly(A)序列上游有4个规则的加尾信号AATAAA,很明显,该cDNA具有完整的蛋白质编码区(图 1)。
 |
| 图 1 SbGal核苷酸序列及其编码氨基酸序列 Fig. 1 Nucleotide and deduced amino acid sequence of SbGal 阴影部分为SbGal的四个结构域, 加粗带下划线的为糖结合位点, 双下划线分别代表起始密码子和终止密码子, 带框的为加尾信号, 波浪线表示多聚尾 |
氨基酸序列分析可知,SbGal基因编码一个含有554个氨基酸残基组成的蛋白质,预测的分子量大小为63.3158kDa,理论等电点为4.99。结构特征分析结果表明: 该氨基酸序列无信号肽,也非线粒体靶向肽,无明显的跨膜区域; 该蛋白具有多个功能化位点,第186位NETC和319位NGTD存在潜在糖基化位点; 在137、218、278、279、382处有脾酪氨酸激酶磷酸化位点,279、382、388、526bp处有可激活胰岛素受体激酶磷酸化位点,225位有共济失调毛细血管扩张突变激酶磷酸化位点,374位有蛋白激酶C磷酸化位点,218位有表皮生长因子受体磷酸化位点; 结构域的预测分析结果表明SbGal有四个糖识别结构域(CRD),且每个结构域通过一含有6个氨基酸的短肽链连接在一起,每个CRD都含有保守的糖结合位点,第一、第三和第四CRD均含有132个氨基酸残基(12—143,286—417,424—555),第二CRD含有130个氨基酸残基(150—279)。综上分析结果表明,本实验成功获得了魁蚶半乳糖凝集素基因全长cDNA。
2.2 SbGal基因同源性分析同源性在线搜索结果显示: SbGal编码的氨基酸序列与其它双壳类具有较高的相似性,例如,与美洲牡蛎Crassostrea viginica的相似性为70%,合浦珠母贝Pinctada fucata为65%,海湾扇贝Argopectehs irradiaas为46%; 与腹足类的相似性相对较低,与光滑双脐螺Biompalaria glabrata两个半乳糖凝集素氨基酸的相似性分别是30%、29%; 魁蚶半乳糖凝集素的四个CRD彼此的相似性在36%—41%之间,且CDR1与CDR4的相似性最大为41%。
DNAMAN8.0软件对SbGal基因编码的氨基酸序列与海湾扇贝、美洲牡蛎和合浦珠母贝的氨基酸序列进行比对(图 2),在SbGal四个CRD上都有保守的糖结合位点,不同物种的同一种galectin在糖结合位点上都很保守,在SbGal的第一CRD中,这些保守序列分别是His57,Asn59,Arg61,Asn70,Trp76,Glu79和Arg81,在其它三个CRD中这些氨基酸残基也同样存在。
 |
| 图 2 不同物种Galectin氨基酸序列比对 Fig. 2 Multiple sequence alignment by DNAman 8.0 框线内为半乳糖凝集素的四个糖识别结构域, 用方框标出, 糖结合位点用三角标出, 各物种GenBank登录号为: 海湾扇贝A. irradians (ACS72240, FJ469998); 美洲牡蛎C. virginica (ABG75998); 合浦珠母贝P. fucata (ACO36044) |
在GenBank上搜索选取了具有代表性物种的半乳糖凝集素序列,利用Mega5.0构建NJ系统进化树如图 3,整个系统发育树分成4大支,原型galectin分成原型1和2两个分支,quadruple-galectin居于这两原型分支间,且与原型galectin 1首先聚在一起; 在quadruple-galectin分支中,S. broughtonii首先与C. virginica聚在一起后再与P. fucata聚类。
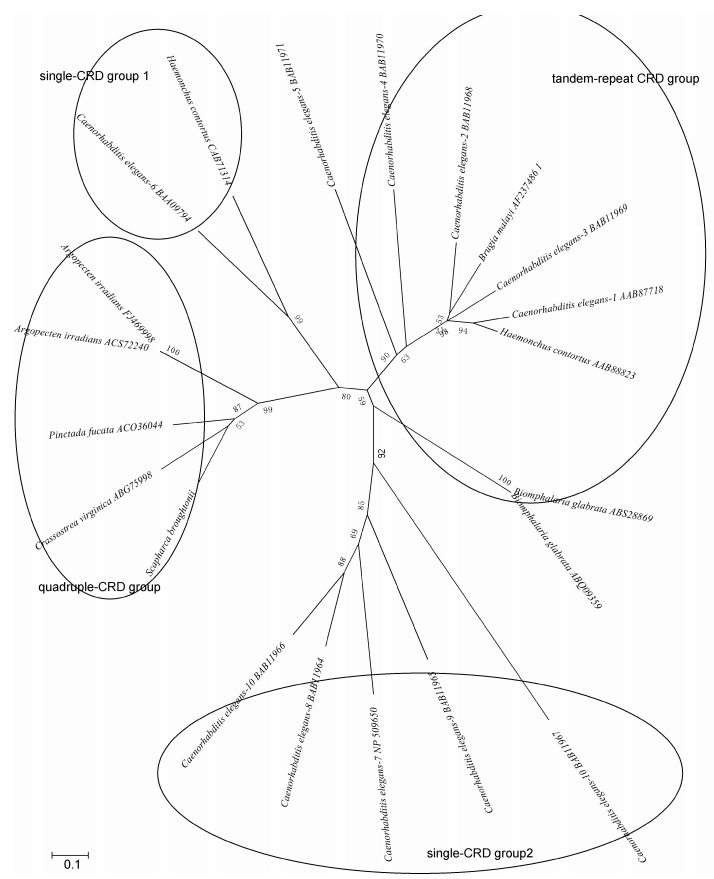 |
| 图 3 半乳糖凝集素的NJ系统进化树 Fig. 3 Phylogenetic tree of CRDs from 21 galectins 各物种galectin同源氨基酸序列的GenBank登录号如下: 海湾扇贝A. irradians (ACS72240, FJ469998); 美洲牡蛎C. virginica (ABG75998); 合浦珠母贝P. fucata (ACO36044); 秀丽隐杆线虫1-9, Caenorhabditis elegans-1-9 (AAB87718, BAB11968, BAB11969, BAB11970, BAB11971, BAA09794, NP-509650, BAB11964, BAB11965); 秀丽隐杆线虫Caenorhabditis elegans-10 (BAB11966, BAB11967); 马来布鲁丝虫, Brugia malayi (AF237486-1); 捻转血矛线虫Haemonchus contortus (AA88823, CAB71314); 光滑双脐螺Biomphalaria glabrata (ABS28869, ABQ09359) |
以β-actin为内参基因检测了SbGal mRNA在健康个体不同组织中的表达差异性(图 4),结果表明: SbGal mRNA在斧足、鳃、外套膜、肝胰腺、闭壳肌、血细胞中都有表达,但表达量存在明显的差异。以肝胰腺的表达量为参考,SbGal在血细胞中的表达量最高,为肝胰腺的87.05倍(P<0.01),其次是在斧足当中,为72.86倍(P<0.01)。
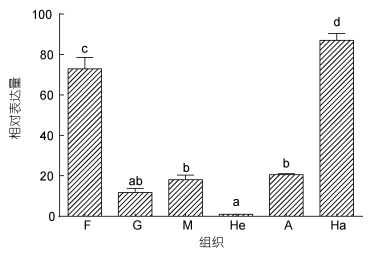 |
| 图 4 SbGal在不同组织中的表达分布 Fig. 4 Distribution of SbGal gene in different tissues of S. broughtonii 所有数据按照平均值± S.D. (n=3)表示。不同字母表示两组织之间SbGal基因表达量差异极显著(P<0.01)。F. 斧足; G. 鳃; M. 外套膜; He. 肝胰腺; A. 闭壳肌; Ha. 血淋巴细胞 |
鳗弧菌感染后,SbGal在斧足、鳃、外套膜、肝胰腺、闭壳肌、血细胞6种组织中的表达模式如图 5,结果表明: 鳗弧菌感染后,魁蚶6种组织中的SbGal的表达量都明显上调。感染4h时,在各组织中的表达量开始明显高于对照组,并且在肝胰腺和闭壳肌中,其表达量达到最大值,分别为对照组的1430.48倍(P<0.01)、1038.23倍(P<0.01); 在斧足和鳃中的表达量于感染后8h达到最高值,分别为对照组的128.21倍(P<0.01)、1502.70倍(P<0.01); 在外套膜和血细胞中的表达量于感染后16h达到最高值,分别为对照组的361.56倍(P<0.01)、354.87倍(P<0.01)。随后,各组织中的表达量开始回落,且在鳃和闭壳肌中其表达量的回落表现出明显的瞬时趋势; SbGal在肝胰腺中的表达量于感染后32h出现二次表达高峰,为对照组的261.72倍(P<0.01)。总之,经鳗弧菌感染后,SbGal表现出显著的时间依赖性,除血细胞外还表现出较显著地瞬时表达趋势,总体表现为先升高后降低的趋势。
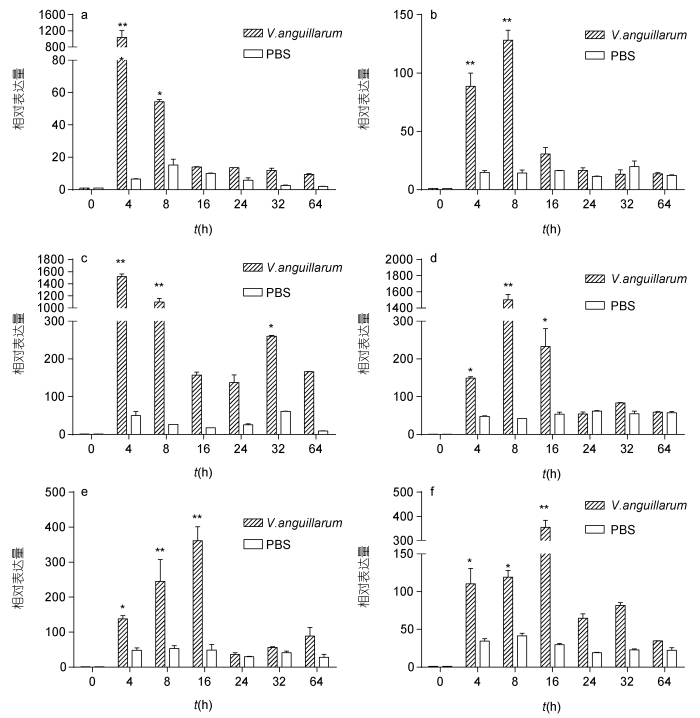 |
| 图 5 鳗弧菌感染后魁蚶6种组织SbGal基因的表达情况 Fig. 5 SbGal mRNA expression level after V. anguillarum challenge in five tissues a. 闭壳肌; b. 斧足; c. 肝胰腺; d. 鳃; e. 外套膜; f. 血细胞。与0h相比, 两个星号表示组间差异极显著(P<0.01), 一个星号表示组间差异显著(P<0.05) |
特异性结合β-半乳糖苷的半乳糖凝集素是动物凝集素的一种代表类型。半乳糖凝集素作为PRR参与免疫防御,病原微生物的刺激会调节半乳糖凝集素在生物体内的表达,进而加强免疫应答过程(Vasta,2009)。近来,有报道称半乳糖凝集素结合在细胞表面和体内潜在病原微生物细胞外基质的多糖上,在先天免疫过程中以识别效应器的角色发挥作用(Vasta,2009)。目前为止,对无脊椎动物galectin的研究指出,quadruple-galectin仅在软体动物中发现,如AiGal1、PfGal、AiGal2已被成功鉴定并做结构功能分析。本研究通过构建魁蚶高通量测序转录组文库并利用RACE技术获得了魁蚶galectin基因全长cDNA; 检测了其mRNA在魁蚶中各组织的分布情况和在外源微生物刺激下表达量的变化,对探讨半乳糖凝集素在固有免疫防御中发挥的作用具有重要意义。
现在已鉴定分析的galectin无信号肽,通过非经典的分泌方式到达细胞外(Almkvist et al,2002)。SbGal编码氨基酸序列的N端也不存在信号肽,推测SbGal也是通过非经典分泌方式到达细胞外,但还需要进一步的实验验证。SbGal cDNA的3'-UTR存在多个加尾信号的现象可能与脊椎动物galectin一样存在多种剪切方式可产生多个转录变异体,皱纹盘鲍galectin基因cDNA的3'-UTR存在3处多聚腺苷酸加尾位点(郑明刚,2007)。
同源性比对分析发现SbGal的四个结构域高度保守,且每个结构域中与糖结合的氨基酸残基也都高度保守,符合半乳糖凝集素家族成员的具有保守糖识别位点(Kasai et al,1996; Leffler,2001)的结构特征; NJ系统进化树看到SbGal与同属于quadruple- galectin的其它物种的galectin聚在一起,总之,成功获得的SbGal也是一种quadruple- galectin。
综上,SbGal与已知的无脊椎动物半乳糖凝集素结构相似,没有信号肽且只含有典型的半乳糖凝集素识别结构域,这一点与脊椎动物的半乳糖凝集素结构特征相一致(宋小燕,2009)。特征性序列分析、较高的同源性、保守氨基酸残基的存在都说明SbGal是半乳糖凝集素家族中的一个新成员,其是在软体动物中发现的又一个具有四个明显结构域的半乳糖凝集素。因此,本研究不仅填补了魁蚶半乳糖凝集素研究的空白,而且还丰富了无脊椎动物半乳糖凝集素研究的相关数据。
qRT-PCR检测发现SbGal与其它双壳贝类galectin一样在健康个体的不同组织都有表达(Tasumi et al,2007; Song et al, 2010,2011; Zhang et al,2011),但表达量存在差异,说明SbGal基因的表达不具有组织特异性,但表达量具有一定的组织特异性。有研究表明细菌、病毒、真菌或寄生虫感染后的牡蛎
oyster(Zhang et al,2011)、文昌鱼Branchiostoma lanceolatum(禹艳红,2007)和文蛤Meretrix meretrix(Kim et al,2008)体内的半乳糖凝集素基因mRNA水平上调。经过鳗弧菌和藤黄微球菌(Micrococcus luteus)感染后的海湾扇贝,AiGal1 mRNA的表达量显著上调,然而,经酵母感染后,其表达量基本保持不变(Song et al,2010); 在正常情况下,合浦珠母贝半乳糖凝集素PoGal2持续表达,当被溶藻弧菌(Vibrio alginolyticus)感染后,其表达量也显著上调(Zhang et al,2011)。本研究中鳗弧菌感染魁蚶后,SbGal在各组织的表达量都有升高,在肝胰腺中上升幅度最大,可
能SbGal通过肝胰腺发挥对病原菌入侵的防御作用较大(郑明刚,2007),或者肝胰腺是软体动物先天免疫中合成蛋白的重要器官(Kong et al,2010; Prokhorova et al,2010; Zhao et al,2010)。鳗弧菌感染后,SbGal前期的表达是逐步上调增强的,再经过一定的时间即恢复到感染前的水平,由此可见SbGal的表达在时间和空间上都有一定的规律,这为进一步研究SbGal在魁蚶免疫反应中的相关免疫功能研究提供了资料。
| 田吉腾, 2012.魁蚶微卫星富集文库的构建及四个地理群体的遗传多样性分析.上海:上海海洋大学硕士学位论文, 1-59 |
| 孙虎山,李光友, 2001.双壳贝类参与免疫防御的体液因子.海洋科学, 25(4):34-36 |
| 吴彪,杨爱国,刘志鸿等, 2010.魁蚶两个不同群体形态性状对体质量的影响效果分析.渔业科学进展, 31(6):54-59 |
| 吴彪,梁超,杨爱国等, 2012.基于SSR标记的魁蚶(Scapharca broughtonii)不同群体遗传结构的分析.海洋与湖沼, 43(4):863-869 |
| 宋小燕, 2009.海湾扇贝凝集素基因和栉孔扇贝亲环素A基因的克隆与表达.咸阳:西北农林科技大学硕士学位论文, 1-84 |
| 陈骋, 2013.半滑舌鳎(Cynoglossus semilaevis)免疫相关基因CsG3BP的克隆、表达及功能研究.北京:中国科学院研究生院(海洋研究所)硕士学位论文, 1-72 |
| 周丽青,杨爱国,王清印等, 2012.魁蚶四个地理群体ITS序列变异及系统发生分析.渔业科学进展, 33(5):79-84 |
| 周丽青,杨爱国,王清印等, 2013.魁蚶血细胞分类及其免疫功能的初步分析.水产学报, 37(4):599-606 |
| 周丽青,杨爱国,王清印等, 2014.鳗弧菌对魁蚶血细胞形态及免疫功能的影响.海洋与湖沼, 45(3):536-541 |
| 郑明刚, 2007.皱纹盘鲍表达序列标签及免疫相关基因的克隆与表达研究.青岛:中国海洋大学博士学位论文, 1-124 |
| 禹艳红, 2007.文昌鱼凝集素基因家族和其他补体相关的模式识别分子的克隆表达、进化分析稚功能研究.广州:中山大学博士学位论文, 1-192 |
| 胥炜,王昊,宋林生等, 2005.栉孔扇贝C型凝集素基因的克隆与表达研究.高技术通讯, 15(1):83-88 |
| 贺雪明,唐丽,贺福初, 2012.半乳糖凝集素1的免疫功能.生物技术通讯, 23(6):896-899 |
| 梁超,杨爱国,刘志鸿等, 2011. 4个地理群体魁蚶(Scapharca broughtonii)的形态差异与判别分析.海洋科学, 35(11):108-113 |
| 董迎辉, 2012.泥蚶高通量转录组分析及生长相关基因的克隆与表达研究.青岛:中国海洋大学博士学位论文, 1-144 |
| 翟玉梅,丁秀云,李光友, 1998.软体动物血细胞及体液免疫研究进展.海洋与湖沼, 29(5):558-562 |
| Almkvist J, Karlsson A, 2002. Galectins as inflammatory mediators. Glycoconj J, 19(7-9):575-581 |
| Barondes S H, 1984. Soluble lectins:a new class of extracellular proteins. Science, 223(4642):1259-1264 |
| Colnot C, Ripoche M A, Scaerou F et al, 1996. Galectins in mouse embryogenesis. Biochem Soc Trans, 24(1):141-146 |
| Drickamer K, 1985. Two distinct classes of carbohydrate-recognition domains in animal lectins. J Biol Chem, 263(20):9557-9560 |
| Dumic J, Dabelic S, Flögel M, 2006. Galectin-3:an open-ended story. Biochem Biophys Acta, 1760(4):616-635 |
| Kasai K-I, Hirabayashi J, 1996. Galectins:a family of animal lectins that decipher glycocodes. J Biochem, 119(1):1-8 |
| Kim J Y, Kim Y M, Cho S K et al, 2008. Noble tandem-repeat galectin of Manila clam Ruditapes philippinarum is induced upon infection with the protozoan parasite Perkinsus olseni. Dev Comp Immunol, 32(10):1131-1141 |
| Kong P F, Zhang H, Wang L L et al, 2010. AiC1qDC-1, a novel gC1q-domain-containing protein from bay scallop Argopecten irradians with fungi agglutinating activity. Dev Comp Immunol, 34(8):834-846 |
| Leffler H, 2001. Galectins structure and function--A synopsis. In:Crocker P R ed. Mammalian Carbohydrate Recognition System. Berlin:Springer, 57-83 |
| Li M, Zhu L, Zhou C Y et al, 2012. Molecular characterization and expression of a novel big defensin(Sb-BDef1) from ark shell, Scapharca broughtonii. Fish Shellfish Immunol, 33(5):1167-1173 |
| Livak K J, Schmittgen T D, 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method. Methods, 25(4):402-408 |
| Nakamura O, Watanabe M, Ogawa T et al, 2012. Galectins in the abdominal cavity of the conger eel Conger myriaster participate in the cellular encapsulation of parasitic nematodes by host cells. Fish Shellfish Immunol, 33(4):780-787 |
| Prokhorova E E, Tsymbalenko N V, Ataev G L, 2010. Expression of genes encoding defense factors in the snail Planorbarius corneus(Gastropoda, Pulmonata) infested with trematodes. Parazitologiia, 44(4):310-325 |
| Rajan B, Kiron V, Femandes J M et al, 2013. Localization and functional properties of two galectin-1 proteins in Atlantic cod(Gadus morhua) mucosal tissues. Dev Comp Immunol, 40(2):83-93 |
| Song X Y, Zhang H, Wang L L et al, 2011. A galectin with quadruple-domain from bay scallop Argopecten irradians is involved in innate immune response. Dev Comp Immunol, 35(5):592-602 |
| Song X Y, Zhang H, Zhao J M et al, 2010. An immune responsive multidomain galectin from bay scallop Argopecten irradians. Fish Shellfish Immunol, 28(2):326-332 |
| Tasumi S, Vasta G R, 2007. A galectin of unique domain organization from hemocytes of the Eastern oyster(Crassostrea virginica) is a receptor for the protistan parasite Perkinsus marinus. J Immunol, 179(5):3086-3098 |
| Vasta G R, 2009. Roles of galectins in infection. Nat Rev Microbiol, 7(6):424-438 |
| Weiss I M, Kaufmann S, Mann K et al, 2000. Purification and characterization of perlucin and perlustrin, two new proteins from the shell of the mollusk Haliotis laevigata. Biochem Biophys Res Commun, 267(1):17-21 |
| Zhang D C, Jiang S G, Hu Y T et al, 2011. A multidomain galectin involved in innate immune response of pearl oyster Pinctada fucata. Dev Comp Immunol, 35(1):1-6 |
| Zhao J M, Qiu L H, Ning X X et al, 2010. Cloning and characterization of an invertebrate type lysozyme from Venerupis philippinarum. Comp Biochem Physiol B Biochem Mol Biol, 156(1):56-60 |
 2015, Vol. 46
2015, Vol. 46


