中国海洋湖沼学会主办。
文章信息
- 王丹妮, 郑春静, 江婷佳, 刘军. 2015.
- WANG Dan-Ni, ZHENG Chun-Jing, JING Ting-Jia, LIU Jun. 2015.
- 蓝点马鲛(Scomberomorus niphonius)两种Wap65基因克隆及蛋白功能的研究
- MOLECULAR CLONING AND FUNCTIONAL ANALYSIS OF TWO DIFFERENT Wap65 GENES FROM SCOMBEROMORUS NIPHONIUS
- 海洋与湖沼, 46(5): 1052-1060
- Oceanologia et Limnologia Sinica, 46(5): 1052-1060.
- http://dx.doi.org/10.11693/hyhz20150700206
-
文章历史
- 收稿日期: 2015-07-29
- 收修改稿日期: 2015-08-21
2. 宁波市海洋与渔业研究院 宁波 315010
2. Ningbo Institute of Marine and Fishery, Ningbo 315010, China
Wap65蛋白(Warm temperature acclimation 65kDa protein)是血浆蛋白的一种,最早发现于金鱼、鲤鱼体内(Kikuchi et al,1995)。实验结果表明,金鱼和鲤鱼在高温诱导下,有一种分子量为65kDa的蛋白大量存在于各组织中,被命名为Wap65,此蛋白与哺乳动物的血红素结合蛋白高度同源(Altruda et al,1985; Nikkila et al,1991; Morgan et al,1993; Tolosano et al,2002)。研究发现,Wap65基因在不断进化中,由于受到串联机制和全基因组重复的影响(Sha et al,2008),产生了两种不同的异构体,分化为两种蛋白,分别为Wap65-1和Wap65-2。目前,已经在许多鱼类发现了该基因,包括青鳉鱼(Hirayama et al,2004)、蓝鲶鱼(Peatman et al,2008)、斑点叉尾鮰(Sha et al,2008)、剑尾鱼(Aliza et al,2008)、红鳍东方鲀(Hirayama et al,2003)、真裸南极鱼(Clark et al,2008)、香鱼(Shi et al,2010)、鲈鱼(Sarropoulou et al,2010)、大鳞泥鳅(Cho et al,2012)等。
蓝点马鲛(Scomberomorus niphonius)属于辐鳍亚纲、鲈形目、鲭亚目、鲭科、马鲛属,广泛分布于北太平洋西部,在我国产于东海、黄海和渤海,在南海以海南文昌铺前附近海域最为著名。由于近年来人们对蓝点马鲛的肆意捕捞以及环境不断恶化,导致蓝点马鲛的产量急剧减少,目前已经在中国宁波象山建立了蓝点马鲛的保护基地。蓝点马鲛属近海温水性洄游鱼类,因此高温是蓝点马鲛的生存及生产的重要因素之一。
在NCBI数据分析中发现,对蓝点马鲛Wap65的研究主要集中在微卫星的研究上,本研究通过克隆Wap65-1和Wap65-2的基因全长序列,并表达相应蛋白,研究其功能,以期为蓝点马鲛耐热品种的培育提供资料。
1 材料与方法 1.1 材料2014年5月在浙江省宁波市象山港捕捞蓝点马鲛样本12尾[平均重(750±5)g],取头、肌肉、肝脏、脾脏、头肾这5个组织迅速投入液氮中保存,根据TRIzol® Plus RNA Purification Kit(Invitrogen)提取上述5个组织的总RNA(步骤见说明书),并采用SuperScriptTM Fist-Str and Synthesis Kit逆转录为cDNA,并保存于-20℃冰箱备用。热诱导实验所用的鱼苗来自宁波市海湾苗种繁育中心,共取24尾[平均重(1.0±0.2)g],热处理后,保存于液氮中备用。
1.2 方法 1.2.1 Wap65-1和Wap65-2基因全长的克隆根据NCBI中黑棘鲷(Acanthopagrus schlegeli)、花鲈(Lateolabrax japonicus)、条石鲷(Oplegnathus fasciatus)的Wap65-1以及真裸南极鱼(Harpagifer antarcticus)、花鲈(Lateolabrax japonicus)、鮸鱼(Miichthys miiuy)的Wap65-2氨基酸序列,利用ClustalW对以上序列进行保守性分析并分别设计简并性引物(见表 1)。
| 引物名称 | 序列(5'—3') | 用途 |
| 1-F1 | GAGTCCTTCKCWGAGTTGGAT | Wap65-1中间片段克隆 |
| 1-R1 | GGTCATCCTTGATCATGTAA | |
| 1-F2 | GACCACAAGGTGTTCAGCTAT | |
| 1-R2 | CAGCGTCCACCTCACTGTG | |
| 2-F1 | CAGCTTGATGACATCCATAACA | Wap65-2中间片段克隆 |
| 2-R1 | TCAATCAGGGTGTAGTGAG | |
| 2-F2 | GATGACAAGGTGTTCAGCTA | |
| 2-R2 | GATGTACACCTGATCATCCTTA | |
| r1-R1 | CTCCTTGAAGGCACTCTCGATGGTGTCA | Wap65-1 5'RACE合成 |
| r1-R2 | GTGCAGTTTGGCATTGTCGTGAACTCCT | |
| r1-F1 | CCACCTGGATGCTGCTGTGGAGTGTC | Wap65-1 3’RACE合成 |
| r1-F2 | GGAGTTCACGACAATGCCAAACTGCACA | |
| r2-R1 | GTCACGATGGGTGTCCAGACGCATGTA | Wap65-2 5’RACE合成 |
| r2-R2 | CAGCCAGCGTAAAGCAGAAGTGCAGACA | |
| r2-F1 | CATGGTCCCACCTGCCTGTCTGCACTT | Wap65-2 3’RACE合成 |
| r2-F2 | CCGAAGGATGCCCGCAGTTACTTCAT | |
| q1-F | CTGCACATCTGCTTTCCGCTT | Wap65-1荧光定量引物 |
| q1-R | CCACGTGGTCGCTATCTTCACT | |
| q2-F | CAGAGCACCCAGATGAACACGAT | Wap65-2荧光定量引物 |
| q2-R | GGATACCCGTCCTCCAGATTG | |
| 18S-F | GAGGCCCTGTAATTGGAATGAGTA | 内参引物 |
| 18S-R | CTGCAGCAACTTTAAGATACGCT | |
| 1-F3 | CTACCGTGGACCAGAGGACT | 检测Wap65-1全长 |
| 1-R3 | GTGGTCAAATCTTGGCGAGTGTTA | |
| 2-F3 | GCTCCACAGTGAGACTCCACAT | 检测Wap65-2全长 |
| 2-R3 | CACCGATAAGCAGATGACTGTGAGA | |
| pCol-Nde-65-1NF | GCATCATCATCATCATCATATGAAGCTGCTCACCCACATC | Wap65-1表达载体构建 |
| pCol-Eco-65-1NR | CAGGTCGACAAGCTTGAATTCTTAGTGGTCACAGCCAAAC | |
| pCol-Nde-65-2NF | GCATCATCATCATCATCATATGAAGCTGCTCACCAAAACTCTC | Wap65-2表达载体构建 |
| pCol-Eco-65-2NR | CAGGTCGACAAGCTTGAATTCCTAATCCCGACATCCCATCAT |
以蓝点马鲛肝脏cDNA为模板,采用巣式PCR(第一轮引物采用F1和R1,第二轮引物采用F2和R2),克隆Wap65-1和Wap65-2的部分片段,采用Platinum® PCR SuperMix High Fidelity酶(Invitrogen),进行两轮PCR,体系为25μL,反应条件均为: 94℃预变性2min; 94℃ 30s,62℃ 30s,68℃ 2min,38个循环,产物保存于-20℃。
然后根据已获得的Wap65-1和Wap65-2基因部分片段分别设计3′和5′RACE特异性引物(见表 1),利用Gene RACETM Kit扩增得到cDNA全长。第一轮PCR反应体系为12.5μL,反应条件: 94℃预变性2min; 98℃ 10s,72℃ 30s,5个循环; 98℃ 10s,70℃ 30s,5个循环; 98℃ 10s,65℃ 30s,25个循环; 最后,68℃彻底延伸5min。第二轮PCR反应体系20μL,反应条件: 94℃,2min,98℃ 10s,65℃ 30s,30个循环; 最后68℃彻底延伸5min。PCR产物保存于-20℃。
上述所有PCR产物与pUCm-T载体连接,转化到E. coli DH5α感受态细胞中,培养过夜,每块板随机挑选5个菌落,然后进行菌落检测,选取阳性菌,送往上海生物工程有限公司进行测序。
序列拼接后,得到Wap65-1和Wap65-2基因的cDNA序列全长,并设计引物,进行全长克隆,克隆所得的基因序列与拼接序列一致,从而确定基因的序列。
1.2.2 生物信息学的分析运用NCBI中的BLASTN对Wap65-1和Wap65-2基因的同源性进行分析,用MEGA 5软件构建Neighbor-joining系统进化树,并利用PredictProtein软件对Wap65-1和Wap65-2蛋白序列进行功能位点分析,采用DNAMAN软件将蓝点马鲛的这两种氨基酸序列和已知的其它鱼类的氨基酸序列进行比对和分析,采用Signal P 4.1工具进行蛋白信号肽分析。
1.2.3 蓝点马鲛幼体高温胁迫及两种基因的表达特征分析将蓝点马鲛的幼体在20℃、25℃、30℃、35℃的温度下进行1h的热诱导,然后提取总RNA,并逆转录为cDNA,用于荧光定量表达分析。根据Beacon Designer 7.0设计目的基因及内参引物(见表 1)。采用Power SYBR® Green PCR Master Mix进行荧光定量PCR(反应体系及反应条件见说明书)。采用2-ΔΔCT法计算Wap65-1和Wap65-2基因的表达量并进行分析,并用SPSS11.0软件进行显著性分析。
1.2.4 蓝点马鲛Wap65-1和Wap65-2原核表达及E. coli BL21(DE3)热耐受性实验设计特异性引物(见表 1),扩增两个基因ORF,用EcoRⅠ和NdeⅠ对目的基因及pCold TF载体分别双酶切,根据/span>In-Fusion® HD Cloning Kit(Clontech)构建重组质粒并导入表达宿主菌E. coli BL21(DE3),37℃培养至OD值0.4—0.6之间,15℃进行冷休克,然后加入IPTG(至终浓度为0.5mmol/L),15℃低温诱导20 h。之后离心,收集总蛋白,剩下的菌液超声破碎,收集上清,然后将总蛋白及上清进行SDS-PAGE电泳分析。再取一部分样品,SDS-PAGE电泳后,用His-Tag Monoclonal Antibody一抗,做Western blot分析,经过转膜、杂交及显色,分析蛋白的表达情况。
在热耐受性实验中,将带有pCold TF、Wap65-1-pCold TF、Wap65-2-pCold TF基因的E. coli BL21(DE3)菌株,接种后,37℃扩大培养使其OD值在0.5,然后加入IPTG(终浓度0.5mmol/L)低温诱导20h 后,取出测其OD值均在0.6—0.7,在保证菌液浓度一致的条件下,分别取1mL的细菌转移到45℃条件下,热处理 0、15、30、45和60min,每个时间点的菌液浓度保持一致,并在每个时间点取50μL菌液,然后稀释50倍后,取100μL涂板,37℃过夜培养,计算每个培养板的菌落数目。运用SPSS软件进行分析,并计算细菌生存率,数据以平均数±标准差表示。
2 结果 2.1 Wap65-1和Wap65-2基因全长cDNA序列分析采用RACE的方法获得Wap65-1和Wap65-2的cDNA序列全长。登录号分别为: KT356862和KT356863。Wap65-1基因长度为1659bp,其中5′和3′未参与编码的碱基长度分别为71bp和307bp,开放阅读框(ORF)为1281bp,编码区编码426个氨基酸,预测分子量大小约为48.74kDa,理论等电点为5.5,3’端含有终止密码子TAA及一个ploy(A)尾巴。运用Predictprotein分析蓝点马鲛的Wap65-1蛋白功能位点,发现具有多个功能位点的蛋白序列,包括2个N-糖基化位点(67—70和179—182),2个蛋白激酶C磷酸化位点(362—364和365—367); 8个酪蛋白磷酸化位点(40—43,69—72,93—96,199—202,286—289,293—296,316—319及353—356); 5个酪氨酸激酶磷酸化位点(113—120,155—162,185—191,211—219及302—309); 3个N-甲基化位点(62—67,252—257及420—425)。
 |
| 图 1 Wap65-1开放阅读框核苷酸序列及推导编码的氨基酸 Fig. 1 The open reading frame of full length cDNA of Wap65-1 gene and deduced amino acid sequence 方框里ATG为起始密码子, TAA为终止密码子, 下划线为信号肽 |
Wap65-2基因长度为1725bp,其中,5′和3′的未参与编码的碱基长度分别为83bp和331bp,开放阅读框(ORF)为1311bp,编码区编码436个氨基酸,预测分子量大小约为48.45kDa,理论等电点为5.7,3’端含有终止密码子TAA及一个ploy(A)尾巴。运用Predictprotein分析蓝点马鲛的Wap65-2蛋白序列的功能位点,同样发现具有多个功能位点的蛋白序列,包括3个N糖基化位点(78—81和208—211,220— 223),7个蛋白激酶C磷酸化位点(80—82,179—181,277—279,290—292,334—336,373—375和411— 413),11个酪蛋白激酶Ⅱ磷酸化位点(51—54,80—83,144—147,251—254,257—260,277—280,290—293,296—299,303—306,316—329及334—337),2个酪氨酸激酶磷酸化位点(166—173和196—202),3个肉蔻酰基位点(32—37,240—245和387—392)。
 |
| 图 2 Wap65-2开放阅读框核苷酸序列及推导编码的氨基酸 Fig. 2 The open reading frame of full length cDNA of Wap65-2 gene and deduced amino acid sequence 方框里ATG为起始密码子, TAG为终止密码子, 下划线为信号肽 |
使用DNAMAN软件对蓝点马鲛Wap65-1和Wap65-2的氨基酸序列进行同源序列分析,结果如图 3所示,蓝点马鲛(Scomberomorus niphonius)Wap65-1基因与花鲈(Lateolabrax japonicus)的同源性为86%,与条石鲷(Oplegnathus fasciatus)、金头鲷(Sparus aurata)、黑棘鲷(Acanthopagrus schlegeli)的同源性为85%。利用MEGA5软件进行系统进化分析,结果表明,蓝点马鲛Wap65-1基因与花鲈的亲缘关系比较近。蓝点马鲛(Scomberomorus niphonius)Wap65-2基因与条石鲷(Oplegnathus fasciatus)、花鲈(Lateolabrax japonicus)的同源性为84%,与南极真裸鱼(Harpagifer antarcticus)、鮸鱼(Miichthys miiuy)的同源性为82%,与大菱鲆(Scophthalmusmaximus)的同源性为80%。利用MEGA5软件进行系统进化分析,结果表明,蓝点马鲛Wap65-2与条石鲷、花鲈的亲缘关系比较近。
 |
| 图 3 蓝点马鲛Wap65-1和Wap65-2氨基酸序列与其它鱼类氨基酸序列比对 Fig. 3 Amino acid sequence alignment of Wap65-1 and Wap65-2 from S. niphonius with other fishes 同种氨基酸用相同颜色背景表示; 缺失的氨基酸用“.”表示 |
 |
| 图 4 蓝点马鲛Wap65-1和Wap65-2基因与其它鱼类的系统进化树 Fig. 4 Phylogenetic tree of Wap65-1 and Wap65-2 from S. niphonius and other fishes |
 |
| 图 5 蓝点马鲛幼体在不同温度下Wap65-1和Wap65-2的相对表达量 Fig. 5 Expression characterization of Wap65-1 and Wap65-2 transcript in different temperature |
qRT-PCR结果表明: 蓝点马鲛Wap65-1基因和Wap65-2基因在20℃、25℃、30℃、35℃分别都有表达,而Wap65-2的表达量随着温度的增高而明显增高,这一结果与所查文献所得出的结果类似,在蓝点马鲛体内,主要参与温度调节的基因是Wap65-2。
2.4 蓝点马鲛Wap65-1和Wap65-2原核表达及E. coliBL21(DE3)热耐受性实验重组质粒转化大肠杆菌BL21(DE3)IPTG诱导后,SDS-PAGE检测表明在相对分子质量为100kDa处出现浓度较高的表达条带,由于pCold TF载体自带表达伴侣,所以表达出的蛋白分子量应减掉自带分子伴侣的分子量(48kDa)。经过计算后,所得蛋白的分子量与预测一致,并且用His-Tag Monoclonal Antibody一抗进行Western blot分析(见图 6)。
 |
| 图 6 蓝点马鲛Wap65基因的原核表达 Fig. 6 Prokaryotic expression of S. niphonius a. Wap65两种蛋白的SDS-PAGE电泳结果; b. Wap65两种蛋白的Western bolt分析结果 |
通过对表达pCold TF、Wap65-1-pCold TF、Wap65-2-pCold TF的E. coli BL21(DE3)进行45℃的热处理,在处理15、30、45和60min后,细菌生存率分别是40%、22%、15%、7%,以及75%、60%、45%、30%; 而对照组(含pCold TF)细菌生存率在上述各时间点分别是30%、17%、10%和5%(见图 7),这说明热刺激条件下,Wap65-1-pCold TF和Wap65-2-pCold TF对细菌都起到了一定程度的保护作用,而Wap65-2与空白对照组比较,表明其保护作用尤为显著。
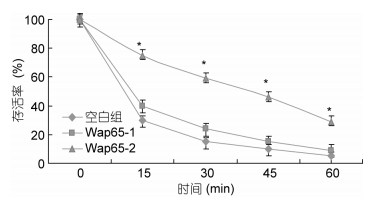 |
| 图 7 Wap65基因在高温胁迫下保护实验 Fig. 7 The protection experiments of Wap65 under high temperature stress |
Wap65广泛存在于硬骨鱼类的血浆蛋白,参与了体内多种机制的调控。本次研究通过克隆技术获得了蓝点马鲛Wap65-1和Wap65-2的cDNA全长序列,通过SDS-PAGE电泳检测结果表明,Wap65-1和Wap65-2的分子量大约为48kDa,与理论大致吻合。两个基因的N端都有19个氨基酸序列为信号肽序列,与花鲈及其它硬骨鱼类的Wap65基因一样。虽然Wap65-1与Wap65-2是具有同源性的,但是,Wap65-2蛋白具有鱼类Wap65的典型结构特征,具有保守的7个疏水残基和2个组氨酸残基,这些都与血红素结合区的形成有关(史雨红等,2012),而Wap65-1却没有。
通过对蛋白质氨基酸的分析,发现在氨基酸的组成中,两种蛋白赖氨酸和组氨酸的含量比较高,其氨基酸上含有多个功能位点,例如糖基化、磷酸化等,有助于进一步研究蛋白的结构稳定性和功能,同样也促进了蛋白质的主要定位。
通过对其进化的分析,结果表明: 蓝点马鲛的Wap65-1与花鲈亲缘关系最近,Wap65-2与条石鲷、花鲈的Wap65-2亲缘关系最近。
许多资料证明,Wap65-1与Wap65-2除了在分子特征的差异,其表达量在不同温度下,也有差异。在高温处理的蓝点马鲛幼体组织定量结果表明,Wap65-2的表达量随着温度的升高表达量呈显著性差异(P<0.05),与所查文献结果一致。这就说明了在蓝点马鲛体内,其参与温度调节的主要是Wap65-2。
鱼类Wap65-1和Wap65-2表达的差异性证明了它们之间的功能的差异性。通过对鱼类在进化过程中适应性的分析,可以知道Wap65-2仍然处于快速的进化当中,其中也存在着一些选择位点,称为正达尔文选择位点,尤其是在 Wap65-2中该位点更多一些(Sarropoulou et al,2010)。
目前,对Wap65这类蛋白的功能研究还不是很多,除了与温度有关,还与其它多种环境应激因子有关,例如水的盐度(Choi et al,2008),重金属胁迫等有关(George et al,2004; Hayes et al,2004; Berthet et al,2005; Burgos et al,2005)。另外,许多数据研究发现,鱼类的免疫系统与Wap65之间的关系非常密切,而且细菌、LPS也会诱导Wap65的上调(Peatman et al,2008),此外,转录调控区NF-IL6存在于Wap65-2基因5’调控区,表明免疫因子调节与Wap65-2的表达可能相关。但是,目前在功能和作用途径仍不清楚。
本次研究成功克隆了蓝点马鲛Wap65-1和Wap65-2基因的cDNA序列全长,并通过不同温度下其表达量的差异,进一步确定Wap65-2与温度之间的关系,在温度调节过程中起着重要的作用,为以后深入研究Wap65基因在鱼类或者其它动物的功能奠定了基础。
| 史雨红,陈炯,高珊珊等, 2012.花鲈Wap65-2基因的克隆、理化性质及其表达与哈维氏弧菌感染的相关性.动物学研究, 33(5):481-486 |
| Aliza D, Ismail I S, Kuah M-K et al, 2008. Identification of Wap65, a human homologue of hemopexin as a copper-inducible gene in swordtail fish, Xiphophorus helleri. Fish Physiol Biochem, 34(2):129-138 |
| Altruda F, Poli V, Restagno G et al, 1985. The primary structure of human hemopexin deduced from cDNA sequence:Evidence for internal, repeating homology. Nucleic Acids Res, 13(11):3841-3859 |
| Berthet B, Mouneyrac C, Pérez T et al, 2005. Metallothionein concentration in sponges(Spongia officinalis) as a biomarker of metal contamination. Comp Biochem Physiol C, 141(3):306-313 |
| Burgos M G, Winters C, Stürzenbaum S R et al, 2005. Cu and Cd effects on the earthworm Lumbricus rubellus in the laboratory:multivariate statistical analysis of relationships between exposure, biomarkers, and ecologically relevant parameters. Environ Sci Technol, 39(6):1757-1763 |
| Cho Y S, Kim B S, Kim D S et al, 2012. Modulation of warm-temperature-acclimation-associated 65-kDa protein genes(Wap65-1 and Wap65-2) in mud loach(Misgurnus mizolepis, Cypriniformes) liver in response to different stimulatory treatments. Fish Shellfish Immunol, 32(5):662-669 |
| Choi C Y, An K W, Choi Y K et al, 2008. Expression of warm temperature acclimation-related protein 65-kDa(Wap65) mRNA, and physiological changes with increasing water temperature in black porgy, Acanthopagrus schlegeli. J Exp Zool Part A:Ecol Genet Physiol, 309A(4):206-214 |
| Clark M S, Burns G, 2008. Characterisation of the warm acclimated protein gene(wap65) in the Antarctic plunderfish(Harpagifer antarcticus). DNA Seq, 19(1):50-55 |
| George S, Gubbins M, MacIntosh A et al, 2004. A comparison of pollutant biomarker responses with transcriptional responses in European flounders(Platicthys flesus) subjected to estuarine pollution. Mar Environ Res, 58(2-5):571-575 |
| Hayes R A, Regondi S, Winter M J et al, 2004. Cloning of a chub metallothionein cDNA and development of competitive RT-PCR of chub metallothionein mRNA as a potential biomarker of heavy metal exposure. Mar Environ Res, 58(2-5):665-669 |
| Hirayama M, Kobiyama A, Kinoshita S et al, 2004. The occurrence of two types of hemopexin-like protein in medaka and differences in their affinity to heme. J Exp Biol, 207:1387-1398 |
| Hirayama M, Nakaniwa M, Ikeda D et al, 2003. Primary structures and gene organizations of two types of Wap65 from the pufferfish Takifugu rubripes. Fish Physiol Biochem, 29(3):211-224 |
| Kikuchi K, Yamashita M, Watabe S et al, 1995. The warm temperature acclimation-related 65-kDa protein, Wap65, in goldfish and its gene expression. J Biol Chem, 270(29):17087-17092 |
| Morgan W T, Muster P, Tatum F et al, 1993. Identification of the histidine residues of hemopexin that coordinate with heme-iron and of a receptor-binding region. J Biol Chem, 268:6256-6262 |
| Nikkila H, Gitlin J D, Muller-Eberhard U, 1991. Rat hemopexin. Molecular cloning, primary structural characterization, and analysis of gene expression. Biochemistry, 30(3):823-829 |
| Peatman E, Terhune J, Baoprasertkul P et al, 2008. Microarray analysis of gene expression in the blue catfish liver reveals early activation of the MHC class I pathway after infection with Edwardsiella ictaluri. Mol Immunol, 45(2):553-566 |
| Sarropoulou E, Fernandes J M O, Mitter K et al, 2010. Evolution of a multifunctional gene:the warm temperature acclimation protein Wap65 in the European seabass Dicentrarchus labrax. Mol Phylogenet Evol, 55(2):640-649 |
| Sha Z X, Xu P, Takano T et al 2008. The warm temperature acclimation protein Wap65 as an immune response gene:its duplicates are differentially regulated by temperature and bacterial infections. Mol Immunol, 45(5):1458-1469 |
| Shi Y H, Chen J, Li C H et al, 2010. Molecular cloning of liver Wap65 cDNA in ayu(Plecoglossus altivelis) and mRNA expression changes following Listonella anguillarum infection. Mol Biol Rep, 37(3):1523-1529 |
| Tolosano E, Altruda F, 2002. Hemopexin:structure, function, and regulation. DNA Cell Biol, 21(4):297-306 |
 2015, Vol. 46
2015, Vol. 46


