中国海洋湖沼学会主办。
文章信息
- 陈晓聪, 张冉, 李成华, 包永波. 2015.
- CHEN Xiao-Cong, ZHANG Ran, LI Cheng-Hua, BAO Yong-Bo. 2015.
- 菲律宾蛤仔(Venerupis philippinarum)对重金属Hg2+的富集及相关生物标记物的识别
- MERCURY BIOACCUMULATION AND BIOMARKERS IDENTIFICATION IN MERCURY EXPOSED VENERUPIS PHILIPPINARUM
- 海洋与湖沼, 46(4): 928-936
- Oceanologia et Limnologia Sinica, 46(4): 928-936.
- http://dx.doi.org/10.11693/hyhz20150100010
-
文章历史
- 收稿日期:2015-01-13
- 改回日期:2015-02-10
2. 浙江万里学院 浙江省水产种质资源高效利用技术研究重点实验室 宁波 315100
2. Zhejiang Wanli University, Zhejiang Key Laboratory of Aquatic Germplasm Resources, Ningbo 315100, China
近年来,随着工农业经济的迅猛发展,海洋环境质量恶化的总趋势依然严峻。重金属污染物污染以其快速扩散和蔓延能力、难以降解的特性以及通过食物链富集和放大的效应而逐渐成为全球性的环境污染研究热点(Jiang et al,2006)。汞(Hg)作为环境中毒性最强的重金属元素之一,在我国近海海域广泛存在,部分海区汞浓度已高达100 μg/L,是Ⅰ类海水2000倍,汞污染对生态系统及人类健康威胁严重(Liu et al,2011)。
研究发现,海洋中的汞可通过食物链经由海洋生物进入人体,产生慢性汞中毒,严重者可出现神经紊乱、痴呆等(王冬梅等,2001)。因此开发效应快、灵敏度高、特异性强的生物标记物是实现海洋汞污染快速检测的前提。海洋双壳贝类营埋栖生活、通过滤食摄食、代谢率低,对海洋污染物具有很强的生物富集作用,是理想的海洋环境监测指示生物(Moraga et al,2002; Irato et al,2003)。菲律宾蛤仔(Venerupis philippinarum)以其地理分布广、是沿海海区的优势种、生物体能累积污染物、能对多种环境污染物产生响应等特点被人们广泛的应用于污染物检测和预警研究中。蛤仔拥有开放式的循环系统,当受到环境胁迫时,血淋巴细胞参与细胞免疫发挥防御作用。鳃作为蛤仔的呼吸器官,直接与环境污染物接触。实验选取的鳃和血细胞是研究环境毒理的理想组织(Zanette et al,2008; Bouki et al,2013)。
本文根据目前我国近海重金属汞污染现状,选取近海养殖重要经济贝类菲律宾蛤仔为研究对象,采用微波消解-原子荧光技术测定了鳃组织中重金属汞的短期的富集效应,并借助定量PCR分析相关基因包括抗氧化酶CAT、GST、GPx,药物/毒物代谢酶 CYP414A1,抗氧化蛋白分子Trx、MT、HSP70以及Lysozyme在汞胁迫下的表达模式,探索菲律宾蛤仔应对污染物的解毒机制,筛选应用于海洋环境汞污染的生物标记物。
1 材料与方法 1.1 材料 1.1.1 实验动物成体蛤仔[壳长(3.5±0.14)cm,壳宽(2.0±0.22)cm]采集于浙江省宁波市某养殖厂,实验开始前于温度为(20±1)°C、盐度为22的海水。实验中所用到的海水均采集于远离工业和生活区的近海海域,属于Ⅰ类海水,Hg浓度均低于检出限。充气暂养5天,定时换水,保持良好水质。
1.1.2 药品氯化汞、硼氢化钾、氢氧化钾均为分析纯,硫酸、盐酸、高锰酸钾均为优级纯,高纯氩气,测定用水为Miili Q水,汞标准储备液为100 μg/L(由宁波市海洋与渔业研究院提供); RNAiso plus,SYBR Premix Ex TaqTMⅡ(TaKaRa公司); MMLV First Str and cDNA Synthesis Kit(生工公司); 引物由上海生工生物工程有限公司合成。
1.2.3 仪器AFS-230E双道原子荧光光度计(北京海光仪器),MARS6微波消解仪(美国CEM),超纯水系统(德国Millipore),Rotor-Gene 6000实时定量荧光PCR仪(德国QIAGEN)。
1.2 方法 1.2.1 汞胁迫实验准确称取一定量的HgCl2粉末配制成浓度为1 g/L的Hg2+母液,保存备用。量取适当体积的母液,制备浓度为2.5、5、7.5和10 μg/L四个暴露剂量(不包括水体Hg2+本底值)。实验水体30L,每箱60只蛤仔,分别在实验开始的0 h、24 h和48 h进行取样,每箱取10只个体解剖后取鳃和血细胞进行后续实验。每组样品设置3个平行样本,所有样品均于超低温冰箱中保存。
1.2.2 原子荧光法测定汞含量按照《海洋监测规范》(GB 17378.6-2007)中原子荧光光谱法测定总汞方法进行。将1 g鳃组织待测样品转入消解罐内,加入4 mL浓硝酸先于电热板上消解30 min。待反应趋于平稳后,冷却使气体逸出。然后放入微波消解仪腔体内消解30 min。完毕后,冷却至室温,用MilliQ水冲洗容器壁,将液体转移至25 mL容量瓶中定容后待测。配制标准系列(0,0.10,0.25,0.50,1.00 μg/L),用于标准曲线制定。仪器的工作参数为光电倍增管负高压: 280 V; 灯电流: 15 mA; 原子化器高度: 8mm; 载气流量: 400 mL/min; 屏蔽气流量: 800mL/min; 读数时间: 10 s; 延迟时间: 1 s; 重复次数: 1; 测量方法: Std. Curve; 读数方式: Peak Area。用原子荧光光谱仪按上述给定条件进行设定,预热30min,待仪器稳定后进行标准品与实验样品的测定,并自动绘制标准曲线,由已绘制的标准曲线可读出样品溶液中汞元素的含量。当汞含量为0.052×10-6mg/L时,测定的再现性相对标准偏差为8%; 平均相对误差为1%; 重复性相对标准偏差为5%。本实验所用所有器皿,使用前均用15% 硝酸浸泡24 h,MilliQ水洗净后使用。
1.2.3 菲律宾蛤仔解毒代谢基因mRNA表达分析利用Trizol方法获得总RNA,琼脂糖凝胶电泳检测RNA的完整性,分光光度计测定RNA浓度,取3 μg进行cDNA合成,具体步骤参照上海生工生物工程有限公司MMLV第一链cDNA合成试剂盒说明书(BS250)。用荧光定量PCR检测菲律宾蛤仔CAT、GST、GPx、CYP414A1、Trx、MT、HSP70、Lysozyme基因的表达差异。采用β-actin作为内参基因(Li et al,2011),实验所用引物序列见表 1。PCR循环条件: 94°C预变性5min、94°C变性15s、60°C退火15s、72°C 延伸20s,共40个循环。PCR反应结束后,首先进行溶解曲线分析,确认反应的特异性,再用Rotor-Gene的软件进行CT值分析,采用2−ΔΔCT法确定不同时段各个基因mRNA的相对表达量(Livak et al,2001)。
| 引物 | 序列 | 产物长度(bp) | 基因ID |
| β-actin(forward) | CTCCCTTGAGAAGAGCTACGA | 121 | EF520696.1 |
| β-actin(reverse) | GATACCAGCAGATTCCATACCC | ||
| CAT(forward) | GGCTGGTGATTTGGCAGGTA | 64 | EF520699.1 |
| CAT(reverse) | GGCGATGGCATTGTAAAGGT | ||
| Trx(forward) | GGACGTTGATGATGTTTCGGAGGT | 125 | JF499393 |
| Trx(reverse) | TTTCCAGTTCATCAGCATCAGCCC | ||
| CYP414A1(forward) | AGGACCGAGGTCATGTTTAG | 147 | HQ234335 |
| CYP414A1(reverse) | GGATTTAGAGTTGTCGCCAG | ||
| MT(forward) | CATGCGACTGTGCTGAAACTGG | 157 | EF520701.1 |
| MT(reverse) | TGTCCACAGGCACATGAACCAT | ||
| GST A(forward) | CATTGCCCGTGCTTACTATTGAC | 207 | GQ384392 |
| GST A(reverse) | TGTTCCTTTCTTCCTCGTTATCC | ||
| GPx A(forward) | AGTGGAGAAGGACTCAAAGGGAC | 192 | GQ384395.1 |
| GPx A(reverse) | CTCTTCCAGTTAGCTGGTGTTGC | ||
| HSP70(forward) | AGAGCGGTATTCACGAGATTGT | 213 | KJ569079.1 |
| HSP70(reverse) | GAGGTGTTACGTCCAACAGGAG | ||
| Lysomyze(forward) | ATTCTTTCGCAGCACTTTCGTTG | 253 | GQ384413 |
| Lysomyze(reverse) | ACCCGGTTTACCGCAGTCTATC |
实验数据用统计学方法进行处理,所有实验结果均以平均值±标准偏差(Mean±SD)给出。采用SPSS 19.0统计分析软件通过单因素方差分析(One-Way AVONA)和Duncan检验法进行各浓度处理组与对照组差异的显著性检验,P<0.05表示有显著性差异,P<0.01表示有极显著差异。
2 结果2.1 菲律宾蛤仔对汞的富集结果
2.1.1 标准曲线
按实验方法利用汞的标准系列测得汞浓度(C)与其吸光值(If)呈良好的曲线关系,建立线性回归方程为: If = 132.765 C-2.137,该方程相关系数r2 = 0.9993。
2.1.2 菲律宾蛤仔对汞的富集菲律宾蛤仔鳃组织中Hg2+的富集结果如图 1所示。不同暴露剂量下,所有检测样品均呈现时间依赖性的增长模式,在同一时间点的不同暴露剂量组,则表现为浓度依赖性的富集效应。2.5 μg/L和7.5 μg/L 24 h处理组对Hg2+的富集与对照组呈现显著差异(P<0.05),在5 μg/L和10 μg/L处理24 h时与对照组呈极显著差异(P<0.01)。48 h处理组5、7.5、10 μg/L均与对照组呈现极显著差异,并在10 μg/L组达到(0.308±0.037)μg/g的最高富集量,为对照组的21倍(P<0.01)。
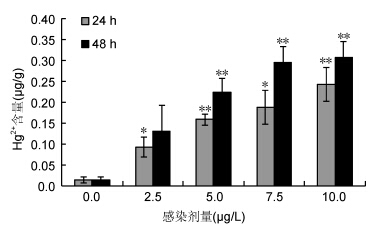 |
| 图 1 汞胁迫菲律宾蛤仔鳃组织中Hg2+含量 Fig. 1Hg2+ content in gill tissue of V. philippinarum after exposure to different doses of Hg2+ |
鳃CYP414A1和GPx基因表达结果如图 2所示。在24 h各处理组中鳃CYP414A1基因只在2.5 μg/L处理组表达显著上调,鳃GPx基因只在48 h 2.5 μg/L处理组表达显著上调(P<0.05),2.5 μg/L处理组表达变化的结果与对照组和其它处理组均呈现显著性差异。
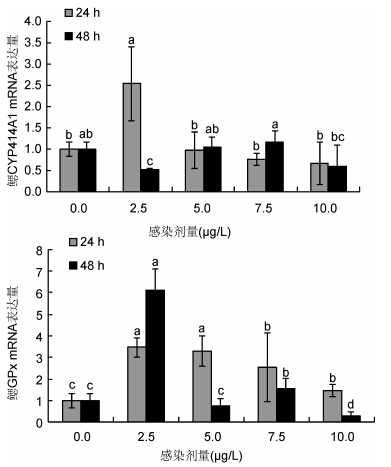 |
| 图 2 汞胁迫菲律宾蛤仔鳃中CYP414A1、GPx基因mRNA表达模式 Fig. 2 Expression profiles of CYP414A1,GPx in gill of V. philippinarum after exposure to different doses of Hg2+ |
鳃Lysozyme和HSP70基因表达结果如图 3所示。鳃Lysozyme基因在24 h 7.5 μg/L处理组较其它处理组表达显著上调,上调倍数为2.59,其它各组之间均无显著差异。鳃HSP70基因只在48 h 7.5μg/L处理组中显著下调(P<0.05)。
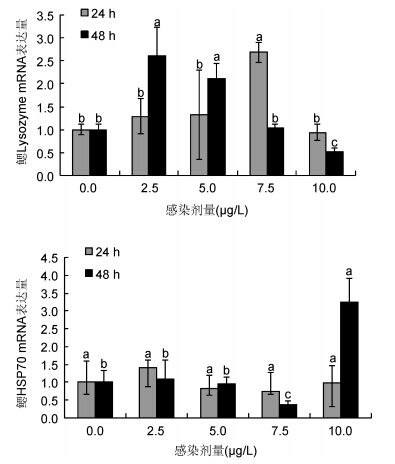 |
| 图 3 汞胁迫菲律宾蛤仔鳃中Lysozyme、HSP70基因mRNA表达模式 Fig. 3 Expression profiles of Lysozyme and HSP70 in gill of V. philippinarum after exposure to different doses of Hg2+ |
图 4所示为汞胁迫24 h和48 h鳃和血细胞中HSP70基因的表达结果。血细胞中HSP70在24 h处理组中,仅在10 μg/L时表达显著上调,其它处理之间无显著差异。鳃中HSP70则在胁迫到48 h时,在10 μg/L组表达显著上调(P<0.05)。
 |
| 图 4 汞胁迫菲律宾蛤仔鳃HSP70和血细胞HSP70基因mRNA表达模式 Fig. 4 Expression patterns of HSP70 in gill and hemocytes of V. philippinarum after exposure to different doses of Hg2+ |
图 5为Hg2+影响菲律宾蛤仔鳃中CAT、GST、Trx和MT基因表达的结果。由图 5可知: 菲律宾蛤仔鳃组织中的CAT和GST基因的表达模式均呈现“诱导—抑制”的趋势,与Hg2+浓度呈现负相关。2.5 μg/L Hg2+处理组,CAT和GST基因表达极显著上调(P<0.01)。同时,CAT在48 h 7.5 μg/L组2.36倍上调表达(P<0.05)。在10 μg/L Hg2+处理组中,CAT基因的表达量下降到与对照组相近水平,GST基因表达受到明显抑制下调0.33倍(P<0.01)。MT基因的表达模式呈现“倒抛物线”的趋势,且24 h处理组的表达量均高于48 h处理组。Trx基因在24 h的2.5和7.5 μg/L处理组中表达上调,48 h的10 μg/L处理组中表达显著下调(P<0.01),其它组与对照组无显著差异。
 |
| 图 5 汞胁迫菲律宾蛤仔鳃CAT、GST、MT和Trx基因mRNA表达模式 Fig. 5 Expression patterns of CAT,GST,MT and Trx in gill of V. philippinarum after exposure to different doses of Hg2+ |
如图 6所示,Hg2+胁迫菲律宾蛤仔血细胞中7个基因的表达结果,其中CYP414A1和CAT基因在48 h的7.5μg/L和10μg/L处理组织显著上调,其它浓度处理组的表达结果与对照组无显著差异。GST和GPx在胁迫发生后表达显著上调,Lysozyme和MT基因表达在所有处理组中均显著上调,并且48 h的表达量均高于24 h(P<0.01)。Trx基因与其它基因不同,呈现下调趋势,在5 μg/L 48 h处理组中表达量最低,是对照组的0.21倍(P<0.01)。
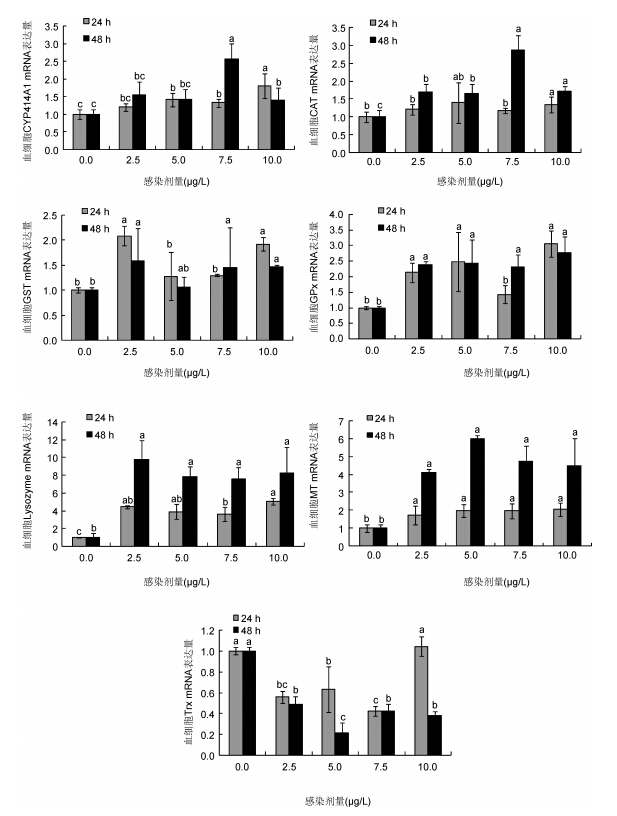 |
| 图 6 汞胁迫菲律宾蛤仔血细胞CYP414A1、CAT、GST、GPx、Lysozyme、MT和Trx基因mRNA表达模式 Fig. 6 Expression patterns of CYP414A1,CAT,GST,GPx,Lysozyme,MT and Trx in hemocytes of V. philippinarum after exposure to different doses of Hg2+ |
本文以菲律宾蛤仔为对象检测了重金属汞的胁迫下鳃组织的富集效应,研究发现鳃组织对汞的富集作用呈现时间依赖性和浓度依赖性,在10 μg/L剂量组处理48 h时达到(0.308±0.037)μg/g的最高富集量。这种富集作用主要通过呼吸作用将重金属在鳃处滞留,再借助被动吸收、胞饮或内吞作用等方式向细胞内转运,积累和放大(励建荣等,2007)。研究发现不同水生动物对重金属的富集能力存在差异,其中贝类对重金属的富集系数远远大于虾类、鱼类(阮金山等,2000)。贝类的不同组织和不同器官对重金属的富集也有差异,崔可铎等(1987)报道了5种金属在毛蚶(Scapharca subcrenata)体内的积累情况为: 鳃>外套膜>闭壳肌>内脏>肌肉。蔡立哲等(1999)指出Zn、Pb在菲律宾蛤仔两种器官的浓集系数大小顺序为: 鳃>软体部。苑旭洲等(2012)对菲律宾蛤仔全组织汞富集测定发现在1.0 μg/L的高浓度处理组菲律宾蛤仔体内Hg的最大含量是0.027 μg/g。上述差异可能由于选择的组织类型、暴露剂量和暴露时间的不同引起的,此外,重金属的富集还受到生物个体大小、性别、年龄、繁殖状态及水体盐度、温度、pH值等诸多因素的影响,致使同种种类生物的富集作用也有所差异(王召根等,2013)。
已有研究表明,重金属在海洋生物体内富集可诱导产生大量的活性氧自由基,如H2O2、O2-、·OH等,破坏生物体内的活性氧平衡,进而引起生物体的氧化损伤(Regoli et al,2014)。机体抗氧化防御系统是保障重金属污染胁迫造成的活性氧平衡的重要调节体系,因而常被作为监测海洋重金属污染物的候选生物标记物(Winston et al,1991)。Regoli等(2014)指出海洋生物的氧化应激通路中,过氧化氢酶(CAT)是防止ROS分子形成必不可少的分子。CAT的主要作用就是催化H2O2分解为H2O与O2,使得H2O2不至于与O2在铁螯合物作用下反应生成非常有害的HO·。谷胱甘肽过氧化物酶(GPx)则利用H2O2将还原型谷胱甘肽(GSH)氧化成氧化型谷胱甘肽(GSSG),使H2O2还原成无毒的羟基化合物,从而降低H2O2浓度。谷胱甘肽硫转移酶(GST)作为第二阶段解毒酶可
催化污染物与GSH 结合,生成极性小分子物质从而减轻其毒性(闫博等,2007)。汞胁迫下蛤仔鳃组织中CAT、GPx和GST基因均呈现先诱导后抑制的表达模式,这种在低剂量表现为刺激效应,而高剂量则表现为抑制效应的模式称为“毒物兴奋效应”(顾海龙等,2013)。而血细胞中CAT、GPx和GST基因则呈现上调的模式,这可能由于血细胞和鳃的生理功能不同而存在差异。有研究证实Cd胁迫下贻贝(Mytilus galloprovincialis)的GST基因表达被上调,野外站点采集的贻贝GST基因表达的水平与实际环境中污染状况间相关性良好(Hoarau et al,2006),Hg胁迫下蛤仔血细胞中GST基因表达上调与上述结果一致。Zhang等(2012)利用RACE PCR技术克隆了菲律宾蛤仔中一种新型的细胞色素P450,命名为CYP414A1。并研究了在苯并[α]芘、镉和铜胁迫下其mRNA的相对表达量,镉胁迫条件下表达量明显上调,铜胁迫条件下表达量明显下调,为CYP414A1作为分子标记物研究提供了基础。汞胁迫下蛤仔血细胞和鳃中CYP414A1的表达均呈现上调趋势与镉胁迫结果一致。
除抗氧化酶外,金属硫蛋白(MT)、硫氧还蛋白(Trx)和热休克蛋白(HSP70)等参与生物体的重金属解毒和自由基清除等修复作用的蛋白分子也广泛用于生物标记物的研究(Bierkens et al,1998; Cosson,2000; Jikimoto et al,2002)。在关于Cd和Cu胁迫菲律宾蛤仔的报道中指出,Trx在肝胰腺中均呈现上调趋势(Wang et al,2011),本研究中汞胁迫下鳃和血细胞中Trx的表达模式不相同,血细胞中呈现下调趋势,鳃中呈现上调趋势,说明Trx在不同组织中对不同重金属的响应存在差异。霍礼辉等(2012)研究了在不同浓度重金属Cd2+胁迫条件下,缢蛏内脏团中MT mRNA的诱导表达具有明显的剂量效应和时间效应,呈现脉冲式波动。汞胁迫下蛤仔鳃组织中MT的表达模式也呈现脉冲式波动,血细胞中MT的表达模式则呈现了良好的时间效应,并且所有处理组MT的表达相对于对照组均显著上调(P<0.05)。说明汞的胁迫使MT大量表达参与解毒,MT mRNA表达变化可以作为指示环境重金属污染的一个良好的生物参考指标。当机体遇到重金属胁迫等刺激时,HSP70可通过防止蛋白的凝聚及变性,维持细胞内环境稳定,增强机体抗刺激及生存能力(Morimoto et al,1992)。本研究中鳃和血细胞中HSP70的表达量在高浓度处理组显著上调,说明HSP70表达量增加用来维护机体的正常生理活动。溶酶体是累积重金属的主要场所,过量的重金属离子进入生物体内会改变溶酶体膜的通透性,造成大量酶的释放。溶菌酶(Lysozyme)是贝类中研究最多的溶酶体酶,它可以降解细胞外病原生物,起到机体免疫防御的功能。研究表明,重金属能够改变鱼类溶菌酶活性(Wu et al,2007),而di(2-ethylhexyl)phthalate(DEHP)的胁迫能够引起菲律宾蛤仔溶菌酶基因表达量的变化(Lu et al,2013)。因此,溶菌酶是一种对外源胁迫较为敏感的响应成分。汞胁迫对金鱼(Carassius auratus)胚胎发育的影响的研究中发现,溶菌酶的活力被诱导,并呈现明显的浓度依赖型(Kong et al,2012)。本研究中蛤仔血细胞中Lysozyme基因在所以处理组均表达上调,对汞胁迫响应灵敏,与上述观点一致。
研究中各基因的表达变化则说明蛤仔的抗氧化防御系统参与清除Hg2+的胁迫产生的氧化损伤。目前,国内外学者认为组合型的生物标记物能更加准确、全面的评价重金属的毒性作用。本研究在实验室条件下设置一系列Hg2+处理浓度,利用实时定量PCR技术检测了菲律宾蛤仔鳃和血细胞中8种不同功能基因的mRNA表达变化,从中选择可指示汞污染的基因作为潜在的生物标记物。从筛选结果中看出,鳃CYP414A1和GPx基因、鳃Lysozyme和HSP70基因、鳃和血细胞HSP70基因,可分别指示2.5、7.5、10 μg/L不同浓度的汞污染,基本符合生物标记物评价要求,并且上述基因可作为组合型的生物标记物增加了检测的准确性。鳃和血细胞中其它基因的表达结果可以看出各基因对汞胁迫作出响应,但响应结果不符合生物标记物的筛选原则,不能作为指示汞污染的生物标记物。
综上所述,本研究在实验室条件下筛选了一批用于指示海洋汞污染的菲律宾蛤仔分子生物标记物,明确了各生物标记物基因表达模式,表明这些分子生物标记物可作为组合型生物标记物较有效地反映海洋环境汞污染状况,与汞在蛤仔体内富集的数据相结合,增加了一系列生物标记物共同指示海洋环境中汞污染的可行性。
| 王冬梅, 冯 军, 2001.锦州市近岸海域汞污染状况调查及防治对策.辽宁工学院学报, 21(3): 58-59 |
| 王召根, 吴洪喜, 陈肖肖等, 2013.年龄和环境条件对泥蚶富集重金属镉和铜的影响.生态学报, 33(21): 6869-6875 |
| 闫 博, 王 兰, 李涌泉等, 2007.镉对长江华溪蟹肝胰腺抗氧化酶活力的影响.动物学报, 53(6): 1121-1128 |
| 阮金山, 许翠娅, 罗冬莲, 2000.福建兴化湾海水、沉积物及水产生物体内重金属的分析与评价.热带海洋, 19(1): 52-57 |
| 励建荣, 李学鹏, 王丽等, 2007.贝类对重金属的吸收转运与累积规律研究进展.水产科学, 26(1): 51-55 |
| 苑旭洲, 崔 毅, 陈碧鹃等, 2012.菲律宾蛤仔对6种重金属的生物富集动力学.渔业科学进展, 33(4): 49-56 |
| 顾海龙, 沈伟良, 孙长森等, 2013.低浓度Cd2+长期胁迫对泥蚶抗氧化防御系统及MDA含量的影响.海洋环境科学, 32(5): 741-745 |
| 崔可铎, 吴玉霖, 赵鸿懦等, 1987.镉、铜、铅、镍、铬在毛蚶体内累积、分布和排出的实验研究.海洋科学集刊, (28): 97-107 |
| 蔡立哲, 洪华生, 洪丽玉, 1999.菲律宾蛤仔对锌、铅的积累特征.环境科学学报, 19(3): 319-322 |
| 霍礼辉, 陈彩芳, 林志华等, 2012.镉诱导缢蛏(Sinonovacula constricta)体内金属硫蛋白基因变化规律研究.海洋与湖沼, 43(4): 723-728 |
| Bierkens J, Maes J, Plaetse F V, 1998.Dose-dependent induction of heat shock protein 70 synthesis in Raphidocelis subcapitata following exposure to different classes of environmental pollutants.Environmental Pollution, 101(1): 91-97 |
| Bouki E, Dimitriadis V K, Kaloyianni M et al, 2013.Antioxidant and pro-oxidant challenge of tannic acid in mussel hemocytes exposed to cadmium.Marine Environmental Research, 85: 13-20 |
| Cosson R P, 2000.Bivalve metallothionein as a biomarker of aquatic ecosystem pollution by trace metals: limits and perspectives.Cellular and Molecular Biology (Noisy-le-Grand, France), 46(2): 295-309 |
| Hoarau P, Damiens G, Roméo M et al, 2006.Cloning and expression of a GST-pi gene in Mytilus galloprovincialis.Attempt to use the GST-pi transcript as a biomarker of pollution.Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 143(2): 196-203 |
| Irato P, Santovito G, Cassini A et al, 2003.Metal accumulation and binding protein induction in Mytilus galloprovincialis, Scapharca inaequivalvis, and Tapes philippinarum from the Lagoon of Venice.Archives of Environmental Contamination and Toxicology, 44(4): 476-484 |
| Jiang G B, Shi J B, Feng X B, 2006.Mercury pollution in China.An overview of the past and current sources of the toxic metal.Environmental Science & Technology, 40(12): 3672-3678 |
| Jikimoto T, Nishikubo Y, Koshiba M et al, 2002.Thioredoxin as a biomarker for oxidative stress in patients with rheumatoid arthritis.Molecular Immunology, 38(10): 765-772 |
| Kong X H, Wang S P, Jiang H X et al, 2012.Responses of acid/alkaline phosphatase, lysozyme, and catalase activities and lipid peroxidation to mercury exposure during the embryonic development of goldfish Carassius auratus.Aquatic Toxicology, 120-121: 119-125 |
| Li C H, Li H, Su X R et al, 2011.Identification and characterization of a clam ferritin from Sinonovacula constricta.Fish & Shellfish Immunology, 30(4-5): 1147-1151 |
| Liu X L, Zhang L B, You L P et al, 2011.Toxicological responses to acute mercury exposure for three species of Manila clam Ruditapes philippinarum by NMR-based metabolomics.Environmental Toxicology and Pharmacology, 31(2): 323-332 |
| Livak K J, Schmittgen T D, 2001.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method.Methods, 25(4): 402-408 |
| Lu Y L, Zhang P, Li C H et al, 2013.Characterisation of immune-related gene expression in clam (Venerupis philippinarum) under exposure to di(2-ethylhexyl) phthalate.Fish & Shellfish Immunology, 34(1): 142-146 |
| Moraga D, Mdelgi-Lasram E, Romdhane M S et al, 2002.Genetic responses to metal contamination in two clams: Ruditapes decussatus and Ruditapes philippinarum.Marine Environmental Research, 54(3-5): 521-525 |
| Morimoto R I, Sarge K D, Abravaya K, 1992.Transcriptional regulation of heat shock genes.A paradigm for inducible genomic responses.Journal of Biological Chemistry, 267(31): 21987-21990 |
| Regoli F, Giuliani M E, 2014.Oxidative pathways of chemical toxicity and oxidative stress biomarkers in marine organisms.Marine Environmental Research, 93: 106-117 |
| Wang Q, Ning X X, Chen L L et al, 2011.Responses of thioredoxin 1 and thioredoxin-related protein 14 mRNAs to cadmium and copper stresses in Venerupis philippinarum.Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 154(3): 154-160 |
| Winston G W, Di Giulio R T, 1991.Prooxidant and antioxidant mechanisms in aquatic organisms.Aquatic Toxicology, 19(2): 137-161 |
| Wu S M, Shih M-J, Ho Y-C, 2007.Toxicological stress response and cadmium distribution in hybrid tilapia (Oreochromis sp.) upon cadmium exposure.Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 145(2): 218-226 |
| Zanette J, Nunes F F, Medeiros I D et al, 2008.Comparison of the antioxidant defense system in Crassostrea rhizophorae and Crassostrea gigas exposed to domestic sewage discharges.Marine Environmental Research, 66(1): 196-198 |
| Zhang L B, Gan J L, Ke C L et al, 2012.Identification and expression profile of a new cytochrome P450 isoform (CYP414A1) in the hepatopancreas of Venerupis (Ruditapes) philippinarum exposed to benzo[a]pyrene, cadmium and copper.Environmental Toxicology and Pharmacology, 33(1): 85-91 |
 2015, Vol. 46
2015, Vol. 46


