中国海洋湖沼学会主办。
文章信息
- 户国, 谷伟, 孙鹏, 白庆利, 王炳谦. 2015.
- HU Guo, GU Wei, SUN Peng, BAI Qing-Li, WANG Bing-Qian. 2015.
- 大规格虹鳟(Oncorhynchus mykiss)收获期主要生长性状显性效应的遗传分析
- ESTIMATION ON DOMINANCE EFFECTS FOR BODY WEIGHT AND MEASUREMENT TRAITS AT HARVEST IN LARGE-SIZE RAINBOW TROUT ONCORHYNCHUS MYKISS
- 海洋与湖沼, 46(4): 922-927
- Oceanologia et Limnologia Sinica, 46(4): 922-927.
- http://dx.doi.org/10.11693/hyhz20140800218
-
文章历史
- 收稿日期:2014-08-15
- 改回日期:2014-10-09
家养动物经济性状形成的遗传学机理非常复杂,参与这类表型形成的因素往往涉及同一位点上等位基因产生的加性效应(additive effect)和显性效应(dominance effect)、不同位点上非等位基因交互作用产生的上位效应(epistatic effect)以及遗传与环境的交互作用(genetics-environment interaction)(户国等,2012a,b)。对复杂经济性状的遗传组成进行充分的剖分解析对理解家养动物遗传选育群体的表型变化的遗传学机理具有重要意义(户国等,2010)。显性效应等非加性效应的方差组分剖分方法较为复杂,且对实验群体样本量需求较大,计算量很大,但是,考虑显性效应可以在遗传评估模型中获得更准确动物个体估计育种值,更精确的遗传力和选择反应估计值,也有助于在具体的育种规划中育种方案和选择策略的制定。随着数量遗传学理论和相关计算软件的不断发展,人们逐渐得以对显性效应展开深入研究,在乳牛和家禽中陆续发现了一些重要经济性状遗传变异方差中存在着显著的显性效应方差组分(Miglior et al,1995; Misztal,1997; Misztal et al,2000)。
鱼类育种者也开始借助数量遗传学方法对重要经济性状进行遗传剖分,并取得了切实的研究结果。在鱼类,尤其是主要养殖鲑科鱼类中,显性效应是生长性状的一个重要的遗传方差来源(Gall,1975; Gjedrem,1983,1992)。例如,对挪威海水养殖虹鳟收获期体质量的显性方差占总方差的比率介于0—0.22(Pante et al,2002); 大西洋鲑(Salmo salar)收获期体质量的显性方差占总方差的比率介于0.02—0.18(Gjerde et al,1984); 大鳞大麻哈鱼(Oncorhynchus tshawytscha)在淡水和海水养殖体质量的显性效应占总方差的比率介于0.08—0.27(Winkelman et al,1994a,b)。因此,对我国虹鳟选育群体体质量性状显性遗传方差组分的准确剖分对理解虹鳟生长性状形成的数量遗传学基础,培育生长快速的大规格虹鳟品种具有积极意义。
在中国市场,由于消费者的传统饮食习惯和新兴对刺身等食用方式的开发,对大规格虹鳟的消费需求日益提高,体型和规格相关性状的经济意义逐渐提高。虹鳟是典型的冷水性鱼类,受限于水温,海水养殖虹鳟我国主要海区度夏存在困难,所以我国沿海天然水域尚无商业规模的虹鳟养殖,我国的大规格虹鳟生产是以淡水养殖为主(王炳谦等,2012)。本研究采用虹鳟优良品系G2选育群体作为试验材料,于1000日龄采集体质量、头长、体长、体宽和体厚等5个主要生长性状的表型数据,采用了平均信息约束最大似然法(Average Information Restricted Maximum Likelihood,AIREML)估计了上述5个性状的加性、显性遗传方差组分,并计算了加性遗传力(h2)、显性方差组分比率(d2),为更深入地理解大规格虹鳟主要生长性状的数量遗传学基础提供数据支持。
1 材料与方法 1.1 试验群体的家系建立及饲养管理本研究中实验群体养殖在中国水产科学研究院黑龙江水产研究所渤海冷水性鱼试验站,位置坐落于镜泊湖(44.02°N,128.74°E)附近。基础群体(G0)由中国渤海品系(由朝鲜品系与日本品系群体混杂形成的品系)、丹麦品系(来自丹麦的一个商业品系)、挪威品系(来自挪威的一个商业品系)、道氏品系(美国道尔纳逊氏优质虹鳟)和加州品系(来自美国加州的一个商业品系)等5个地理远缘品系于2001年通过完全双列杂交技术建立(户国等,2012a,b; Hu et al,2013)。上述五个群体没有系谱记录信息,但采用微卫星标记进行了遗传分析,以确保组建基础群体个体间没有亲缘关系(王炳谦等,2009),然后闭锁群体,且世代之间没有重叠,G1群体构建于2004年,G2群体构建于2007年,本研究所涉及的G2实验群体是G1群体根据2龄体重BLUP育种值排序选定的75组亲本建立的75个全同胞家系。在卵黄囊吸收,仔鱼上浮后(约30—35天)按照家系分别培养在独立选育缸饲养至50 g以上,植入PIT电子标记后放入流水混凝土池混合养殖。水源使用天然涌泉水,周年水温变化范围在5—18°C,流量20—30 L/s,氧分压7—11 mg/L,饲养管理按照SalmonFood公司Vitacare饲料投喂指南要求进行。
1.2 性状测定鱼种于2008年4月入池至2010年11月下旬养殖至性成熟,期间于2010年9月约1000日龄测定体质量(body weight)、头长(head length)、体长(body length)、体宽(body depth)、体厚(body thickness)等性状,将待测虹鳟用苯氧乙醇0.5mg/L麻醉后,利用电子秤测量虹鳟体质量(精确到0.1 g),同时依第二性征记录性别。本研究中以PIT电子标记作为区分个体的方法,共计获得了70个全同胞家系中的1972尾个体的表型数据,上述个体均具有详细清晰的系谱记录。
1.3 数据统计分析本研究中采用混合线性模型估计遗传方差组分,为确认加性效应和显性效应等组分,构建了如下2个混合线性模型:
其中,y是动物个体表型观察值向量,a是个体随机加性效应向量,b是固定效应向量,包含池塘、性别以及父母本品系来源,d是显性效应向量,X、Z1、Z2是相应的关联矩阵,e是随机残差向量。模型(1)是只含有加性效应的动物模型; 模型(2)是含有加性效应和显性效应的动物模型。
在模型(2)中,a、d、e和y的数学期望分别为,E(a)=0,E(d)=0,E(e)=0和E(y)=Xb; a、d、e和y的方差分别为$Var\left[ {\begin{array}{*{20}{c}} {\bf{a}}\\ {\bf{d}}\\ {\bf{e}} \end{array}} \right] = \left[ {\begin{array}{*{20}{c}} {{\bf{A}}\sigma _a^2}&0&0\\ 0&{0.25{\bf{D}}\sigma _d^2}&0\\ 0&0&{{\bf{I}}\sigma _e^2} \end{array}} \right]$和$Var[{\bf{y}}] = {\bf{A}}\sigma _a^2 + 0.25{\bf{D}}\sigma _d^2 + {\bf{I}}\sigma _e^2$。其中$\sigma _a^2$是加性效应方差,$\sigma _b^2$是显性效应方差,$\sigma _e^2$是随机残差方差,A是个体间加性遗传关系矩阵,D是个体间显性遗传关系矩阵,I是单位矩阵。在模型(1)中只要减去相应地变量组分即可,其它假设与全模型(2)相同。假设表型方差为$\sigma _p^2$,则各遗传组分占总方差的比率可以表示为加性方差组分$h_{}^2 = \frac{{\sigma _\alpha ^2}}{{\sigma _p^2}}$,显性离差组分为$d_{}^2 = \frac{{\sigma _d^2}}{{\sigma _p^2}}$。
本研究使用AIREMLF90软件(Misztal et al,2002),采用平均信息约束最大似然法(AIREML)获得模型的方差组分,然后将方差组分代入相应公式求得各遗传组分占表型方差比率及其标准误差,REML迭代收敛水平设为1×10-10,表型描述性统计分析使用JMP软件实现(Proust,2007)。
2 结果与分析 2.1 虹鳟主要生长性状的描述性统计本研究中测量了虹鳟优良品系选育群体G2群体1000日龄的体质量、头长、体长、体宽和体厚等主要生长性状的表型数据,结果显示,该群体主要生长性状的统计学分布符合正态分布,表型存在着较大的变异,其中体质量性状变异系数最大,为17.48%,体长变异系数最小,为6.94%,详细结果见表 1。对虹鳟体质量、体长和体厚等三个主要生长性状之间的关系也进行了考察,结果显示三个性状在三维空间上的散点分布也符合正态分布,同时,在该实验群体中存在较多体质量、体长和体厚性能表现都较为优秀的个体,有良好的育种价值(图 1)。
| 性状 | 均值 | 标准偏差(SD) | 最大值 | 最小值 | 变异系数(%) |
| 体质量 | 2704.99 | 472.77 | 4060.00 | 744.00 | 17.48 |
| 头长 | 10.23 | 1.30 | 14.60 | 6.47 | 12.68 |
| 体长 | 56.11 | 3.90 | 67.65 | 33.50 | 6.94 |
| 体宽 | 15.03 | 1.26 | 26.34 | 6.31 | 8.42 |
| 体厚 | 9.78 | 0.94 | 12.60 | 6.00 | 9.64 |
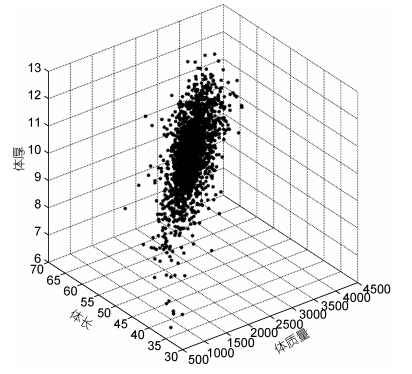 |
| 图 1 体质量、体长和体厚在三维空间的散点图 Fig. 1 The scatter plot for body weight,body length,and body thickness in three-dimensional space 图中各坐标轴数据均为无量纲,只单纯比较数据的散点空间分布 |
本研究首先利用只含有加性效应的单性状动物模型进行了试验群体1000日龄的体质量、头长、体长、体宽和体厚等5个主要生长性状的遗传方差剖分以及遗传力估计。本研究统计模型涉及池塘、性别以及父母本品系来源等三个固定效应,结果显示,其中体质量遗传力最高,为0.48; 其它体尺性状均为中等水平的遗传力,介于0.16—0.36。当统计模型中仅含有池塘、性别等两个固定效应时,主要体尺性状的遗传力0.131—0.313,两者结果较为一致(户国等,2014)。上述5个方差组分和遗传力估计的详细结果见表 2。
| 性状 | 加性方差$\sigma _a^2$ | 环境残差$\sigma _e^2$ | 狭义遗传力$h_a^2$ |
| 体质量 | 105600.00 | 116700.40 | 0.48 |
| 头长 | 0.25 | 0.78 | 0.24 |
| 体长 | 3.06 | 12.20 | 0.20 |
| 0.59 | 1.07 | 0.36 | |
| 体厚 | 0.13 | 0.67 | 0.16 |
在本研究中进一步采用了同时含有加性效应和显性效应的单性状动物模型估算同一试验群体1000日龄的体质量、头长、体长、体宽和体厚等5个主要生长性状的遗传方差、加性遗传力和显性方差组分比率。研究结果显示,与模型(1)相比,5个性状加性遗传力均有下降,体质量性状加性遗传力下降至0.42,体质性状加性遗传力下降至0.14—0.31之间,但是,模型改变后并没有改变各性状加性遗传力利用模型(1)获得估计值的排序关系。在模型(2)中,上述5个性状的显性方差组分比率介于0.24—0.67之间,均处于中等或较高水平。其中体长显性离差最低,为0.24,头长显性离差最高,为0.67。加性遗传力和显性方差组分比率加和所解释的方差组分占总表型方差组分的0.39—0.97,其中体宽性状几乎可以完全由遗传方差解释,该结果表明更为详尽的遗传方差剖分有助于对育种目标性状数量遗传学基础的更深入理解。模型(2)获得的加性效应和显性效应的方差组分估计结果详见表 3。
| 性状 | 加性方差 $\sigma _a^2$ | 显性离差 $\sigma _a^2$ | 环境残差 $\sigma _a^2$ | 加性遗传力 $h_d^2$ | 显性离差$h_d^2$ |
| 体质量 | 90069.00 | 86229.00 | 38294.00 | 0.42 | 0.40 |
| 头长 | 0.22 | 0.69 | 0.12 | 0.21 | 0.67 |
| 体长 | 2.19 | 3.55 | 9.13 | 0.15 | 0.24 |
| 体宽 | 0.52 | 1.11 | 0.04 | 0.31 | 0.66 |
| 体厚 | 0.11 | 0.46 | 0.22 | 0.14 | 0.58 |
育种项目主要是改变目标群体的遗传基础以提高其生产性能和经济效益(Gjedrem,1992)。在动物育种实践中,只利用加性遗传效应进行遗传选育已经取得了很大成功。在目前的水产动物育种技术体系中,利用混合线性模型直接估计显性和上位性等非加性遗传组分的研究还不多,先前受限于计算手段和群体规模,导致非加性效应很难与共同环境效应剖分开,而且显性效应和上位效应所需的计算机运算量要远大于简单加性效应。随着大规模家系选育技术在鲑鱼育种中长期有效地开展,以及育种者不断追求更大的选育效果,非加性遗传效应也逐渐引起育种工作者的兴趣(Pante et al,2002; 户国等,2012a,b)。非加性效应对乳牛、肉鸡等重要经济性状的存在显著影响的研究已经见诸报道(Fuerst et al,1994; Hu et al,2010),也有一些研究结果证明,如果将显性效应纳入育种规划,可以获得显著的额外遗传进展(Sun et al,2013)。
本研究对5个生长性状进行了表型描述性统计,结果显示体质量性状的变异系数最大。体质量、体长和体厚三个主要性状在三维空间的散点分布显示,该群体主要生长性状的整齐度较好,而且存在着数量较多的体质量、体长和体厚生产性能都非常优良的个体,有着良好的育种应用潜力。本研究中利用只含有加性效应的模型遗传力分析的结果显示,5个性状的遗传力在0.16—0.48之间,根据一般经验值,均属于中高遗传力性状(h2≥0.15),其中,体质量性状的遗传力约为0.35,体长约为0.20。此外,先前很多研究结果表明,虹鳟生长性状共同环境效应估计值介于0—0.06(Pante et al,2002); 大西洋鲑的生长性状共同环境效应估计值接近于0(Gjerde et al,1984); 大鳞大麻哈鱼的生长性状共同环境效应估计值介于0—0.08(Winkelman et al,1994a,b)。上述结果显示,鲑科鱼类生长性状的共同环境效应估计值都较低,对表型方差的贡献较小,因此,本研究为简化统计模型,没有将共同环境效应纳入考虑。同时对加性和显性方差进行剖分的结果显示,上述5个性状的显性离差在0.24—0.67之间,均处于中等或较高水平。其中体长显性离差最低,为0.24,头长显性离差最高,为0.67。为了提高统计模型对参数估计的准确程度,本实验群体为全同胞家系构成,共同环境效应与显性效应可能混淆在一起,无法完全剖分开。根据数量遗传学原理,显性效应和共同环境效应的设计矩阵不同,显性效应与遗传结构相关,而共同环境效应则不完全与遗传结构直接相关(Falconer et al,1996)。本研究中近2000个体,每个全同胞家系个体数平均30个以上,在这样的数据结构和样本含量下,可以近似地认为,显性方差的估计值接近于真值。
本研究结果表明,加性遗传力和显性方差组分比率加和所解释的方差组分占总表型方差比率较高,其中体宽性状加性遗传力和显性方差组分比率的加和达0.97,几乎可以完全由遗传方差解释。该结果一方面提示我们的研究中可能存在着对显性效果高估的可能性,另一方面也暗示着,只含有加性效应的动物模型中所期望的显性效应等非加性效应都可以简单地归入随机残差至少是不确切的。本研究中发现将显性效应纳入分析后,加性方差和遗传力都出现下降的现象,在国外对虹鳟的研究中也有类似发现(Pante et al,2002)。而对乳牛的研究则发现模型中是否纳入显性效应,对加性效应估值的影响并不显著(Fuerst et al,1994; Misztal,1997)。其中一个原因可能是,乳牛群体中以半同胞家系为主,而虹鳟、大西洋鲑等养殖鲑科鱼类的遗传结构以全同胞家系为最主要方式。根据显性效应的数量遗传学定义可知,显性相关系数只有全同胞个体之间数值≥0.25,其它非全同胞个体间的显性相关系数为0(Falconer et al,1996)。
综上所述,本研究结果显示所涉及的5个重要生长性状都存在着中等或较高水平的显性效应方差组分,在设计育种方案时可以在考虑加性效应的条件下,进行选种,在选配时应兼顾显性效应,这样可以利用更多的遗传方差,从而获得更多的遗传进展。本研究结果也提示,在下一阶段的虹鳟良种选育过程中,显性效应在育种方案设计时也应该纳入参考。本研究对大规格虹鳟生长性状的遗传规律有了更深入的认识,为改进虹鳟生长性状的育种方案设计提供了数据支持。本研究结果对以生长性状为目标的鱼类良种选育技术的改进具有一定的参考价值。
| 王炳谦, 户 国, 束永俊, 2012.虹鳟育种技术研究.哈尔滨: 东北林业大学出版社, 1-14 |
| 王炳谦, 谷 伟, 高会江等, 2009.利用配合力和微卫星标记预测虹鳟品系间的杂交优势.中国水产科学, 16(2): 206-213 |
| 户 国, 王守志, 李 辉, 2012a.上位性及其对家养动物复杂经济性状形成的遗传学影响.东北农业大学学报, 43(3): 117-122 |
| 户 国, 王守志, 张 森等, 2010.ApoB与UCP基因间上位效应对鸡腹脂性状影响的遗传学分析.遗传, 32(1): 59-66 |
| 户 国, 谷 伟, 王 鹏等, 2012b.电子标记辅助虹鳟家系建立及快速生长家系筛选.中国水产科学, 19(1): 77-83 |
| 户 国, 谷 伟, 姜再胜等, 2014.虹鳟(Oncorhynchus mykiss)选育群体主要体尺性状表型和遗传相关分析.海洋与湖沼, 45(3): 548-553 |
| Falconer D S, Mackay T F C, 1996.Introduction to Quantitative Genetics.Harlow, Essex: Longman |
| Fuerst C, Sölkner J, 1994.Additive and nonadditive genetic variances for milk yield, fertility, and lifetime performance traits of dairy cattle.Journal of Dairy Science, 77(4): 1114-1125 |
| Gall GAE, 1975.Genetics of reproduction in domesticated rainbow trout.Journal of Animal Science, 40(1): 19-28 |
| Gjedrem T, 1983.Genetic variation in quantitative traits and selective breeding in fish and shellfish.Aquaculture, 33(1-4): 51-72 |
| Gjedrem T, 1992.Breeding plans for rainbow trout.Aquaculture, 100(1-3): 73-83 |
| Gjerde B, Gjedrem T, 1984.Estimates of phenotypic and genetic parameters for carcass traits in Atlantic salmon and rainbow trout.Aquaculture, 36(1-2): 97-110 |
| Hu G, Gu W, Bai Q L, et al, 2013.Estimation of genetic parameters for growth traits in a breeding program for rainbow trout (Oncorhynchus mykiss) in China.Genetics and Molecular Research, 12(2): 1457-1467 |
| Hu G, Wang S Z, Tian J W et al, 2010.Epistatic effect between ACACA and FABP2 gene on abdominal fat traits in broilers.Journal of Genetics and Genomics, 37(8): 505-512 |
| Miglior F, Burnside E B, Kennedy B W, 1995.Production traits of Holstein cattle: estimation of nonadditive genetic variance components and inbreeding depression.Journal of Dairy Science, 78(5): 1174-1180 |
| Misztal I, 1997.Estimation of variance components with large-scale dominance models.Journal of Dairy Science, 80(5): 965-974 |
| Misztal I, Besbes B, 2000.Estimates of parental-dominance and full-sib permanent environment variances in laying hens.Animal Science, 71(3): 421-426 |
| Misztal I, Tsuruta S, Strabel T et al, 2002.BLUPF90 and related programs (BGF90).In: Proceeding of 7th World Congress of Genetics Applied to Livestock Production.Montpellier, France: CD-ROM Communication |
| Pante M J R, Gjerde B, McMillan I et al, 2002.Estimation of additive and dominance genetic variances for body weight at harvest in rainbow trout, Oncorhynchus mykiss.Aquaculture, 204(3-4): 383-392 |
| Proust M, 2007.JMP Statistics and Graphics Guide.Cary, NC, USA: SAS Publishing |
| Sun C, VanRaden P M, O'Connell J R et al, 2013.Mating programs including genomic relationships and dominance effects.Journal of Dairy Science, 96(12): 8014-8023 |
| Winkelman A M, Peterson R G, 1994a.Heritabilities, dominance variation, common environmental effects and genotype by environment interactions for weight and length in chinook salmon.Aquaculture, 125(1-2): 17-30 |
| Winkelman A M, Peterson R G, 1994b.Genetic parameters (heritabilities, dominance ratios and genetic correlations) for body weight and length of chinook salmon after 9 and 22 months of saltwater rearing.Aquaculture, 125(1-2): 31-36 |
 2015, Vol. 46
2015, Vol. 46