文章信息
- 杨程, 富裕, 朱卫东, 申屠基康, 斯烈钢, 王志铮. 2015.
- YANG Cheng, FU Yu, ZHU Wei-Dong, SHENTU Ji-Kang, SI Lie-Gang, WANG Zhi-Zheng. 2015.
- 四明山脉溪流区水产经济动物棘胸蛙(Paa spinosa)同生群两性亲体间的形质差异
- MORPHOLOGICAL DIFFERENCES BETWEEN BISEXUAL PARENTS OF ECONOMIC FROG PAA SPINOSA IN STREAMS OF SIMING MOUNTAINS
- 海洋与湖沼, 46(4): 853-861
- Oceanologia et Limnologia Sinica, 46(4): 853-861.
- http://dx.doi.org/10.11693/hyhz20141200360
-
文章历史
- 收稿日期:2014-12-19
- 改回日期:2015-01-30
2. 余姚市水产技术推广中心 余姚 315400;
3. 宁波市海洋与渔业研究院 宁波 315012
2. FisheryTechnology Extension Center of Yuyao, Yuyao 315400, China;
3. Marine and Fishery Research Institute of Ningbo, Ningbo 315000, China
棘胸蛙(Paa spinosa)隶属于两栖纲、无尾目、蛙科、棘蛙属,系分布于我国南方丘陵溪流区中具滴水产卵繁育特性的特有大型食用蛙(林光华等,1990; 丁松林等,2009),具很高的食用和药用价值,素有“百蛙之王”之美誉,是一种极具开发利用潜力的名贵水产品。上世纪八十年代以来,我国学者为破解棘胸蛙野生种质资源日趋衰退和商品棘胸蛙市场消费需求日益高涨之困局,先后就棘胸蛙种质生物学(李炳华等,1983; 胡知渊等,2005; 凌云等,2012)、繁殖与发育生物学(林光华等,1990; 刘元楷等,1990; 虞鹏程等,1995; 俞宝根等,2008; 丁松林等,2009)以及人工养殖技术(谢海妹等,2007)等开展了较为深入的研究,有力促进了浙江、安徽、福建、湖南、江西等地棘胸蛙增养殖业的蓬勃发展,但迄今有关该蛙优质亲体选育途径及其精细化培育方面的研究则尚未见报道。
形质作为生物的表型信息,它既是生物外观表型和体质状况等宏观生物学指标的集中反映,也是生物营养生理状况及其生存对策的外在体现(王志铮等,2012)。开展目标水产养殖动物两性亲体间形质特征的差异研究,无疑对于揭示其用于区分性别的典型体征以及性间选择对策具重要学术价值。为此,本文作者针对棘胸蛙成体具雌小雄大两性异形特征(刘春涛等,2007; 路庆芳等,2008),以及形态性状对体质量和净体质量影响效果上具鲜明性别差异(斯烈钢等,2015)的实际,于2013年6月16日以位于四明山脉溪流区的浙江省余姚市下鲁石蛙养殖场养成的3年龄棘胸蛙同生群养殖群体中的成熟个体为研究材料,以生物学测定指标以及形质特征指标参数的性别差异为线索,以弄清导致该蛙两性成体间典型体征和性间选择对策差异的真实原因为目标,借助聚类分析、主成分分析和判别分析方法较系统地开展了棘胸蛙两性成体间的形质差异研究,以期为指导该蛙两性优质亲体选育及精细化培育提供科学依据。
1 材料与方法 1.1 供试蛙来源及数量2013年6月16日于浙江省余姚市下鲁石蛙养殖场亲蛙培育池中,随机选取产卵时间为2010年6月20日的3周龄余姚本地品系棘胸蛙同生群雌、雄成熟个体各84只作为本研究测定群体。
1.2 生物学指标测定与形质评价指标计算实验样品逐一编号后,进行生物学指标测定。其中,尺寸性状测定指标依次为: 体长(吻端至泄殖腔孔后缘的水平距离,SUL)、吻长(吻端至眼前角的水平距离,SL)、头长(吻端至颈褶的水平距离,HL)、肩肛距(颈褶至肛孔后缘的的水平距离,SAL)、前足长(前肢基部至第三指末端的直线距离,FFL)、前肢长(肩关节至第三指末端的直线距离,FLL)、后足长(后肢基部至最长趾末端的的直线距离,HFL)、后肢长(体后端正中部位至第四趾末端的直线距离,HLL)、眼间距(左右上眼睑内侧缘间的水平距离,IS)、鼻间距(左右鼻孔间的水平距离,INS)、头宽(头部左右两侧的最大水平距离,HW)和肩宽(左右肩点间的水平距离,SW); 重量性状指标依次为: 体质量(BW)、心质量(WH)、肾质量(WK)、肺质重(WLU)、肝质量(WL)、胃质量(WS)、肠质量(WI)、性腺质量(WG)。根据所测结果,分别计算尺寸性状比(各尺寸性状之间的比值)、脏心质量比(各脏器质量与心质量的比值)、脏器系数(各脏器质量占体质量的百分比)和Fulton’s指数K=体重/体长3×100(Fulton,1911)等形质评价指标。
1.3 数据处理整理所测结果,借助SPSS 17.0软件分别计算棘胸蛙两性亲体各项生物学测定指标、形质评价指标的均值、标准差和变异系数,并比较组间差异显著性(P<0.05视为显著水平); 根据上述各项形质评价指标的均值,计算两性亲体间经标准化处理的欧氏距离(全距为1.00),并以此度量两者形质特征间的相似性程度(P<0.05视为显著水平); 根据所有实验样本的形质评价指标值进行主成分分析和判别分析,其中主成分分析以特征值大于1且累计贡献率大于80%为原则确定主成分(PC)的提取个数,采用逐步导入剔除法进行判别分析,并参照Li等(2005)的方法计算判别准确率(P1 为某性别判 别正确的个数占该性别实际个数的百分比,P2 为某性别判别正确的个数占判入该性别个数的百分比)和综合判别率(P为两性实验对象判别正确的个数之和占实验对象总个数的百分比)验证所建判别方程组的可靠性。
2 结果与分析 2.1 两性亲体生物学测量指标间的差异比较由表 1可见,雌雄两性亲体在生物学测量指标间存在一定程度的异同,主要表现为:(1)从尺寸性状指标看,雄性除SL(吻长)、IS(眼间距)测量值与雌性无显著差异(P>0.05)外,其余10项指标的测量值均显著大于雌性(P<0.05),除HL(头长)、INS(鼻间距)、SW(肩宽)测量值的变异 系数小于雌性(P<0.05)外,其余9项指标测量值的变异系数均大于雌性(P<0.05),表明雄性不仅体型增长速度显著大于雌性(P<0.05),而且体型稳定性也强于雌性,而雌性较雄性则更专注于捕食视野和吞食空间的拓展;(2)由质量性状指标看,雌性除WG(性腺质量)测量值与雄性无显著差异(P>0.05)外,其余7项指标的测量值均显著小于雄性(P<0.05),除WB(体质量)、WG变异系数小于雄性外,其余6项指标测量值的变异系数均大于雄性(P<0.05),表明雄性不仅增重速度显著大于雌性(P<0.05),而且其消化、血循、呼吸以及排泄脏器的质量稳定性也均强于雌性,而雌性较雄性则更专注于繁殖营养能量的积累。综上可知,棘胸蛙两性亲体在尺寸性状、体质量性状及脏器质量性状的增长对策上均存在较为明显的差异。
| 性状属性 | 测量指标 | ♂(n=84) | ♀(n=84) | ||
| M±SE | CV(%) | M±SE | CV(%) | ||
| 尺寸性状(mm) | 体长 Snout-urostyle length,SUL | 95.87±6.88a | 7.18 | 90.65±5.15b | 5.68 |
| 头长Head length,HL | 32.00±3.26a | 10.19 | 30.21±3.32b | 10.99 | |
| 吻长Snout length,SL | 9.41±1.74a | 18.49 | 9.62±1.70a | 17.67 | |
| 前肢长 Fore-limb length,FLL | 57.70±6.05a | 10.48 | 48.12±4.06b | 8.44 | |
| 前足长 Froefootlength,FFL | 18.96±2.58a | 13.61 | 16.76±1.72b | 10.26 | |
| 后肢长Hind-limb length,HLL | 140.36±8.38a | 5.97 | 128.62±6.95b | 5.40 | |
| 后足长 Hindfootlength,HFL | 42.32±3.53a | 8.34 | 39.00±3.04b | 7. 79 | |
| 肩肛距Shoulder-to-anallength,SAL | 69.44±7.86a | 11.32 | 66.39±4.62b | 6.96 | |
| 头宽Head breadth,HB | 36.35±2.39a | 6.57 | 33.56±2.20b | 6.55 | |
| 眼间距Interorbital space,IS | 15.28±1.83a | 11.98 | 14.84±1.59a | 10.71 | |
| 鼻间距 Internasal distance,INS | 7.48±0.86a | 11.50 | 7.17± 0.91b | 12.69 | |
| 肩宽 Shoulderwidth,SW | 42.26±3.32a | 7.86 | 39.08±2.81b | 7.19 | |
| 质量性状(g) | 体质量Body weight,WB | 120.71±22.97a | 19.03 | 101.63±14.47b | 14. 24 |
| 心质量Heart weight,WH | 0.7466±0.2429a | 32.53 | 0.4503±0.1716b | 38.11 | |
| 肾质量Kidney weight,WK | 0.5898±0.1234a | 21.06 | 0.4870±0.1328b | 27.27 | |
| 肺质重Lungs weight,WLU | 0.4751±0.1365a | 28.73 | 0.3055±0.1059b | 34.66 | |
| 肝质量Liver weight,WL | 3.3691±1.0244 a | 30.40 | 2.9226±0.9660b | 33.05 | |
| 胃质量Stomach weight,WS | 1.3170±0.2611a | 19.82 | 1.1201±0.3095b | 27.63 | |
| 肠质量Intestines weight,WI | 1.6479±0.4130a | 25.06 | 1.4646±0.4347b | 29.68 | |
| 性腺质量Gonad weight,WG | 8.8974±2.8801a | 32.37 | 8.1417±2.1956a | 26.97 | |
| 同行上标不同小写字母表示组间差异显著(P<0.05),下同 | |||||
由表 2可见,雌雄两性亲体在形质评价指标间存在一定程度的异同,主要表现为:(1)从尺寸性状比例指标看,雄性除L2(后足长/后肢长)、L3(吻长/头宽)、L5(眼间距/头宽)和L11(鼻间距/眼间距)与雌性无显著差异(P>0.05),及L10(吻长/眼间距)显著大于雌性(P<0.05)外,其余6项指标值均显著小于雌性(P<0.05),即在所得11项尺寸性状比例指标中两者的指标相似性为36.7%,表明雌性HW(头宽)、SL(吻长)、IS(眼间距)与SW(肩宽)的比例均显著大于雄性(P<0.05);(2)从脏器 系数来看,雌性除R2(肝系数)、R3(胃系数)、R4(肠系数)和R6(肾系数)与雄性无显著差异(P>0.05),及R7(性腺系数)显著大于雄性(P<0.05)外,其余2项指标值均 显 著小于雄性(P<0.05),即在所得7项指标中两者的指标相似性为57.1%,表明雄性花费于建造呼吸和血循脏器的能量占比显著大于雌性(P<0.05),雌性花费于繁殖营养代谢的能量占比显著大于雄性(P<0.05),而两者间花费于建造消化和排泄脏器的能量占比则相当;(3)由脏心质量比例指标看,雄性除W4(肺质量/心质量)与雌性无显著差异(P>0.05)外,其余5项指标值均显著小于雌性(P<0.05),且所得各项指标的变异系数均大于雌性(P<0.05),即在所得6项脏心质量比例指标中两者的指标相似性仅为16.7%,表明以WH(心脏质量)为参照,雌性较雄性更专注于在消化、排泄和生殖脏器上的能量投入;(4)两者间肥满度指数无显著差异(P>0.05),表明雌雄两性亲体单位体积内所含有的生物量相当。综上可知,棘胸蛙两性亲体在脏器质量配置对策和与吞咽、捕食功能相关的尺寸比例性状上均存在较为明显的差异。
| 形质评价类别 | 评价指标 | 代码 | ♂(n=84) | ♀(n=84) | ||
| M±SE | CV(%) | M±SE | CV(%) | |||
| 尺寸性状比例 | 前足长/前肢长FFL/FLL | L1 | 0.33±0.04a | 12.12 | 0.35±0.04b | 11.43 |
| 后足长/后肢长HFL/HLL | L2 | 0.30±0.02a | 6.67 | 0.30±0.02a | 6.67 | |
| 吻长/头宽 SL/HW | L3 | 0.62±0.11a | 17.74 | 0.65±0.11a | 16.92 | |
| 体长/头宽SUL/HW | L4 | 2.64±0.19a | 7.20 | 2.71±0.19b | 7.01 | |
| 眼间距/头宽 IS/HW | L5 | 0.18±0.02a | 11.11 | 0.18±0.02a | 11.11 | |
| 肩肛距/头宽SAL/HW | L6 | 1.92±0.23a | 11.98 | 1.98±0.17b | 8.58 | |
| 吻长/肩宽 SL/SW | L7 | 0.26±0.05a | 19.23 | 0.29±0.05b | 17.24 | |
| 眼间距/肩宽 IS/SW | L8 | 0.42±0.04a | 9.52 | 0.44±0.05b | 11.36 | |
| 头宽/肩宽 HW/SW | L9 | 0.36±0.04a | 11.11 | 0.38±0.04b | 10.53 | |
| 吻长/眼间距 SL/IS | L10 | 0.82±0.14a | 17.07 | 0.76±0.14b | 18.42 | |
| 鼻间距/眼间距INS/IS | L11 | 0.49±0.05a | 10.20 | 0.49±0.05a | 10.20 | |
| 脏器系数(%) | 心系数WH/WB | R1 | 0.63±0.21a | 33.15 | 0.44±0.14 b | 32.66 |
| 肝系数WL/WB | R2 | 2.78±0.62a | 22.34 | 2.87±0.84 a | 29.30 | |
| 胃系数WS/WB | R3 | 1.10±0.16a | 14.10 | 1.10±0.24 a | 21.88 | |
| 肠系数WI/WB | R4 | 1.38±0.30a | 21.91 | 1.43±0.34 a | 23.44 | |
| 肺系数WLU/WB | R5 | 0.39±0.08a | 20.67 | 0.30±0.09 b | 30.26 | |
| 肾系数WK/WB | R6 | 0.50±0.11a | 22.76 | 0.49±0.14 a | 27.96 | |
| 性腺系数WG/WB | R7 | 7.27±1.58a | 21.78 | 7.96±1.57 b | 19.71 | |
| 脏心质量比例 | 肝质量/心质量WL/WH | W1 | 5.29±4.55a | 86.01 | 6.94±2.48b | 35.73 |
| 胃质量/心质量WS/WH | W2 | 2.16±2.03a | 93.98 | 2.71±0.89b | 32.84 | |
| 肠质量/心质量WI/WH | W3 | 2.69±2.52a | 93.68 | 3.56±1.34b | 37.64 | |
| 肺质量/心质量WLU/WH | W4 | 0.75±0.70a | 93.33 | 0.73±0.28a | 38.36 | |
| 肾质量/心质量WK/WH | W5 | 0.93±0.78a | 83.87 | 1.19±0.45b | 37.82 | |
| 性腺质量/心质量WG/WH | W6 | 14.18±13.09a | 92.31 | 19.51±6.16b | 31.57 | |
| 肥满度指数(g/cm3) | Fulton’s指数 | K | 13.74±2.39a | 17.39 | 13.65±1.48a | 10.84 |
| 欧式距离 | 0.305(P<0.01) | |||||
| *评价指标栏中测量指标的字母缩写同表 1,下同 | ||||||
经筛选,对由尺寸性状比例、脏心质量比例指标和肥满度指数组成的形质评价指标进行Bartlett球形检验和KMO适合度检验,发现其相关系数矩阵与单位阵有显著差异(P<0.05)且适合度尚可(KMO=0.726> 0.70),表明有必要对上述形质评价指标进行主成分分析。
由表 3可见,所列5个主成分的特征值均大于1且方差累计贡献率达80.841%,故可认定它们为能概括本研究所涉两性成体形质特征差异的公共因子。其中,PC1的贡献率最大,达30.677%。将载荷绝对值p>0.5的变量视作主要影响变量,则PC1和PC2的正相关主要变量影响力排序分别为W3(0.951)>W2(0.948)> W6(0.924)>W1(0.921)>W4(0.898)>W5(0.887)和L3(0.859)> L4(0.757)>L7(0.748)>L5(0.669)>L6(0.657)>L10(0.516),两者均无负相关主要变量; PC3的正相关和负相关主要变量影响力排序分别呈L(0.825)>L11(0.603)和L8(-0.584)>L5(-0.638); PC4和PC5均无负相关主要变量,它们正相关主要变量的影响力排序分别为L9(0.731)>L8(0.573)和L2(0.823)>L1(0.548)。由此可见,各公共因子的贡献率大小与其所包含的主要影响变量的组成个数及其载荷绝对值加和的大小密切相关。
| 形质评价类别 | 评价指标 | 代码 | 载荷P | ||||
| PC1 | PC2 | PC3 | PC4 | PC5 | |||
| 长度性状比例 | 前足长/前肢长FFL/FLL | L1 | 0.14 | 0.229 | -0.025 | 0.335 | 0.548 |
| 后足长/后肢长HFL/HLL | L2 | 0.029 | -0.17 | 0.028 | 0.049 | 0.823 | |
| 吻长/头宽 SL/HW | L3 | 0.199 | 0.859 | 0.394 | 0.168 | -0.094 | |
| 体长/头宽SUL/HW | L4 | 0.049 | 0.757 | -0.083 | -0.5 | 0.112 | |
| 眼间距/头宽 IS/HW | L5 | 0.205 | 0.669 | -0.638 | 0.136 | -0.055 | |
| 肩肛距/头宽SAL/HW | L6 | 0.134 | 0.657 | -0.099 | -0.421 | 0.08 | |
| 吻长/肩宽 SL/SW | L7 | 0.183 | 0.748 | 0.469 | 0.413 | -0.07 | |
| 眼间距/肩宽 IS/SW | L8 | 0.169 | 0.458 | -0.584 | 0.573 | -0.019 | |
| 头宽/肩宽 HW/SW | L9 | -0.075 | -0.441 | 0.167 | 0.731 | 0.036 | |
| 吻长/眼间距 SL/IS | L10 | 0.085 | 0.516 | 0.825 | 0.106 | -0.07 | |
| 鼻间距/眼间距 INS/IS | L11 | -0.097 | -0.332 | 0.603 | -0.197 | 0.103 | |
| 脏心质量比例 | 肝质量/心质量WL/WH | W1 | 0.921 | -0.065 | -0.029 | -0.032 | 0.061 |
| 胃质量/心质量WS/WH | W2 | 0.948 | -0.088 | 0.049 | -0.015 | 0.016 | |
| 肠质量/心质量WI/WH | W3 | 0.951 | -0.033 | -0.008 | -0.038 | 0.049 | |
| 肺质量/心质量WLU/WH | W4 | 0.898 | -0.148 | 0.007 | -0.095 | -0.015 | |
| 肾质量/心质量WK/WH | W5 | 0.887 | -0.218 | 0.084 | 0.022 | 0.036 | |
| 性腺质量/心质量WG/WH | W6 | 0.924 | -0.139 | 0.013 | -0.101 | 0.036 | |
| 肥满度(g/cm3) | Fulton’s指数 | K | 0.467 | -0.333 | -0.041 | 0.136 | -0.479 |
| 特征值 | 5.522 | 3.824 | 2.225 | 1.711 | 1.269 | ||
| 贡献率(%) | 30.677 | 21.243 | 12.364 | 9.505 | 7.052 | ||
| 累计贡献率(%) | 30.677 | 51.920 | 64.284 | 73.789 | 80.841 | ||
| *评价指标栏中测量指标的字母缩写同表 1,下同 | |||||||
在诸公共因子中,从属于PC1的主要影响变量均仅为脏心质量比例指标,而从属于其它公共因子的主要影响变量则均仅为尺寸比例指标,且所有载荷绝对值达到0.880以上的主要影响变量均仅存在于PC1中的情形,表明PC1在对两性亲体形质特征的区分上较其它公共因子更具重要性。分别绘制PC1与其它主成分间的得分散布图,得图 1。由图 1可见,棘胸蛙雌、雄亲体沿FAC1轴自左向右虽分别集中于各自相对独立的区域,但仍具较高的重叠度,表明仅借助PC1无法有效确定部分实验个体的性别归属问题,惟有与其它主成分结合才能较全面而精准地反映雌、雄亲体间形质特征的差异。
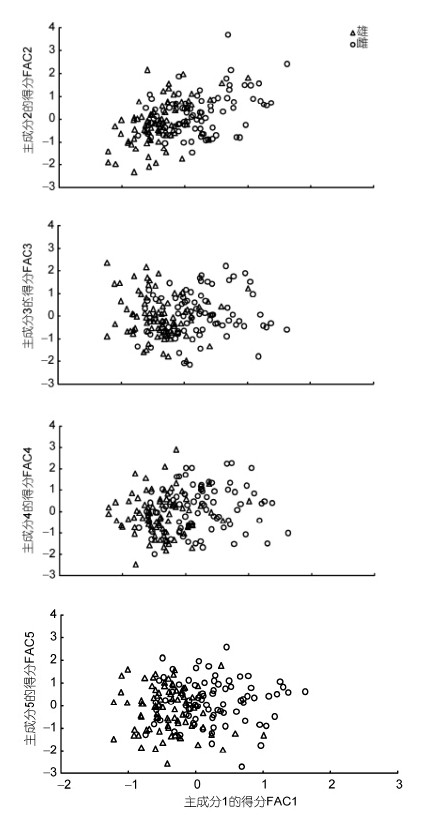 |
| 图 1 棘胸蛙两性亲体形质评价指标的主成分散布图Fig. 1 Scatter diagram in principal component of morphological evaluation indexes for bisexual parent of P. spinosa |
采用逐步导入剔除法,从列入主成分分析的18个形质特征变量(表 2)中筛选出对判别贡献较大的L1(前足长/前肢长)、L5(吻长/肩宽)、L7(眼间距/头宽)、W2(胃质量/心质量)、W4(肺质量/心质量)、W6(性腺质量/心质量)6个变量进行判别分析,F检验表明各变量均达到极显著水平(P<0.01)。根据上述6个变量建立棘胸蛙雌、雄两性亲体的Fisher分类函数方程组,得表 4。经验证,雄性判别准确率P1、P2分别为84.52%和83.53%,雌性判别准确率P1、P2分别为83.33%、84.34%,两者综合判别率为83.93%(表 5)。另,所绘制的典型判别函数判别得分散布图(图 2),在进一步验证了上述判别分析的可靠性的同时,也印证了仅采用脏心质量比例指标无法准确确定部分实验个体性别归属问题的结果(图 1)。
| 性别 | 自变量系数 | 常数项 | |||||
| L1 | L5 | L7 | W2 | W4 | W6 | ||
| ♂ | 191.9191 | 163.0435 | 62.50833 | -1.09311 | -2.60962 | 0.384594 | -74.1368 |
| ♀ | 205.6932 | 171.6329 | 72.20434 | -0.04162 | -8.53082 | 0.557005 | -85.8849 |
| 性别 | 总数 | 预测分类 | 判别准确率(%) | 综合判别率(%) | ||
| ♂ | ♀ | P1 | P2 | |||
| ♂ | 84 | 71 | 13 | 84.52 | 83.53 | 83.93 |
| ♀ | 84 | 14 | 70 | 83.33 | 84.34 | |
 |
| 图 2 棘胸蛙雌雄亲体的典型判别函数判别得分散布图Fig. 2 Scatter diagram of discrimination function of bisexual parent of P. spinosa |
在本研究所涉20项生物学测定指标和25项形质评价指标中,具显著差异的分别为17项和16项(表 1,表 2),且二者形质评价指标均值间的标准化欧氏距离也具显著差异(表 3)的情形,表明棘胸蛙亲体在形质特征上均具较为明显的性别差异。但上述存在显著差异的形质评价指标并非均为区分二者间形质特征的关键判别变量,而要真正找到可作为判别形质特征的关键性评价指标尚需依赖主成分分析和判别分析才能得以实现。
由表 3、图 1可见,虽PC1的贡献率明显大于其它各主成分,但仅借助PC1尚无法较清晰地确定部分棘胸蛙雌、雄两性亲体的性别归属问题,即PC1所包含的主要影响变量组合并未能从全貌上概括棘胸蛙雌、雄两性亲体间的形质特征差异(图 1,表 4),其原因既与PC1的贡献率(30.677%)远小于其它主成分的贡献率加和值(50.164%)有关,也与从属于PC1的主要影响变量仅为脏心质量比例指标,而从属于其它主成分的主要影响变量均仅为尺寸比例指标有关(表 3),故形质特征判别指标应包含脏心质量比例指标和尺寸比例指标,这也充分印证了判别分析所得结果(表 5,图 2)的可靠性,即从属于PC1主要影响变量的W2(胃质量/心质量)、W4(肺质量/心质量)和W6(性腺质量/心质量),与从属于PC2、PC3主要影响变量中的L5(吻长/肩宽)和L7(眼间距/头宽)以及从属于PC5主要影响变量的L1(前足长/前肢长)6个变量构成了判别本研究实验对象性别归属问题的关键变量组合。当然,导致各主成分中部分主要影响变量未能被列入上述关键判别变量组合的原因,无疑与列入本研究关键判别变量组合的性状间存在信息重叠有关。本研究中棘胸蛙雌雄亲体间R2(肝系数)、R3(胃系数)、R4(肠系数)、R6(肾系数)均无显著差异(P>0.05),而W1(肝质量/心质量)、W2(胃质量/心质量)、W3(肠质量/心质量)、R7(性腺系数)、W5(肾质量/心质量)和W6(性腺质量/心质量)却均具显著差异(P<0.05),消化器官的脏器系数和脏心质量比例指标中均以R3(胃系数)和W2(胃质量/心质量)为最小(表 2),以及PC1中W2(0.948)载荷值与W </ span>1(0.921)和W3(0.951)均相近,而W6载荷值(0.924)明显大于W5(0.887)(表 3)的情形,表明胃质量指标和性腺质量指标分别与同属消化系统重要脏器的肝、肠质量指标和同属泄殖系统重要脏器的肾质量指标存在信息重叠,即W2(胃质量/心质量)、W6可分别作为表征消化系统和泄殖系统脏心质量比例的标志性指标。另,表 3中仅 L 5(眼间距/头宽)、L10(吻长/眼间距)为PC2和PC3的公共主要影响变量,L8(眼间距/肩宽)为PC3和PC4的公共主要影响变量,表明IS(眼间距)、HW(头宽)、SL(吻长)和SW(肩宽)为可涵盖PC2、PC3和PC4主要表型比例信息的公共性状,鉴于表 1、表 2中棘胸蛙雌雄亲体间SL(吻长)、IS(眼间距)、L3(吻长/头宽)均无显著差异(P>0.05)之情形,致使L5(< /span>眼间距/头宽)和L7(吻长/肩宽)在排除L3(吻长/头宽)和L10(吻长/眼间距)后顺势入选关键判别变量组合。至于同为足肢比例性状的L2(后足长/后肢长)未能入选关键判别变量组合的原因,则可能为棘胸蛙雌雄亲体间L< sub>2(后足长/后肢长)无显著差异(P>0.05)所致(表 2)。故本文作者认为本研究所涉实验对象间的性别关键判别性状组合为L1(前足长/前肢长)、L5(吻长/肩宽)、</ span>L7(眼间距/头宽)、W2(胃质量/心质量)、W4(肺质量/心质量)和W6(性腺质量/心质量)。
3.2 关于棘胸蛙两性亲体间形质特征差异的原因分析由表 4可见,以载荷绝对值均达到0.880以上的W1(肝质量/心质量)、W2(胃质量/心质量)、W3(肠质量/心质量)、W4(肺质量/心质量)、W5(肾质量/心质量)和W6(性腺质量/心质量)为核心变量的PC1是与脏器质量配置相关的能量代谢因子,以L3(吻长/头宽)、L4(体长/头宽)、L5(眼间距/头宽)、L6(肩肛距/头宽)、L7(吻长/肩宽)、L10(吻长/眼间距)为核心变量的PC2为以头宽和吻长为代表的与口腔空间大小有关的食物吞咽因子,考虑到主成分越靠后误差越大这一实际(Backhaus et al,2005),将以L1(前足长/前肢长)、L2(后足长/后肢长)、L8(眼间距/肩宽)、L9(头宽/肩宽)和L11(鼻间距/眼间距)为核心变量的PC3、PC4和PC5统归为以足肢比和眼间距为代表的与寻食、跳跃和抱食能力相关的捕食功能因子。上述5个公共因子所涵盖的体现实验对象组间差异的能量代谢状况、吞食空间以及捕食功能等一系列特征信息,揭示了性间机体能量分配策略及其对应的捕食对策是引起本研究所涉棘胸蛙雌、雄两性亲体间形质特征差异的主因,从而客观地反映了在人工饲育条件下性间能量分配策略对其生长速度、养成周期及形质特征差异影响的生态重要性。
表 2所显现的本研究所涉棘胸蛙雌、雄两性亲体间的形质特征差异,也充分支持了上述性间机体能量分配策略及其对应的捕食对策为影响形质特征差异主因的观点,即:(1)Fulton’s指数K表示动物单位体积内所含有的生物量,可作为反映动物生理状态或营养状况的重要指标(Ricker,1975; 房继明等,1995; 王寿兵等,1999)。本研究中棘胸蛙同生群两性亲体间Fulton’s指数K、R2(肝系数)、R3(胃系数)、R4(肠系数)和R6(肾系数)无显著差异(P>0.05)的情形,表明人工饲育条件下棘胸蛙两性亲体具相似的营养状况和消化生理状态;(2)动物两性异形进化主要基于性选择(Shine,1979; Anderson et al,1990; Parker,1992)和生育力选择(Woolbright,1983; Olsson et al,2002)。已有研究表明,两栖类成体平均个体大小通常与性成熟时的平均年龄或个体大小呈正相关(Miaud et al,1999; Yilmaz et al,2005; Ma et al,2009); 两栖动物在繁殖投入上雄性远低于雌性,较大的雌性个体具较高的生育力和繁殖成功率(Angilletta et al,2000; Kyriakopoulou-Sklavounou et al,2008),通过增大个体以在争斗中处于有利地位,从而获得更多的交配机会,是两栖类雌小雄大两性异形类型中雄性常采取的策略(Davies et al,1977; Shine,1979)。故本研究中雌性R7(性腺系数)显著大于雄性(P<0.05),而肺系数和心系数却均显著小于雄性(P<0.05)的情形,无疑揭示了棘胸蛙亲体所具的雌小雄大异形特征(刘春涛等,2007; 路庆芳等,2008; 斯烈钢等,2015),主缘于两者在用以繁殖、呼吸和血循脏器建造的能量分配策略上存在的巨大差异。即: 雄性因在呼吸和血循脏器建造的能量投入上显著大于雌性,致使其可通过加强呼吸代谢和加快血循速度来显著提高食物利用和转化效率并促进个体生长,从而达到顺应性选择压力和提高繁殖适合度的目的; 观察发现,从变态后的幼蛙计起,棘胸蛙雌性达到性成熟的时间为24月龄,而雌性则仅为1周年(林光华等,1990),故雌性其为顺应生育力选择压力和提高繁殖适合度势必在繁殖营养生理代谢中较雄性投入更多的能量,从而限制了其个体的生长;(3)本研究中 雌性的L1(前足长/前肢长)、L7(吻长/肩宽)、L8(眼间距/肩宽)、L9(头宽/肩宽)均呈雌性显著大于雄性(P<0.05)的情形,无疑揭示了雌性为弥补其在呼吸和血循脏器建造的能量投入上较雄性亲体的不足,而采取了显著提高L9(头宽/肩宽)和L7(吻长/肩宽)以扩增口腔吞咽食物的容积率,和通过显著提高L8(眼间距/肩宽)和L1(前足长/前肢长)以扩增寻食空间和提高抱食成功率的捕食对策,这一有别于雄性的捕食对策,与Schoener等(1982)认为头部较大的个体具有摄食较大食物的潜能,有利于获得较大的净能,并在资源或配偶竞争中获得优势的观点相吻。上述分析表明,导致棘胸蛙两性个体间形质特征差异的本质,为它们基于性选择和生育力选择压力,而就机体能量分配策略及其对应的捕食对策进行权衡与优化的结果。
| 丁松林, 郑宝成, 2009. 棘胸蛙繁育特性研究. 四川动物, 28(4): 602-604 |
| 王寿兵, 蒋朝光, 屈云芳等, 1999. 野生和人工养殖辽宁中国林蛙肥满度和重/长指标的初步研究. 应用生态学报, 10(1): 91-94 |
| 王志铮, 杨 磊, 朱卫东, 2012. 三种养殖模式下日本鳗鲡养成品的形质差异. 应用生态学报, 23(5): 1385-1392 |
| 刘元楷, 苏向阳, 李荣招等, 1990. 棘胸蛙生殖腺发育的研究. 福建水产, (2): 15-24 |
| 刘春涛, 郑荣泉, 路庆芳等, 2007. 棘胸蛙的两性异形和雌性繁殖特征. 见: 两栖爬行动物学研究(第十一辑). 南京: 东南大学出版社, 160-165 |
| 李炳华, 汪尊德, 1983. 棘胸蛙的染色体组型分析. 遗传, 5(5): 39-41 |
| 林光华, 虞鹏程, 1990. 棘胸蛙的繁殖生物学研究. 江西大学学报(自然科学版), 14(4): 64-70 |
| 房继明, 孙儒泳, 刘志龙, 1995. 布氏田鼠肥满度分析和小型兽类肥满度指标 K 与 KWL(重长指标)的比较. 动物学报, 41(2): 141-148 |
| 胡知渊, 来雅萍, 陈文静, 2005. 棘胸蛙、虎纹蛙、黑斑蛙血细胞的比较. 四川动物, 24(1): 5-8 |
| 俞宝根, 叶容晖, 郑荣泉等, 2008. 人工环境下棘胸蛙(Paa spinosa)繁殖期的行为谱及活动节律. 生态学报, 28(12): 6371-6378 |
| 凌 云, 邵 晨, 颉志刚等, 2012. 低温暴露和恢复对棘胸蛙雌性亚成体生存力及能量物质消耗的影响. 生态学报, 32(18): 5763-5769 |
| 斯烈钢, 富 裕, 李鸿鹏等, 2015. 四明山脉溪流区水产经济动物棘胸蛙(Paa spinosa)成体形态性状对体质量和净体质量影响效应的性别差异. 海洋与湖沼, 46(3): 679-686 |
| 谢海妹, 袁久尧, 2007. 棘胸蛙养殖关键技术研究. 浙江海洋学院学报(自然科学版), 26(4): 457-460 |
| 虞鹏程, 林光华, 1995. 棘胸蛙早期胚胎发育的初步观察. 水生生物学报, 19(3): 216-222 |
| 路庆芳, 郑荣泉, 刘春涛等, 2008. 湖南平江棘胸蛙两性异形和雌性个体生育力. 浙江师范大学学报(自然科学版), 31(3): 220-224 |
| Anderson R A, Vitt L J, 1990. Sexual selection versus alternative causes of sexual dimorphism in teiid lizards. Oecologia, 84(2): 145-157 |
| Angilletta M J Jr, Sears M W, 2000. The metabolic cost of reproduction in an oviparous lizard. Functional Ecology, 14(1): 39-45 |
| Backhaus K, Erichson B, Plinke W, 2005. Multivariate Statistical Analysis. Berdelberg: Springer |
| Davies N B, Halliday T R, 1977. Optimal mate selection in the toad Bufo bufo. Nature, 269(5623): 56-58 |
| Fulton T W, 1911. The Sovereignty of the Sea. London and Edinburgh: William Blackwood and Sons |
| Li S F, Wang C H, Cheng Q Q, 2005. Morphological variations and phylogenesis of four strains in Cyprinus carpio. 水产学报, 29(5): 606-611 |
| Kyriakopoulou-Sklavounou P, Stylianou P, Tsiora A, 2008. A skeletochronological study of age, growth and longevity in a population of the frog Rana ridibunda from southern Europe. Zoology, 111(1): 30-36 |
| Ma X Y, Lu X, 2009. Sexual size dimorphism in relation to age and growth based on skeletochronological analysis in a Tibetan frog. Amphibia-Reptilia, 30(3): 351-359 |
| Miaud C, Guyétant R, Elmberg J, 1999. Variations in life-history traits in the common frog Rana temporaria (Amphibia: Anura): a literature review and new data from the French Alps. Journal of Zoology, 249(1): 61-73 |
| Olsson M, Shine R, Wapstra E et al, 2002. Sexual dimorphism in lizard body shape: The roles of sexual selection and fecundity selection. Evolution, 56(7): 1538-1542 |
| Parker G A, 1992. The evolution of sexual size dimorphism in fish. Journal of Fish Biology , 41(supplement): 1-20 |
| Ricker W E, 1975. Computation and interpretation of biological statistics of fish populations. Bulletin Fisheries Research Board of Canada, 191: 1-382 |
| Schoener T W, Slade J B, Stinson C H, 1982. Diet and sexual dimorphism in the very catholic lizard genus, Leiocephalus of the Bahamas. Oecologia, 53(2): 160-169 |
| Shine R, 1979. Sexual selection and sexual dimorphism in the Amphibia. Copeia, 1979(2): 297-306 |
| Woolbright L L, 1983. Sexual selection and size dimorphism in anuran amphibia. The American Naturalist, 121(1): 110-119 |
| Yilmaz N, Kutrup B, Çobanoğlu Ü et al, 2005. Age determination and some growth parameters of a Rana ridibunda population in Turkey. Acta Zoologica Academiae Scientiarum Hungaricae, 51(1): 67-74 |
 2015, Vol. 46
2015, Vol. 46


