文章信息
- 杨金生, 林琳, 夏松养, 谢超. 2015.
- YANG Jin-Sheng, LIN Lin, XIA Song-Yang, XIE Chao. 2015.
- 超低温冻藏对金枪鱼肉质构及生化特性机理研究
- MECHANISM STUDY OF TEXTURE AND BIOCHEMICAL CHARACTERISTICS OF TUNA DURING ULTRALOW TEMPERATURE STORAGE
- 海洋与湖沼, 46(4): 828-832
- Oceanologia et Limnologia Sinica, 46(4): 828-832.
- http://dx.doi.org/10.11693/hyhz20150200063
-
文章历史
- 收稿日期:2015-02-28
- 改回日期:2015-03-27
2. 浙江省海产品健康危害因素关键技术研究重点实验室 浙江海洋学院食品与医药学院 舟山 316022
2. Key Laboratory of Health Risk Factors for Seafood of Zhejiang Province, College of Food and Medicine, Zhejiang Ocean University, Zhoushan 316022, China
金枪鱼肉质鲜美,并具有红色肉质,富含多种不饱和脂肪酸和微量元素,生活环境污染很少,又有“海底黄金”的美称(杨金生,2012)。常见的7种金枪鱼有鲣鱼、黄鳍金枪鱼、长鳍金枪鱼、大眼金枪鱼、大西洋金枪鱼、北部蓝鳍金枪鱼、青甘金枪鱼(孙丽,2009)。由于金枪鱼肉含有高的肌红蛋白,很容易氧化褐变,因此对其保藏条件比较苛刻,在贮藏过程中,如果处理不好,常常导致金枪鱼肉变质,品质下降。
随着对金枪鱼品质要求的提高,人们对金枪鱼肉保鲜效果也越来越关注,Kristiansen等(2007)利用含有一氧化碳熏制金枪鱼肉,熏过的金枪鱼肉盐溶性蛋白含量下降较少,研究表明一氧化碳熏制方法对蛋白质的稳定起重要作用,而且烟熏前后金枪鱼肉的质构和持水力均无明显的变化(Kristiansen et al,2007)。Saito等(2009)在氮气、氧气、二氧化碳分别占19%、21%、60%包装内放入金枪鱼肉,研究气调保鲜对金枪鱼肉的保鲜效果。研究表明: 在0°C存放30d,鱼肉的质构、鲜度无明显变化(Saito et al,2009)。Woo等(2007)采用冰鲜法保鲜金枪鱼肉,在碎冰中添加山梨醇、氯化 钠等盐溶液,存放到3°C左右冷库中,此种冰鲜法的保质期为2—3d(Woo et al,2007)。国外也有研究者为了保藏金枪鱼原生态结构采用-70°C或更低温度冻藏。目前为了长期贮藏金枪鱼,保证鱼肉原生态结构,一般采用超低温冷冻的方式进行贮藏。
本研究的目的是找出不同冻藏温度对金枪鱼肉质构和生化特性的影响,质构与生化变化规律,同时摸索出既能保证金枪鱼肉原生态结构,又能够做到降低成本,降低消耗的最佳冻藏温度。本研究的数据为水产品加工保鲜技术提供一定的理论基础,为金枪鱼的冷藏保鲜和储藏运输提供技术支持。
1 材料与方法 1.1 材料与仪器材料: 黄鳍金枪鱼,舟山市越洋食品有限公司(新鲜,未经过冻结)。
主要仪器: TMZ型物性分析仪,美国Food Technology Corporation公司; TU1800PC紫外可见分光光度计,德国托利多仪器公司; PRO数显高速匀质机,德国托利多仪器公司; 凯氏定氮仪,德国托利多仪器公司。
1.2 实验方法黄鳍金枪鱼,去内脏,剔除淤血碎肉。先经过快速冻结,使产品中心温度在很短的时间内达到-18°C; 再取黄鳍金枪鱼肌肉,密封包装,分别放在在不同的冻藏温度下(-18,-25,-35,-45,-55,-65°C)冻藏6个月,每15d对其质构、生化特性、鲜度测定。每次取背部肌肉测定,为了去除超低温对实验结果影响,每次取出鱼肉放在4°C冰箱内解冻。
1.2.1 肌原纤维蛋白的提取与测定参考万建荣等(1993)方法进行提取。肌原纤维蛋白的定量采用考马斯亮蓝法测定。
1.2.2 K值测定ATP降解产物提取及测定参考(戚晓玉等,2001)。采用高效液相色谱法(HPLC)测定。洗脱液,A泵缓冲液(将0.05mol KH2PO4与0.05mol K2HPO4混合在一起,用H3PO4调节pH至6.6—6.8)94%,B泵6%乙腈,采用外标法定量(赵艳等,2009)。K值计算公式:
| K值(%)= $\frac{{{\rm{H}}xR + H{\rm{x}}}}{{ATP + ADP + AMP + IMP + {\rm{H}}xR + H{\rm{x}}}} \times 100\% $> |
测定条件参考戴志远等(2008)方法。利用物性分析仪,采用两次挤压(TPA)模式(图 1),测试探头型号P/25,测试前后、中速度分别为速度1mm/s,测试速度0.5mm/s,鱼肉压缩比60%。样品为鱼背部肉,规格2cm×3cm×3cm。测定样品的硬度、弹性指标。
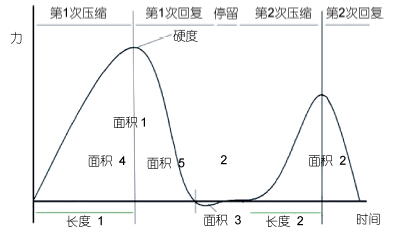 |
| 图 1 两次挤压模式与图形 Fig. 1 Twice squeeze mode and typical graph |
采用CR-400型色差仪,通过反射法测定a*值。通过测定a*值变化,反映样品中肌红蛋白含量的变化。
1.2.5 持水力(water-holdingcapacity,WHC)值测定 采用加压重量法。通过测定鱼肉前后质量变化,计算持水力值。
1.2.6 数据分析利用SPSS 17.0对实验结果进行处理与分析,实验结果为平均值±标准偏差。
2 结果与讨论 2.1 金枪鱼质构特性的变化通过测定金枪鱼硬度和弹性两个指标来反映其质构变化,分别见图 2和图 3。
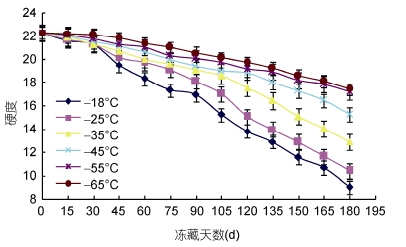 |
| 图 2 金枪鱼肉硬度变化Fig. 2 Change of the hardness of Tuna |
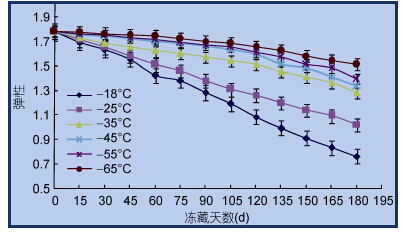 |
| 图 3 金枪鱼肉弹性的变化Fig. 3 Change of the springiness of Tuna |
硬度变化的大小,可以反映出鱼肉在咀嚼时质感变化程度,下降越多,质感越差。由图 2可以看出,在不同冻藏温度下贮藏,硬度都呈现下降趋势,冻藏温度高低决定硬度下降的程度。温度高低对硬度变化(P<0.05)显著。在-18°C硬度下降最快,下降61%; -25°C,下降54.3%; -35°C,下降44.9%; -45°C,下降33.2%; -55°C,下降23.4%; -65°C,下降22.1%。硬度的变化直接影响到鱼肉的质感,硬度下降得越快,质感下降越明显,保藏效果越差。鱼肉在冻藏过程中硬度变化受到肌肉中盐溶性蛋白含量的影响,蛋白质的变性程度也会影响鱼肉的硬度(Zhang et al,2009; Ruiz-Capillas et al,2002)。硬度下降的原因,一方面主要由于在冻藏过程中,肉里面的自由水被冻成冰,体积增大膨胀,形成体积较大冰晶,导致肌原纤维细胞被压缩变形,蛋白质三级、四级结构发生变化,以至于在解冻后鱼肉硬度下降; 另一方面由于在冻藏过程中ATPase活性逐渐降低,肌动蛋白变性比较明显所致(Chow et al,1985)。
弹性指在外力挤压或压缩后恢复原来的性能。肉中含有大量水和蛋白质,蛋白质与水形成网状结构,具有一定的抵抗外力的作用,这种力称为弹性。由图 3可以看出,-18°C与-25°C鱼肉的弹性变化很大,冻藏6个月后分别下降57.8%、46.5%; -35°C,下降26.9%; -45°C,下降23.1%; -55°C,下降17.1%; -65°C,下降15.3%。弹性的测定变化直接影响到肉的新鲜度(蒋予箭等,2002),也可衡量鱼肉的加工性能的好坏,弹性下降,加工性能变差,鱼肉弹性大小的测定是一项非常有意义的工作(Sato et al,1986; Vizcarra-Magaña et al,1999)。冻藏温度不同,弹性下降的速度也有明显差异。温度越低,弹性保持越好。弹性下降的原因,一方面是由于鱼体内从合成代谢转化为分解代谢,蛋白质等大分子物质在酶的作用下分解产生氨基酸等小分子物质; 另一方面是由于蛋白质结构遭到破坏而导致鱼肉弹性下降。
2.2 肌原纤维盐溶性蛋白含量的变化由图 4可知,冻藏温度对盐溶性蛋白含量变化影响显著(P<0.05); 冻藏温度的高低决定了盐溶性蛋白含量下降的速度和程度,也导致了蛋白质变性的程度。在-18°C下冻藏90d后,肌原纤维盐溶性蛋白含量为0; -25°C冻藏120d时,盐溶性蛋白含量接近为0; -35°C冻藏,在120d后下降较快; -45°C冻藏135d 后,下降趋势较快; -55°C与-65°C在冻藏180d 后分别下降到27.95 mg/g、30.85mg/g。金枪鱼肌肉中水分为第一大组分,蛋白质次之,蛋白质是鱼体内构成生物体,完成生理活动的重要物质。其中在肌肉蛋白之中,盐溶性蛋白含量占总蛋白含量60%以上,它的变化也是蛋白质变性的标志之一。盐溶性蛋白含量下降的原因,有人认为巯基氧化形成的二硫键导致盐溶性蛋白含量下降(Somjit et al,2005)。笔者认为,盐溶性蛋白含量下降,一是由冰晶机械作用引 起,导致肌原纤维破坏,在解冻后,盐溶性蛋白含量流失; 另外一个原因蛋白质冷冻变性后,形成碱溶性蛋白质所致(杨金生,2012)。
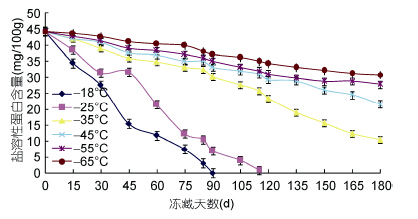 |
| 图 4 盐溶性蛋白含量的变化 Fig. 4 Change of the salt-solubility |
图 5表明,K值不断增高,相反鲜度逐渐下降。在-18°C冻藏,K值增加明显,在90d后,其K值接近50%,达到保鲜最大限度; -25°C冻藏90d K值接近40%,达到二级鲜度最大限度; -35°C冻藏180d,K值为39%,属于二级鲜度; -45°C冻藏6个月后,K值为35%; -55°C冻藏90d,K值为18%,-65°C冻藏6个月后,K值在17.1%,-55°C与-65°C冻藏后的金枪鱼仍然可以做生鱼片。国外很多学者以K值作为判断鱼新鲜度的一个准确指标,K值在20%以下可以做生鱼片,K值为50%,达到保鲜最大限度,60%—80%不能食用(王慥等,1993; 李学英等,2009; Hatful et al,2012)。Li等(2009)研究发现ATP降解的产物不但可以使盐溶性蛋白含量下降速度减缓,还对蛋白质有一定的保护作用,这与ATP降解产生的ADP、AMP、IMP有关。然而ATP降解产生次黄嘌呤核苷却能促进盐溶性蛋白含量下降,导致蛋白质变性(Li et al,2009)。冻藏温度越低,ATP分解能力越弱,HxR效果越不明显,这一结论有助于解释为何冻藏温度越低,鱼肉鲜度越好。
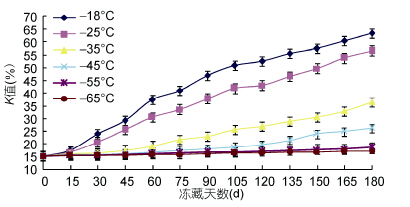 |
| 图 5 K值的变化 Fig. 5 Change on the K value |
肉的颜色变化,是消费者判断肉质好坏的指标之一。金枪鱼红色肉质,鱼肉中含有丰富的肌红蛋白,肌红蛋白含量的变化影响到鱼肉的a*值变化,肌红蛋白被氧化成高铁肌红蛋白,二价亚铁离子被氧化成三价铁离子成褐色,导致鱼肉褐变。从图 6可以看出,a*值下降程度与冻藏温度关系密切,冻藏温度越低,a*值下降越慢,鱼肉色泽变化越不明显。-55°C与-65°C冻藏6个月后,鱼肉从色泽上仍是红色,a*值变化不显著。-18°C冻藏一个月后,肉质为褐色,-35°C与-45°C冻藏6个月后,肉分别变成褐色与暗红色。肉的颜色变化程度与氧合肌红蛋白生成率密切相关,当氧合肌红蛋白生成率在20%、30%、50%、70%时,分别呈鲜红色、暗红色、褐红色、褐色(路昊等,2007)。
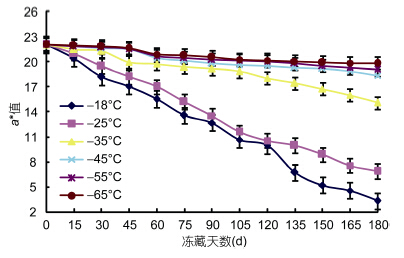 |
| 图 6 不同冻藏温度对金枪鱼颜色的影响Fig. 6 Effect of different storage temperatures on the K value of Tuna |
由图 7看出,持水力随冻藏时间延长而呈下降趋势。持水力的变化影响到鱼肉的水分含量、质地、风味。-18°C、-25°C、-35°C、-45°C冻藏6个月后,持水力分别下降到35%、43%、57%、64%,-55°C与-65°C冻藏6个月后,持水力下降到69%与71%,-55°C与-65°C持水力变化不显著。肌肉持水力靠蛋白质极化基团之间的作用力吸附周围水分子,水分子在被纳入到蛋白质的网状结构中。在冻藏过程中,蛋白质周围疏水与亲水结合键遭到破坏,使蛋白质亲和的水分子变成游离水流出,增加蛋白质凝聚变性的机会,因此导致蛋白质持水率下降(Benjakul et al,2003; 杨金生,2012)。
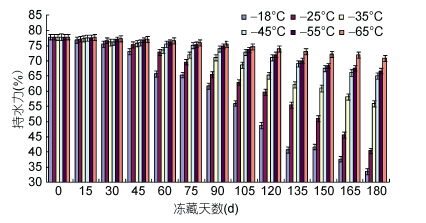 |
| 图 7 持水力的变化 Fig. 7 Change of the WHC of Tuna |
本文以黄鳍金枪鱼为研究对象,以金枪鱼的硬度、弹性、盐溶性蛋白含量、K值、a*为指标,研究不同冻藏温度对金枪鱼质构与生化特性有(P<0.05)显著影响。随着冻藏时间的延长,各指标均呈下降趋势,而且质地的变化与肌原纤维中盐溶性蛋白含量的变化呈正向关系。在-18、-25、-35、-45°C冻藏6个月后,无论在质构、颜色、鲜度、盐溶性蛋白含量方面与超低温-65°C相比有显著变化。-55°C与-65°C冻藏180d后除盐溶性蛋白含量的变化相对较大,质构、颜色、鲜度均无明显变化。通过衡量各个指标,对金枪鱼采用 -55°C,冻藏180d,既可以最大限度地保持金枪鱼的品质,又能节约能源。
| 万建荣, 洪玉菁, 奚印慈等, 1993. 水产食品化学分析手册. 上海: 上海科学技术出版社, 198—202 |
| 王 慥, 郭大钧, 冯 媛等, 1993. 鳙在不同保藏温度下的鲜度变化. 水产学报, 17(2): 113—119 |
| 边 涛, 赵 艳, 张 虹等, 2009. 凡纳滨对虾在不同冷藏条件下的品质变化研究. 水产科学, 28(9): 493—497 |
| 孙 丽, 2009. 金枪鱼肉在蒸煮过程中品质特性变化的研究. 无锡: 江南大学硕士学位论文, 1—2 |
| 李学英, 许 钟, 郭全友等, 2009. 大黄鱼冷藏过程中的鲜度变化. 中国水产科学, 16(3): 442—450 |
| 杨金生, 2012. 金枪鱼肌肉冷藏工艺的研究. 舟山: 浙江海洋学院硕士学位论文, 1—3 |
| 戚晓玉, 李 燕, 周培根, 2001. 日本沼虾冰藏期间ATP降解产物变化及鲜度评价. 水产学报, 25(5): 482—484 |
| 蒋予箭, 周 雁, 2002. 肉类弹性测定方法的研究. 食品科学, 23(4): 99—102 |
| 路 昊, 包建强, 2007. 黄鳍金枪鱼肉在不同冻藏温度下品质变化的动力学研究. 现代食品科技, 23(2): 5—7 |
| 戴志远, 崔雁娜, 王宏海, 2008. 不同冻藏条件下养殖大黄鱼鱼肉质构变化的研究. 食品发酵工业, 34(8): 188—191 |
| Benjakul S, Visessanguan W, Thongkaew C et al, 2003. Comparative study on physicochemical changes of muscle proteins from some tropical fish during frozen storage. Food Research International, 36(8): 787—795 |
| Chow C J, Ochiai Y, Hashimoto K, 1985. Effect of freezing and thawing on authorization of blue fin tuna myoglobin. Nippon Suisan Gakkaishi, (5): 2073—2078 |
| Hatful T, Kiesvaara M, 2012. Patterns of adenosine triphosphate catabolism as freshness indicator in fish species from the Baltic Sea. Journal of Science Food and Agriculture, 58(4): 485—488 |
| Kristiansen H G, Alabama M O, 2007. Muscle quality of yellow fin tuna (Thinness albacores) steaks after treatment with carbon monoxide gases and filtered wood smoke. Food Chemistry, 78: 347—354 |
| Li J R, Lu H X, Zhu J L et al, 2009. Aquatic products processing industry in China: Challenges and outlook. Trends in Food Science & Technology, 20(2): 73—77 |
| Ruiz-Capillas C, Moral A, Morales J et al, 2002. The effect of frozen storage on the functional properties of the muscle of volador (Illex coindetii). Food Chemistry, 78(2): 149—156 |
| Saito K, Ahhmed M A, Kawahara S et al, 2009. Effects of humidity-stabilizing sheets on the quality of bigeye tuna meat (Thinness obsess) during refrigerated storage. Food Science and Technology Research, 15(3): 283—292 |
| Sato K, Mandy S Y, 1986. Collage on the protein muscle of fishes in association with their swimming movement and meat texture. Bulletin of the Japanese Society of Scientific Fisheries, 52: 1595—1600 |
| Somjit K, Ruttanapornwareesakul Y, Hara K et al, 2005. The cryoprotectant effect of shrimp chitin and shrimp chitin hydrolysate on denaturation and unfrozen water of lizardfi shsurimi during frozen storage. Food Research International, 38(4): 345—355 |
| Vizcarra-Magaña L A, Avila E, Sotelo A, 1999. Silage preparation from tuna fish wastes and its nutritional evaluation in broilers. Journal of the Science of Food and Agriculture, 79(3): 1915—1922 |
| Woo J-W, Yu S-J, Cho S-M et al, 2007. Extraction optimization and properties of collagen from yellow fin tuna (Thinness albacores) dorsal skin. Food Hydrocolloids, (22): 879—887 |
| Zhang J J, Yan Q P, Ji R X et al, 2009. Isolation and characterization of a hepcidin peptide from the head kidney of large yellow croaker, Pseedosciaena croce. Fish & Shellfish Immunology, 26(6): 864—870 |
 2015, Vol. 46
2015, Vol. 46


