文章信息
- 宋敏, 刘为, 张鹰炯, 童晓倩, 李鹏, 王斌, 罗红宇. 2015.
- SONG Min, LIU Wei, ZHANG Ying-Jiong, TONG Xiao-Qian, LI Peng, WANG Bin, LUO Hong-Yu. 2015.
- 高效分解水产原料的菌株分离鉴定和组合发酵初探
- ISOLATION AND IDENTIFICATION OF STRAINS WHICH HAVE HIGH EFFICIENT DECOMPOSITION ON LOW-VALUE AQUATIC PRODUCTS AND EXPLORATION OF COMBINATION FERMENTATION
- 海洋与湖沼, 46(4): 800-807
- Oceanologia et Limnologia Sinica, 46(4): 800-807.
- http://dx.doi.org/10.11693/hyhz20150200056
-
文章历史
- 收稿日期:2015-03-07
- 改回日期:2015-04-21
2. 岱山县绿康源海洋生物技术有限公司 舟山 316200
2. Daishan County Green Health Source Marine Biotechnology Co. Ltd., Zhoushan 316200, China
随着水产品加工业的迅速发展,加工产量逐年递增的同时,产生了大量的下脚料,如鱼头、鱼皮、鱼鳍、鱼尾、鱼内脏、鱼骨、鱼胆、鱼鳔、虾壳、蟹壳、贝类及其残留鱼肉,其重量约占原料鱼的40%—55%(李晶,2012)。随着渔业资源的衰退,目前渔获物产量中有相当数量的低值杂鱼,这类杂鱼和水产下脚料统称为低值水产蛋白资源(以下简称低值水产品),其中的大部分作为初饲料被利用,部分甚至被废弃,不仅污染环境,还造成资源浪费(孙静等,2013)。低值水产品中含有丰富的营养物质和功能活性物质。目前,虽然国内对低值水产品开展了一些初级的利用,如将鱼头、鱼骨加工成鱼骨糊、鱼骨粉,从鱼内脏中提取鱼油等(孙晓莲,2009),但这些途径对下脚料的利用仍然较为低效低值,还会有剩余的下脚料被抛弃到环境中,因此亟待对低值水产品进行深度高值开发。
目前,国内外有关利用微生物降解石油、修复石油污染以及用微生物处理废水污水等(Moriarty et al,2012)已有较多报道,微生物利用动物粪便、稻壳、污泥和秸秆等发酵生产菌肥方面的研究也很多。如张士萍等(2008)从受石油污染土壤中筛选及驯化得到以机油为唯一碳源进行生长代谢的混合菌种,该混合菌种对高浓度含机油废水具有较强的降解能力。宋鹏等(2008)利用生活垃圾以及污泥混合物为原料,接入有机物料腐熟固体混合菌剂和有益菌群混合菌悬液,生产微生物菌肥。但有关利用微生物降解发酵低值水产品的报道在国内外较少。如辜澜涛等(2012)利用微生物对豆渣、鱼杂、鸡血等进行发酵处理,结果显示发酵液中的粗蛋白含量最高,营养价值也得到有效提高。本文从现有的一种组成未知的复合菌入手,对其进行分离纯化、鉴定以及发酵菌种的探究,从而确定可以降 解低值水产品的主要微生物类群以及发酵菌种配方,为进一步研究微生物发酵低值水产品制备菌肥奠定基础。
1 材料与方法 1.1 试验材料与仪器设备 1.1.1 未知复合菌由岱山县绿康源海洋生物技术有限公司提供。
1.1.2 低值杂鱼和水产下脚料购自舟山市第一渔业公司冷库。
1.1.3 培养基复合菌活化用培养基为液体肉膏蛋白胨培养基(0.5g牛肉膏,1.0g蛋白胨,0.5g氯化钠,水100mL,pH 7.2)。菌种活化用培养基为马铃薯葡萄糖琼脂(PDA)培养基和营养琼脂培养基,青岛高科技工业园海博生物技术有限公司。种子液制备用培养基为马铃薯液体培养基(将200g马铃薯去皮切碎,煮烂后取得土豆汁,加入20g葡萄糖或者蔗糖,加水至1000mL)和LB培养基(胰蛋白胨10g/L,酵母提取物5g/L,氯化钠5g/L)。发酵用培养基[10%(W/V)经绞碎的低值水产品,90%的蒸馏水]。
1.1.4 主要试剂和仪器宝生物DNA提取试剂盒,大连TaKaRa公司; PCR反应用的各种试剂,大连TaKaRa公司; 梅里埃API试剂条,北京三佳拓联科技发展有限公司; LDZX-50KBS立式压力蒸汽灭菌锅,上海申安医疗器械厂; HZQ-F160全温振荡培养箱,太仓市豪成实验仪器制造有限公司; SW-CJ-2F型双人双面净化工作台,苏州净化设备有限公司; BPS- 250培养箱,上海梅颖浦仪器仪表制造有限公司; 722G可见分光光度计,上海精密科学仪器有限公司; AR224CN电子分析天平,美国奥豪斯仪器(上海)有限公司; OLYMPUS CX21显微镜,上海优浦科学仪器有限公司。
1.2 实验方法 1.2.1 菌粉活化在超净台内称取0.1g菌粉添加到盛有50mL无菌的肉膏蛋白胨液体培养基的锥形瓶中,置于恒温摇床,28°C,120 r/min,培养24h。
1.2.2 菌种的分离纯化考虑到复合菌的广谱性,要想从中筛选出适合分解低值水产品的菌株,用一般的细菌、真菌分离培养来筛选无法达到目的,因此考虑用低值水产品制备分离用培养基来筛选出生长良好的菌株作为供试菌。
1.2.2.1 分离培养基的制备培养基成分: 取一定量的低值水产品,加入蒸馏水制成含原料分别为10%,5%,2%,1%,0.5%,0.1%的匀浆液,然后加入一定量的琼脂制成固体培养基。倒平板用于菌种分离,根据菌种生长情况来确定培养基中水产原料的最适浓度。
1.2.2.2 涂布分离纯化在无菌条件下,将活化的复合菌稀释至10-6,取不同稀释梯度的液体均匀涂布于对应标号的低值水产品固体培养基中,选择其中生长密度适宜的平板,根据菌落表面结构、形态、颜色、透明度及边缘等状况,用接种环挑取上面生长的单个菌落,多次划线分离得到的单菌落,用制备好的低值水产品试管斜面保存于4°C冰箱中,作为供试菌株用于后续实验。
1.2.3 菌种的鉴定 1.2.3.1 形态观察与镜检用接种环从低值水产品斜面培养基上取少量菌种,在低值水产品平板培养基上划线,培养后观察菌落的特征,培养特征观察参照文献(魏景超,1979; 东秀珠等,2001),菌株形态特征在光学显微镜下观察。
1.2.3.2 API试剂条法对菌株鉴定API20 C AUX: 将平板培养2—3d的菌体,用接种环取少许加入API suspension培养基(或0.85%生理盐水)混匀,使得溶液浓度为2Mcf,然后从中吸取100ul加入到API C培养基中,混匀后将液体分别加入相应试剂盒各孔内,(29±2)°C静置培养72h,分别在48h和72h时观察试剂盒各孔的变化,最后将实验结果输入apiwebTM鉴定软件进行分析。
API50 CHB/E: 将平板培养24h的菌体用无菌生理盐水洗两次后,加入API 50 CHB/E培养基(或0.85%生理盐水)混匀,然后将混有菌体的API 50 CHB/E培养基(或0.85%生理盐水)分别加入相应试剂盒各孔内,37°C静置培养48h,观察试剂盒各孔颜色的变化,最后将实验结果输入apiwebTM鉴定软件进行分析。
1.2.3.3 分子鉴定分别参照宝生物真菌和细菌基因组DNA提取试剂盒说明操作,完成菌种DNA提取。真菌扩增采用通用引物EF3(5’-TCCTCAAATGACCAAGTTTG-3’)和EF4(5’-GGAAGGGRTGTATTTATTAG-3’)(White et al,1990); 细菌扩增采用通用引物27F(5'-AGAGT TTGATCMTGGCTCAG-3')和1492R(5'-TACGGYTAC CTTGTTACGACTT-3')(武香玉等,2012)。PCR扩增体系(25μL): 10μL ddH2O,12.5μL PCR-mix,引物各1μL,0.5μL模板。PCR扩增程序: 预变性95°C、5min; 94°C变性1min,55°C退火1.5min,72°C延伸2min,共30个循环; 72°C最终延伸10min(Andrew et al,2011;Bernardi et al,2000; Chen et al,2010)。扩增产物用含EB的1%琼脂糖凝胶电泳检测、拍照。纯化的目的DNA送美吉生物工程(上海)股份有限公司测序。将测序结果在GenBank中通过BLAST进行基因比对,获得相似度较高的序列后,与所测序列通过ClustalX进行多重序列比对,比对结果通过MEGA 4.0软件构建系统发育树(敖晓琳等,2011)。
1.2.4 菌株生长曲线的测定主要通过分光光度计,采用光电比浊计数法测定菌液浓度(郑朝成等,2012)。将被测菌用相应平板进行活化,然后用接种环取一环已活化的菌株接入装有50mL相应种子液培养基的锥形瓶中,于28°C,160 r/min振荡培养,每隔2h测定菌株各个时间点的吸光值(OD600)大小。以培养时间为横坐标,OD600值为纵坐标作图,并将各点连接成一条平滑曲线,即为该菌在相应液体培养基中,28°C、160 r/min条件下培养的生长曲线。
1.2.5 单菌种发酵效果的测定将每种菌按发酵液5%接种量分别接入到含5g绞碎的水产原料和45mL水的250mL的锥形瓶中,混匀放入全温振荡培养箱,自然pH,28°C,160 r/min,发酵72 h后测定发酵液游离氨基酸态氮含量,每组三个平行。
氨基酸态氮标准曲线的制作见参考文献(彭爱红等,2002),样品游离氨基酸态氮含量的测定以参考文献(贾雅丽,2010)的方法进行。
1.2.6 发酵菌种组合筛选以各菌株的功能特性为基础,根据发酵原料特点和目标产物的要求,设计不同的菌株组合。每种组合按发酵液5%接种量接入到含5g绞碎的水产原料和45mL水的250mL的锥形瓶中,混匀放入全温振荡培养箱,自然pH,28°C,160r/min,发酵72 h后测定发酵液游离氨基酸态氮含量,每组三个平行。
2 结果 2.1 菌种分离培养基的确定观察菌株在不同培养基中涂布生长的情况表明,在水产原料含量为1%、0.5%、0.1%的三种培养基中菌落生长相似,个体很小,可能是培养基营养物质不够所致,但菌落密集无法计数; 在原料含量为10%、5%、2%的三种培养基中菌落生长也相似,菌落饱满个体较大,生长密集,无法计数。综合考虑菌种既能正常生长又可以节约原料,确定实验所用菌种分离培养基中水产原料的含量为2%。
2.2 菌种的初步鉴定结果混合菌种的稀释分离结果表明,稀释梯度为10-3、10-4时,菌落清晰相间,为适宜的稀释梯度,观察生长密度适宜的平板,根据菌株的形态差异,共分离得到4株菌,分别命名为菌株a、b、c、d。各菌种形态特征和显微特征见表 1。
| 菌种 | 菌落形态 | 显微特征 |
| a | 近圆形,表面湿润、稍有光泽,不透明,奶白色 | 细胞呈卵圆形,直径2—5μm,有分隔的假菌丝,革兰染色阳性 |
| b | 近圆形,表面略湿润,不透明,奶白色 | 细胞呈卵圆形,直径2—4μm,无假菌丝,无子囊孢子,革兰染色阳性 |
| c | 近圆形,表面粗糙,不透明,微黄色 | 细胞呈杆状,(0.7—0.8)μm×(2—3)μm,无荚膜,芽孢为椭圆到柱状,革兰染色阳性 |
| d | 近圆形,表面粗糙,不透明,白色 | 细胞呈杆状,(1—1.2)μm×(3—5)μm,无荚膜,芽孢圆形或柱形,革兰染色阳性 |
API生化试验条法对4株菌的生化性质具体鉴定结果见表 2和表 3,结果与反应鉴定表比对,并参考文献(魏景超,1979; 东秀珠等,2001)。由表 2可知,所分离到的菌株a 与标准菌株C and ida tropicalis性质基本一致,可认为a菌为热带假丝酵母。所分离到的菌株b 与标准菌株Cryptococcus laurentii性质基本一致,可判断b菌为罗伦隐球菌。由表 3可知,所分离到的菌株c与标准菌株Bacillus subtilis性质基本一致,可判断c菌为枯草芽孢杆菌或解淀粉芽孢杆菌(B.amyloliquefaciens)。所分离到的菌株d与标准菌株Bacillus cereus性质基本一致,可判断d菌为蜡样芽胞杆菌。
| Biochemical assays | a | b | C and ida tropicalis | Cryptococcus laurentii |
| GLU | + | + | + | + |
| GLY | - | - | - | - |
| 2KG | + | + | + | + |
| ARA | - | + | - | + |
| XYL | + | + | + | + |
| ADO | + | + | + | + |
| XLT | - | + | - | + |
| GAL | + | + | + | + |
| INO | - | + | - | + |
| SOR | + | + | + | + |
| MDG | + | + | + | + |
| NAG | + | + | + | + |
| CEL | - | + | - | + |
| LAC | - | + | - | + |
| MAL | + | + | + | + |
| SAC | + | + | + | + |
| TRE | + | + | + | + |
| MLZ | + | + | + | + |
| RAF | - | + | - | + |
| HYPH | + | + | + | - |
| Biochemical assays | c | d | Biochemical assays | c | d |
| Control | - | - | GLY | + | - |
| ERY | - | - | DARA | - | - |
| LARA | + | - | RIB | + | + |
| DXYL | + | - | LXYL | - | - |
| ADO | - | - | MDX | - | - |
| GAL | - | - | GLU | + | + |
| FRU | + | + | MNE | + | - |
| SBE | - | - | RHA | - | - |
| DUL | - | - | INO | + | - |
| MAN | + | - | SOR | + | - |
| MDM | - | - | MDG | + | - |
| NAG | + | + | AMY | + | - |
| ARB | + | + | ESC | + | + |
| SAL | + | - | CEL | + | - |
| MAL | + | + | LAC | - | - |
| MEL | + | - | SAC | + | + |
| TRE | + | + | INU | + | - |
| MLZ | - | - | RAF | + | - |
| AMD | + | + | GLYG | + | + |
| XLT | - | - | GEN | + | - |
| TUR | + | - | LYX | - | - |
| TAG | - | - | DFUC | - | - |
| LFUC | - | - | DARL | - | - |
| LARL | - | - | GNT | - | - |
| 2KG | - | - | 5KG | - | - |
以16SrDNA和18S rDNA基因序列测定并与NCBI 数据库中的序列进行同源性比较,将同源性较高的典型菌株的序列用于构建系统发育树,如图 1和图 2所示。
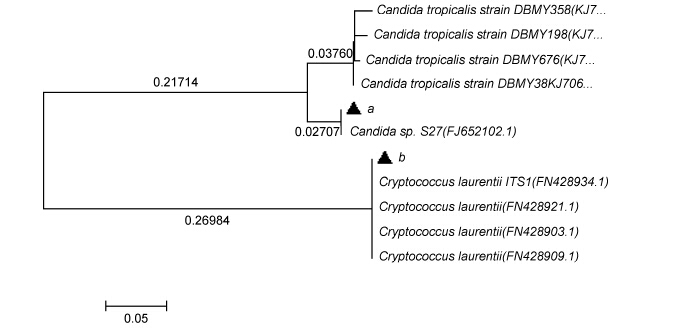 |
| 图 1 以18S rDNA序列为基础的2株菌系统发育树 Fig. 1 Phylogenetic tree of the 2 strains based on 18S rDNA sequence |
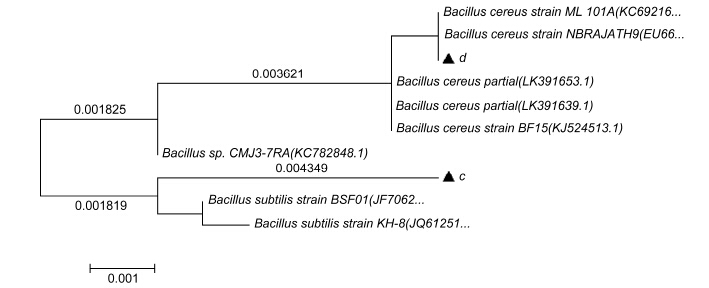 |
| 图 2 以16S rDNA序列为基础的2株菌系统发育树 Fig. 2 Phylogenetic tree of the 2 strains based on 16S rDNA sequence |
根据真菌18S rDNA序列构建的系统发育树可以看出,a菌株与标准菌株C and ida sp.亲缘关系最为接近,其18S rDNA的同源性达到99%,且与相应的标准菌株C and ida tropicalis的序列相似度为94%; b菌株与标准菌株Cryptococcus laurentii聚在一起,其18S rDNA的同源性达到100%。因此,结合菌株形态学特征、生长特性和生理生化特性,可以确定菌株a为热带假丝酵母C and ida tropicalis,菌株b为罗伦隐球菌Cryptococcus laurentii。
根据细菌16S rDNA序列构建的系统发育树可以看出,c菌株与标准菌株Bacillus subtilis 亲缘关系最为接近,其16S rDNA的同源性达到99%; d菌株与标准菌株Bacillus cereus聚在一起,其18S rDNA的同源性达到100%,因此,结合菌株形态学特征、生长特性和生理生化特性,可以确定菌株c为枯草芽孢杆菌Bacillus subtilis,菌株d为蜡样芽胞杆菌Bacillus cereus。
2.5 4 株菌的生长曲线4株菌各自在马铃薯液体培养基(菌株a和b)和LB培养基(菌株c和d)中的生长曲线,如图 3所示。
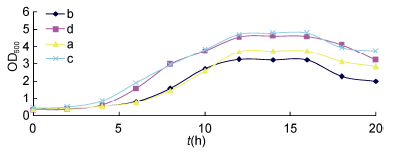 |
| 图 3 4株菌生长曲线 Fig. 3 The growth curve of 4 strains in potato medium or LB medium |
如图 3所见,4株菌的生长曲线表现出较为典型的4个特征时期: 延滞期、对数增长期(指数期)、稳定期和衰亡期。株菌c和d大约在接种4h左右进入对数生长期,OD值开始迅速上升; 菌株a和b大约在接种6h左右进入对数生长期,OD值开始迅速上升。由于养料、空间等问题,对数期结束后,菌种开始进入平稳期,从图 3中可以看出,这4株菌进入平稳期的时间大约都在12h左右。在衰亡期时,细胞死亡率增加,菌株少繁殖或不繁殖,4株菌进入衰亡期的时间也大约都在16h左右。
由于制备后续发酵所需的种子液需取至处于对数时期的菌种,通过图表可见,如需一同制备4株菌的种子液,只要取至培养时间在6—12h之间的菌种即可。
2.6 游离氨基酸态氮标准曲线以OD值为横坐标,游离氨基酸态氮含量为纵坐标,得到游离氨基酸态氮标准曲线如图 4所示。经统计分析,得线性回归曲线为: y=121.98x-1.2967,R2= 0.9982,说明曲线可信度较高,可以运用(冯培勇等,2009)。
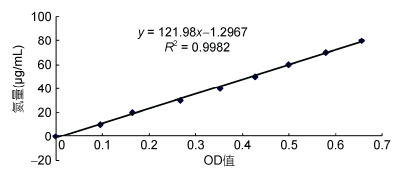 |
| 图 4 游离氨基酸态氮标准曲线 Fig. 4 St and ard curve of free amino acid nitrogen |
单菌种发酵低值水产品后游离氨基酸态氮的含量,如图 5所示。不同菌种发酵后游离氨基酸态氮的含量较对照组都有一定的上升,其中c菌株(枯草芽孢杆菌)和d菌株(蜡样芽胞杆菌)发酵后游离氨基酸态氮含量上升较多,约为4g/L。其次是a菌株(热带假丝酵母),发酵后游离氨基酸态氮含量上升2.365g/L。发酵效果最弱的是b菌(罗伦隐球菌),发酵后游离氨基酸态氮的含量仅上升1.068g/L。每种菌发酵低值水产品的能力各异,这可能与各种菌的特性和发酵过程中各菌种产生的酶的种类有一定相关性。此试验结果结合菌株解磷解钾固氮试验结果,可以为下一步设计不同菌株组合进行混合发酵奠定基础。
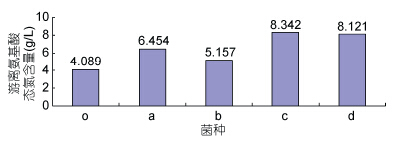 |
| 图 5 单菌种发酵效果 Fig. 5 The ferment effect of a single strain |
不同菌种组合混合发酵低值水产品后游离氨基酸态氮的含量,如图 6所示。不同菌种组合发酵后游离氨基酸态氮的含量较对照组均有明显上升,相比对照组分别上升了3.943、3.034、5.927、3.492、8.276、4.445、4.859g/L。其中,acd菌株组合发酵后游离氨基酸态氮含量上升最显著,效果明显优于其它组合的发酵效果,很有可能是当这三菌株共存在同一个环境时,可以达到一个良好的协同作用,互利共存状态。故可确定最佳发酵菌株配方为acd(热带假丝酵母+枯草芽孢杆菌+蜡样芽胞杆菌),下一步实验将选此最佳组合进行。
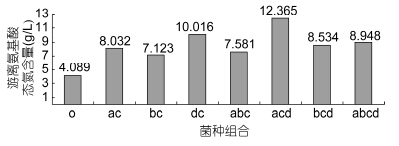 |
| 图 6 不同组合菌株发酵效果Fig. 6 The ferment effect of different strains combination |
低值水产品作为废物直接丢弃,不仅导致资源浪费、产品附加值低,而且造成海洋、陆地环境的严重污染(白福玉等,2007),这是水产养殖与加工业规模化与集约化发展过程中不可避免的一个现实问题。目前,利用微生物处理是一种较为简单易行和有效的方法,具有较好的应用前景。但要切实做好低值水产品的微生物发酵利用,关键在于如何筛选得到具有高效分解功能的微生物菌株。为此,本试验通过用低值水产品制备的分离培养基来筛选出生长良好的菌株作为优势菌,分离培养后,进行生理生化以及分子鉴定,最终从一种组成未知的复合菌中筛选得到4 株具有较好分解低值水产品作用的微生物菌株,分别为a热带假丝酵母、b罗伦隐球菌、c枯草芽孢杆菌、d蜡样芽胞杆菌,这为下一步微生物发酵奠定了 物质基础。
本实验中分离得到的菌株主要为芽孢杆菌和酵母菌,这说明降解低值水产品的主要微生物类群为这两大类。芽孢杆菌内生芽孢,繁殖能力强,有利于工业化生产,又是非致病细菌,对人畜无害,不污染环境。研究发现,芽孢杆菌属菌株广泛分布于自然界中,能抗许多不良环境(Garrity et al,2004)。且芽孢杆菌属细菌可以自身合成分泌胞外蛋白酶(Mehrotra et al,1999)、淀粉酶(Asgher et al,2007)、脂肪酶(Chen et al,2007)等酶类。芽孢杆菌属中的蜡样芽胞杆菌和枯草芽孢杆菌是目前应用较广的菌肥微生物,司丽娜(2012)从多种市售微生物肥料、植物根际土壤中进行微生物菌种分离筛选,其中芽胞杆菌和枯草芽孢杆菌被广泛应用于微生物菌肥的制备中。假丝酵母菌为酵母型真菌,通过发芽而繁殖,可形成假菌丝。假丝酵母是国内外研究较多的产脂肪酶、木糖醇的菌种(Silva et al,2012),以及在生产菌体蛋白等方面也有相关报道。张厚瑞等(2007)自木糖厂环境样品中分离出一株编号为1—18的高产木糖醇分离物,经鉴定该分离物属于为热带假丝酵母。另外,我国在利用假丝酵母等微生物以木薯渣(陈桂光等,1997)、秸秆(白坤等,1998)、玉米皮渣(郭维烈等,1996)为原料生产菌体蛋白方面也做了较多研究。隐球菌属下的物种通常栖息在土壤中,对人类无害。近年来,国内外在利用罗伦隐球酵母产胞外多糖、脂肪酶等方面研究较多,以及在水果采后病害的生物防治方面也有相关报道(Yurkov et al,2013)。梁宁等(2009)以蒜薹为试材,研究了罗伦隐球酵母对引起蒜薹采后病害的主要病原菌交链孢霉菌的生物防治作用,这显示了隐球酵母在蔬果病害防治方面存在巨大的应用前景。
复合微生物肥料是近年来研究较多的一种肥料,内含菌种数量较多,种类复杂,主要有放线菌、芽孢杆菌、酵母菌、霉菌等,这类产品种类多,应用较为广泛且效果显著。目前已经应用的复合微生物肥料有澳大利亚研制的由不同种的根瘤菌组成的复合根瘤菌肥料、美国的“生物一号”接种剂和日本“EM”等多个品种(葛诚,1994)。1994年我国山东省潍坊市从日本引进一种菌肥-酵素菌,它是从土壤和其它物质中分离出来并高倍繁育,由20多种有益微生物组成的菌种群体,可高效分解木屑及植物秸秆等物质,产生大量的腐殖质和可被植物吸收利用的氮、磷和钾及各种微量元素(谢明杰等,2000)。施用后,大大改善了土壤的性质,作物产量成倍增加。
由于进口商用复合菌的市场价格昂贵,工业化生产成本高,在我国农业应用中还未能普及。本试验从分离纯化所得的4株菌种出发,以各菌株的功能特性为基础,根据发酵原料特点和目标产物的要求,并进一步以游离氨基酸态氮为指标,通过单菌种发酵试验和多菌种组合发酵试验,得出多菌种混合发酵的效果明显优于单菌种发酵,且菌株组合acd(热带假丝酵母+枯草芽孢杆菌+蜡样芽胞杆菌)的发酵效果最好,可以作为发酵低值水产品制备菌肥的菌株配方,为后续发酵工艺研究、制备菌肥等提供思路。
4 结论利用低值水产品培养基从一种组成未知的复合菌中筛选出高效分解下脚料的菌株a、b、c、d。通过形态学、生理生化指标和16S rDNA、18S rDNA系统发育树构建等对其进行了鉴定。 就菌种的鉴定角度而言,现在普遍采用形态学指标结合分子生物学鉴定来进行综合鉴定,因此,可认为菌株a为热带假丝酵母,菌株b为罗伦隐球菌,菌株c为枯草芽孢杆菌,菌株d为蜡样芽胞杆菌。并以各菌株的功能特性为基础,根据发酵原料特点和目标产物的要求,以游离氨基酸态氮含量为指标,通过单菌种发酵试验和多菌种组合发酵试验,筛选出最佳发酵菌种组合为acd(热带假丝酵母+枯草芽孢杆菌+蜡样芽胞杆菌),为后续微生物菌肥的研制奠定了基础。
| 东秀珠, 蔡妙英, 2001. 常见细菌系统鉴定手册. 北京: 科学出版社, 62—64 |
| 白 坤, 赵国荣, 姜秀芳, 1998. 使用米糠糟生产蛋白饲料的技术方法. 饲料工业, 19(1): 17—19 |
| 白福玉, 郑 华, 蒋爱民, 2007. 低值水产品及水产副产品的加工与综合利用. 农产品加工?学刊, (4): 76—79 |
| 冯培勇, 赵彦宏, 张 丽, 2009. 响应面法优化黑曲霉产纤维素酶发酵条件. 食品科学, 30(23): 335—339 |
| 司丽娜, 2012. 微生物菌肥菌种分离、鉴定及混合发酵. 济南: 山东大学硕士学位论文 |
| 孙 静, 李 晔, 张春丹等, 2013. 响应面法优化双酶水解鲣鱼下脚料. 中国食品学报, 13(6): 104—110 |
| 孙晓莲, 2009. 低值水产品及加工废弃物的综合利用. 食品研究与开发, 30(3): 158—161 |
| 李 晶, 2012. 水产品下脚料高值化利用技术研究现状. 安徽农业科学, 40(22): 11435—11437 |
| 宋 鹏, 周美红, 陈五岭, 2008. 混合微生物菌群发酵菌肥工艺条件研究. 上海环境科学, 27(4): 156—161 |
| 张士萍, 郑广宏, 王 磊, 2008. 高效微生物菌群降解含机油废水研究. 环境工程, 26(2): 58—61 |
| 张厚瑞, 赵肃清, 蔡爱华等, 2007. 一株热带假丝酵母木糖醇高产新菌株的筛选. 食品科学, 28(6): 193—197 |
| 陈桂光, 庞宗文, 梁静娟, 1997. 木薯渣生料发酵生产单细胞蛋白的研究. 粮食与饲料工业, (6): 23—24 |
| 武香玉, 徐海燕, 辛国芹等, 2012. 一株乳酸菌的分离鉴定及生物学特性研究. 畜牧与饲料科学, 33(3): 1—3 |
| 郑朝成, 周立祥, 2012. 污泥中一株产耐高温蛋白酶菌株的分离、鉴定及酶学特性. 环境科学学报, 32(3): 577—583 |
| 敖晓琳, 张小平, 史 令等, 2011. 四川泡菜中两株优良乳酸菌的鉴定及不同发酵条件对其发酵泡菜品质的影响. 食品科学, 32(11): 152—156 |
| 贾雅丽, 2010. 分光光度法测定调味品中氨基酸态氮的研究. 食品研究与开发, 31(2): 153—154 |
| 郭维烈, 郭庆华, 1996. 用玉米淀粉厂废渣生产4320-15菌体蛋白饲料. 中国饲料, (5): 38—39 |
| 梁 宁, 李喜宏, 2009. 罗伦隐球酵母对蒜薹采后病害防治效果的研究. 保鲜与加工, 9(3): 12—15 |
| 彭爱红, 高 军, 2002. 分光光度法测定石决明口服液中的游离氨基酸氮. 食品研究与开发, 23(1): 57—58 |
| 葛 诚, 1994. 国外微生物肥料的研究和生产应用. 国外畜牧学——草原与牧草, (3): 6—12 |
| 辜澜涛, 董仲玺, 赵玉梅等, 2012. EM发酵豆渣、鱼杂、鸡血及其粗蛋白含量测定分析. 广西师范大学学报: 自然科学版, 30(1): 111—114 |
| 谢明杰, 程爱华, 曹文伟, 2000. 我国微生物肥料的研究进展及发展趋势. 微生物学杂志, 20(4): 42—45 |
| 魏景超, 1979. 真菌鉴定手册. 上海: 上海科学技术出版社, 114 |
| Andrew T, Calloway C D, Stuart S et al, 2011. A twin study of mitochondrial DNA polymorphisms shows that heteroplasmy at multiple sites is associated with mtDNA variant 16093 but not with zygosity. PLoS One, 6(8): e22332 |
| Asgher M, Asad M J, Rahann S U et al, 2007. A thermostable α-amylase from a moderately thermophilic Bacillus subtilis strain for starch processing. Journal of Food Engineering, 79(3): 950—955 |
| Bernardi G, Talley D, 2000. Genetic evidence for limited dispersal in the coastal California killifish, Fundulus parvipinnis. Journal of Experimental Marine Biology and Ecology, 255(2): 187–199 |
| Chen L, Bruford M W, Xu S X et al, 2010. Microsatellite variation and significant population genetic structure of endangered finless porpoises (Neophocaena phocaenoides) in Chinese coastal waters and the Yangtze River. Marine Biology, 157(7): 1453—1462 |
| Chen S X, Qian L L, Shi B Z, 2007. Purification and properties of enantioselective lipase from a newly isolated Bacillus cereus C71. Process Biochemistry, 42(6): 988—994 |
| Garrity G M, Bell J A, Liburn T G, 2004. Bergey’s Manual of Systematic Bacteriology (2nd ed). New York Berlin Heidelberg: Springer, 454 |
| Mehrotra S, Pandey P K, Gaur R et al, 1999. The production of alkaline protease by a Bacillus species isolate. Bioresource Technology, 67(2): 201—203 |
| Moriarty D J W, Decamp O, 2012. Microbial remediation of pollution in tropical coastal environments. Aquatic Ecosystem Health & Management, 15(3): 253—259 |
| Silva S, Negri M, Henriques M et al, 2012. Candida glabrata, Candida parapsilosis and Candida tropicalis: biology, epidemiology, pathogenicity and antifungal resistance. FEMS Microbiology Reviews, 36(2): 288—305 |
| White T J, Bruns T, Lee S et al, 1990. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. In: Innis M A, Gelfand D H, Sninsky J J eds. PCR Protocols: A Guide to Methods and Applications. New York: Academic Press, Inc., 315—322 |
 2015, Vol. 46
2015, Vol. 46


